上海地区非酒精性脂肪性肝炎患者肿瘤坏死因子-α的基因多态性研究*
李 莹 刘 洋 张 玮 邢练军 宋海燕 李运东 王育群
1.上海中医药大学附属龙华医院肝科 (上海,200032) 2.上海中医药大学 3.上海中医药大学附属曙光医院
近年来由于营养过剩、体力活动减少、较多高脂肪食物摄入、肥胖、2型糖尿病 (T2DM)、代谢综合征和久坐行为增加[1~4],脂肪肝发病率逐年升高,而其中非酒精性脂肪性肝炎 (NASH)被认为是全球的肝功能异常最常见的原因。在亚洲,非酒精性脂肪性肝病 (NAFLD)的患病率为12%~24%[5],而在美国,NAFLD的患病率大约是20% ~30%,NASH为3.5% ~5%[6,7]。自然史研究发现,肝纤维化和肝硬化的病情恶化只发生在NASH患者中[8]。细胞因子与氧化应激的相互作用诱导“二次打击”,在发展为脂肪性肝炎的过程中具有举足轻重的作用[9]。肿瘤坏死因子-α (TNF-α)是一种强效免疫调节剂和促进炎症的细胞因子,参与自身免疫性疾病和传染病的发病机制。TNF-α被证明在脂肪变性中参与干扰胰岛素信号,可能在NASH中具有促进炎症的作用[10]。研究证明两种不同的饮食结构诱导TNF受体Ⅰ基因缺陷的小鼠抵抗 NASH[11,12],而用 TNF-α 抗体治疗瘦素缺乏的小鼠可改善肝胰岛素抵抗和脂肪肝[13]。并且TNF-α启动子多态性-308位点罕见的等位基因与自身免疫性疾病和TNF-α的高含量有关[14]。基于此,本研究的目的在于分析上海地区NASH患者TNF-α的不同基因型的特征表现。
1 资料与方法
1.1 临床资料 NASH组共400例,男230例,女170例,年龄 (52.1±14.8)岁,为2009年1月-2011年6月期间就诊于上海中医药大学附属龙华医院和曙光医院的住院和门诊患者,均依据病史、临床症状和影像学等资料确诊。体检为健康人群入对照组,对照组50例同期健康体检者,男27例,女23例,年龄 (48.3±15.2)岁。NASH组与对照组在性别、年龄、民族等方面的差异均无显著性意义。
1.2 诊断标准 根据2006年中华医学会肝脏病学会关于《非酒精性脂肪性肝病诊疗指南》中NASH的诊断标准[15],纳入年龄在15~70岁的男性或女性,符合NASH诊断标准的患者纳入观察组;包括无饮酒史或饮酒折合乙醇量男性每周<140 g、女性每周<70 g;除外病毒性肝炎、药物性肝病、全胃肠外营养、肝豆状核变性等可导致脂肪肝的特定疾病;除原发疾病临床表现外,可有乏力、消化不良、肝区隐痛、肝脾肿大等非特异性症状及体征;影像学的表现符合弥漫性脂肪肝诊断标准,或肝脏组织学表现符合脂肪性肝炎诊断标准的依据等进行综合诊断。
1.3 标本采集和基因组DNA提取 研究对象均抽取外周静脉血3ml,EDTA.K2抗凝,保存在-20℃冰箱。采用TIANGEN公司 (中国)TIANamp Blood DNA Kit(离心柱型)试剂盒提取基因组DNA。基因组DNA保存在-40℃冰箱。
1.4 TNF-α基因型分析
1.4.1 G/A等位基因的序列特异性引物和-308位点PCR产物 采用PCR-RFLP(polymerase chain reaction and restriction fragment length polymorphism)法。引物序列参照文献[16]由上海生工生物技术公司合成。上游引物为:5'-AGGCAATAGGTTTTGAGGGCCAT-3';下游引物为:5'-TCCTCCCTGCTCCGATTCCG-3'。PCR扩增体系20μl,其中含10×反应缓冲液2μl(20mM MgCl2),dNTPs 0.5μl,引物各 0.4μl,Taq 合酶0.5μl(Fermantas)、模板DNA 50ng。反应条件:预变性95℃3分钟,变性95℃ 30秒,退火58.5℃ 30秒,延伸72℃ 30秒,循环30次,最后于72℃ 5分钟终止反应。取10μl扩增产物,用1μl限制性内切酶 NcoⅠ (Fermantas)37℃温育15分钟。酶切产物用3%琼脂糖凝胶 (含嗅化乙锭)电泳分离,紫外线投射仪检测拍照,观察带型并进行分析。
1.4.2 G/A等位基因的序列特异性引物和-238位点PCR产物 采用PCR-RFLP法。引物序列由 Primer软件设计,经上海生工生物技术公司合成。上游引物为:5'AGAAGACCCCCCTCGGAACC 3';下游引物为:5'CTGGAGGAAGCGGTAGTGGG 3';PCR扩增体系20μl,其中含10×反应缓冲液2μl(20mM MgCl2),dNTPs 0.5μl,引物各 0.4μl,Taq 合酶0.5μl(Fermantas),模板DNA 50ng。反应条件:预变性95℃3分钟,变性95℃ 30秒,退火60℃ 30秒,延伸72℃ 30秒,循环30次,最后于72℃ 5分钟终止反应。取10μl扩增产物,用1μl限制性内切酶 MspⅠ (Fermantas)37℃温育15分钟。酶切产物用3%琼脂糖凝胶 (含嗅化乙锭)电泳分离,紫外线投射仪检测拍照,观察带型并进行分析。
1.5 统计学方法 基因频率采用直接计数法,两组间的差异用χ2检验。按遗传平衡定律和χ2计算等位基因频率,通过计算比值比 (OR),对NASH与TNF-α各等位基因和基因型进行关联分析。所有数据处理采用SPSS16.0软件包处理。结果表示为均值±标准差,以P≤0.05(双侧检验)为差异有显著性意义。分别计算OR和95%可信区间 (95%CI)。
2 结果
2.1 TNF-α酶切后种基因型 TNF-α酶切后可分为3种基因型,-308、-238位点见图1、图2。-308位点:G/G型(终产物为87bp,一条带,G等位基因纯合子);G/A型 (终产物为107bp,87bp,两条带,杂合子);A/A型 (终产物为107bp,一条带,A等位基因纯合子)。-238位点:G/G型(终产物为131bp,一条带,G等位基因纯合子);G/A型(终产物为150bp,131bp,两条带,杂合子);A/A型 (终产物为150bp,一条带,A等位基因纯合子)。

图1 TNF-α启动子-308位点NcoI酶切后产物及分析

图2 TNF-α启动子-238位点MspI酶切后产物及分析
2.2 TNF-α基因多态性与NASH的相关性 TNF-α基因多态性经遗传平衡Hardy-Weinberg定律检验,NASH患者和健康对照者TNF-α基因型及基因频率分布达到遗传平衡,具有群体代表性。3种基因型在NASH患者和健康对照者中的分布情况见表1和表2,
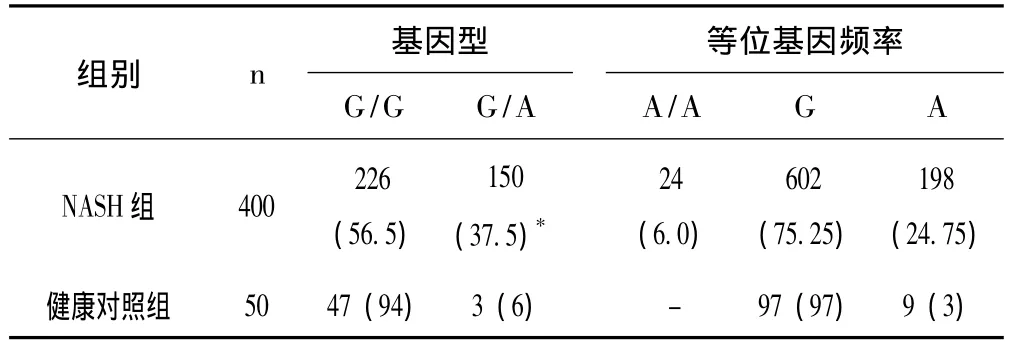
表1 两组人员TNF-α-308位点多态性频率分布[n(%)]
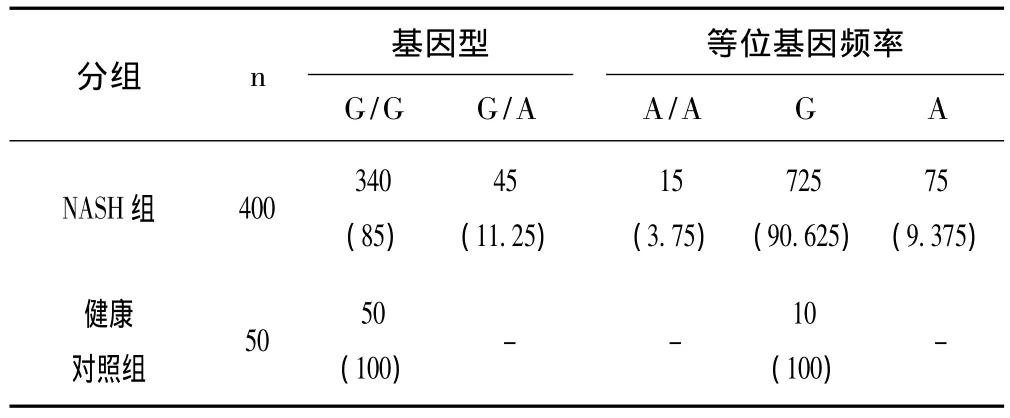
表2 两组人员TNF-α-238位点多态性频率分布[n(%)]
由表1、表2可见,TNF-α基因启动子区域-308多态性在NASH患者中,G/G型、G/A型和A/A型的基因型频率分布分别为 226(56.5%),150(37.5%)和 24(6.0%);TNF-α基因启动子区域-238多态性,在NASH患者中,G/G型,G/A和A/A型的基因型频率分布分别为340(85%),45(11.25%)和15(3.75%)。关联分析结果显示,NASH患者与TNF-α基因-308位点的基因多态性存在关联,OR为14.667。
3 讨论
目前研究提示,TNF-α基因启动子单核苷酸多态性影响TNF-α的表达,并与某些炎症性疾病或严重的疾病状态相关联。有研究发现在TNF-α启动子区域的两个位点 (-308,-238)发生鸟嘌呤 (G)到腺嘌呤 (A)的基因突变能影响胰岛素抵抗 (IR)和TNF-α在体外的表达[17],并与疾病易感性和严重性相关联。有关NAFLD发病机制最广泛接受的学说是“二次打击学说”。“第一次打击”中脂质在肝细胞的积累和胰岛素抵抗是脂肪肝发展的主要致病因素,“二次打击”导致肝细胞损伤,炎症和纤维化。抑制“二次打击”的因素是随后发生的的氧化应激和脂质过氧化,促炎细胞因子,脂肪因子和线粒体功能障碍[18]。有研究表明,TNF启动子区域的单核苷酸多态性 (SNP)可能是与NASH的“二次打击”相关[19]。TNF-α是引发肝损伤的各种细胞因子之一[20],这些炎性细胞因子在损伤肝细胞的同时诱导肝纤维化[21,22]。TNF-α可以诱导肝细胞类固醇调节元件结合蛋白1的表达,肝细胞脂肪酸合成和甘油三酯的积累[23]。TNF-α可以调整在肝细胞内毒素介导的解偶联蛋白 (UCP-2)mRNA的表达,导致肝细胞脂肪变性,敏感性增加,极易发生炎症和坏死[24]。在体外研究[14]认为,这些多态性的不同与TNF-α的产量,与疾病的易感性或严重程度,以及其他几种疾病相关。也有研究发现脂肪肝患者TNF-α-238位点基因多态性突变显著高于健康对照组[25]。最近有研究报道[26]与非洲冈比亚人相比,TNF-α启动子区域核苷酸-1031,-308,-238位点罕见的等位基因频率在中国汉族人群中较低。TNF-α基因启动子区第-308、-238位点的鸟嘌呤 (G)被腺嘌呤 (A)取代后,原来可被限制性内切酶NcoI,MspI识别的位点缺失,核苷酸序列不能被切断,因此产生3种基因型:GG(无突变),GA(突变杂合子),AA(突变纯合子)。G存在的等位基因是常见型,称为TNF1,是低产量表型,被A取代后的等位基因属少见型,称为TNF2,是高产量表型。TNF2表型的增多常与一些疾病相关。不同的肝脏疾病中起主导作用的突变位点也不相同[27]。本研究NASH患者中TNF-α基因-308位点TNF2基因型的分布明显比健康对照组增多,而对于TNF的基因多态性在NASH发病中的地位还需要更多的研究。综上所述,随着研究的深入,TNF-α基因启动子区的多态性的报道越来越多,但研究结果也不尽相同,本研究通过了解上海地区人群中NASH患者TNF-α基因多态性的分布,将进一步为研究我国汉族人群中TNF-α基因多态性与相关疾病的发生发展之间的关系提供理论依据,也将为NASH发病机制研究提供资料,有助于我们更深入地理解这些疾病在不同种族、不同地区间具有的不同的遗传基因背景的重要意义。
[1]ANGULO P.GI epidemiology:nonalcoholic fatty liver disease [J].Aliment Pharmacol Ther,2007,25(8):883-889.
[2]WILLIAMS R.Global challenges in liver disease [J].Hepatology,2006,44(3):521-526.
[3]ONG JP,YOUNOSSI,ZM.Epidemiology and natural history of NAFLD and NASH [J].Clin Liver Dis,2007,11(1):1-16.
[4]FAN JG,FARRELL GC.Epidemiology of non-alcoholic fatty liver disease in China [J].Hepatol,2009,50(1):204-210.
[5]FAN JG,SAIBARAT,CHITTURI S,et al.What are the risk factors and settings for non-alcoholic fatty liver disease in Asia-Pacific[J].Gastroenterol Hepatol,2007,22(6):794-800.
[6]WESTON SR,LEYDEN W,MURPHY R,et al.Racial and ethnic distribution of nonalcoholic fatty liver in persons with newly diagnosed chronic liver disease [J].Hepatology,2005,41(2):372-379.
[7]MCCULLOUGH AJ.The epidemiology and risk factors of NASH[M].In:Farrell GC,George J,Hall P,Mc McCullough AJ,ed.Fatty Liver Disease:NASH and Related Disorders.Oxford:Blackwell Publishing,2005:23-37.
[8]YOUNOSSI ZM,DIEHL AM,ONG JP.Nonalcoholic fatty liver disease:an agenda for clinical research [J].Hepatology,2002,35(2):743-52.
[9]HILL D,SHEDOLFSY F,MCCLAIN CJ,et al.Cytokines and liver disease[M].In:Remick D,Freidland J,editors.Cytokines in health and disease.2nd ed.New York:Marcel Dekker,1997:401-25.
[10]CRESPO J,CAYON A,FERNANDEZ-GIL P,et al.Gene expression of tumor necrosis factor alpha and TNF-receptors p55 and p75,in non-alcoholic steatohepatitis patients [J].Hepatology,2001,34(6):1158-63.
[11]AE.FELDSTEIN,N WWERNEBURG,A CANBAY,et al.“Free fatty acids promote hepatic lipotoxicity by stimulating TNF-α expression via a lysosomal pathway [J].Hepatology,2004,40(1):185-194.
[12]K TOMITA,G TAMIYA,S ANDO,et al.Tumour necrosis factor a signalling through activation of Kupffer cells plays an essential role in liver fibrosis of non-alcoholic steatohepatitis in mice [J].Gut,2006,55(3):415-424.
[13]Z.LI,S.YANG,H.LIN,et al.Probiotics and antibodies to TNF inhibit inflammatory activity and improve nonalcoholic fatty liver disease [J].Hepatology,2003,37(2):343-350.
[14]WILSON AG,SYMONS JA,MCDOWELLTL,et al.Effects of a polymorphism in the human tumor necrosis factor alpha promoter on transcriptional activation[J].Proc.Natl.A cad.Sci.USA,1997,94(7):3195-3199.
[15]Liver Diseases,Chinese Medical Association will fatty liver and alcoholic liver disease study group.Non-alcoholic fatty liver disease treatment guidilines [J].Practical Hepatology,2007,10(1):1-3.
[16]WILSON AG,DI GIOVINE FS,BLAKEMORE AIF,et al.Single base polymorphism in the human tumor necrosis factor alpha gene detectable by Nco1 restriction of PCR product[J].Hum MolGenet,1992,1(5):353.
[17]KROEGER KM,CAWILLE KS,ABRAHAM LJ.The-308 tumor necrosis factor-alphapromoterpolymorphism effectstranscription[J].Mol Immunol,1997,34(5):391-399.
[18]DAY CP,JAMES OF.Steatohepatitis:atale of“two hits” [J].Gastroenterology,1998,114(4):842-845.
[19]TOKUSHIGE K,TAKAKURA M,TSUCHIYA-MATSUSHITA N,et al.Influence of TNF gene polymorphisms in Japanese patients with NASH and simple steatosis [J].Hepatology,2007,46(6):1104-1110.
[20]TILG H,DEEHL AM.Cytokines in alcoholic and nonalcoholic steatohepatitis[J].N Engl J Med,2000,343(20):1467-1476.
[21]WARNE JP.Tumour necrosis factor alpha:a key regulator of adipose tissue mass [J].Endocrinol,2003,177:351-355.
[22]WIGG AJ,ROBERTS-THOMSON IC,DYMOCK RB,et al.The role of small intestinal bacterial overgrowth,intestinal permeability,endotoxaemia,and tumor necrosis factor alpha in the pathogenesis of nonalcoholic steatohepatitis [J].Gut,2001,48:206-211.
[23]ARIDLE,FELDSTEIN,NATHANW,et al.Free fatty acids promote hepatic lipotoxicity by stimulating TNF expression via a lysosomal pathway [J].Hepatology,2004,40(1):185-194.
[24]钱燕,范建高.TNF-α在非酒精性脂肪性肝病中的作用及其机制[J].国际消化病杂志,2006,26(4):266-269.
[25]L.VALENTI,A.L.FRACANZANI,P.DONGIOVANNI,et al.“Tumor necrosis factor alpha promoter polymorphisms and insulin resistance in nonalcoholic fatty liver disease”[J].Gastroenterology,2002,122(2):274-280.
[26]魏茂提,韩燚,何丽,等.中国汉族人群TNF-α基因启动子区的多态性研究 [J].中国免疫学杂志,2007,(6):518-621.
[27]黄健,李瑜元.非酒精性脂肪肝患者肿瘤坏死因子-α基因多态性研究[J].广州医学院学报,2004,32(4):24-26.

