非酒精性脂肪性肝炎大鼠肝组织过氧化物酶体增殖物激活受体α mRNA表达及清热化湿法对其影响的实验研究
刘林,严红梅 ,张赤志
(1.湖北中医药大学,湖北 武汉 430061;2.武汉市第七医院,湖北 武汉 430064;3.湖北省中医院肝病中心,湖北 武汉 430061)
肝细胞脂肪变性、坏死和肝组织的炎症反应、肝纤维化是非酒精性脂肪性肝炎(NASH)的主要病理特征[1]。研究发现,过氧化物酶体增殖物激活受体(PPARα)具有调节脂肪代谢和调节炎症、免疫以及细胞分化等作用,参与了NASH的发病机制[2]。笔者导师张赤志教授运用温病湿热证理论,结合NASH的发病机理和流行病学特点,选用清热化湿的代表性方剂王氏连朴饮加减治疗NASH,取得较好疗效。本研究旨在通过观察加减王氏连朴饮对NASH模型大鼠PPARα mRNA表达的影响,阐明清热化湿方防治NASH的作用机制,为本方在临床的广泛应用提供客观依据。
1 材料
1.1 药品 加减王氏连朴饮方组:黄连3g,厚朴6g,石菖蒲3g,法半夏3g,淡豆豉9g,炒栀子9g,丹参6g,赤芍6g组成,由湖北中医药大学国医堂制剂室制成水煎剂,浓缩、灭菌,1.2g/mL密封包装,置4℃冰箱保存备用,有效期1周。东宝肝泰(吉林通化东宝药业股份有限公司,批号040801)。
1.2 试剂 AST、ALT、TG,LDL试剂(南京建成生物工程研究所);PPARα原位杂交试剂盒(武汉博士德生物工程有限公司)。
1.3 仪器 全自动生化检测仪(Olympus Au560,日本);台式高温低速离心机(Gentrifuge5471,德国);恒温箱(S648型,上海医疗器械厂);721分光光度计;恒温箱(S648型,上海医疗器械厂);图像分析系统(EagelII型,USA)。
1.4 动物 清洁级SD大鼠,40只,雌雄各半,体质量(170±20)g(湖北省医学实验动物中心)。
2 方法
2.1 动物分组
所有大鼠正常喂养1周,随机分为4组,每组10只:正常对照组(A组)、空白模型组(B组)、加减王氏连朴饮组(C组)、东宝肝泰对照组(D组)。
2.2 模型建立及给药
A组大鼠普通饲料正常喂养。B、C、D组参考钟岚等[3-4]报道的方法配成高脂饲料(在普通饲料基础上加10%猪油、2%胆固醇)复制大鼠NASH模型。给药8周后B、C、D组继续用高脂饲料喂养同时,B组予生理盐水10mL/kg/d灌胃,每日1次;C组予加减王氏连朴饮混悬液2.4g/kg/d灌胃(清热化湿方相当于成人常规剂量的1/35),每日1次;D组予东宝肝泰混悬液0.09g/kg/d灌胃,每日1次。连续给药4周。
2.3 取材
A组大鼠普通饲料喂养12周。B、C、D组给药4周(即实验12周),末次给药后,禁食12h,处死大鼠,迅速自眼眶静脉丛取血,常规分离血清。将肝脏4℃生理盐水冲洗,在最大叶距边缘5mm处取小块肝组织。
2.4 指标检测
2.4.1 血清生化测定 用Olympus Au560全自动生化分析仪检测血清TG、TCH、LDL、ALT、AST水平。
2.4.2 原位杂交技术检测肝组织PPARα mRNA的表达 将肝组织用含4%多聚甲醛/0.1M PBS(pH7.0-7.6,中含有1/1000 DEPC)缓冲液固定2~4h后,脱水制取石蜡切片,然后脱蜡至无水。将切片放入胃蛋白酶中,于37℃消化30min,放入用1%多聚甲醛/0.1M PBS(pH7.0~7.6,中含有1/1000 DEPC)室温固定10min。每张切片滴加20μl预杂交液于38~42℃置于湿盒2h,每张切片滴加20μl PPARα寡核甘酸探针杂交液于38~42℃在恒温箱中杂交过夜。取出切片反复洗涤,滴加封闭液37℃30min,将切片与生物素化地高辛抗体37℃温育30min。滴加SABC室温30min,滴加生物素化过氧化物酶室温30min,DAB显色,苏木素复染,酒精脱水,二甲苯透明,封片。显微镜下观察显色结果及扫描记录。每张切片随机选择5个高倍(10×40)视野,每一视野经图像分析系统读取吸光度,将平均每视野的吸光度作为该标本切片的代表值(MOD),再计算出各组的均数。
PPARα寡核甘酸探针序列(靶基因 mRNA序列):
5'—AAGAGATGGGAAACATTCAAGAGAT TTCTC AGTCC—3'
5'—AGCTGTCCAGGCTCGGAGGGCTCTG TCATC ACAGA—3'
5'—ACCAG TACAG ATGAG TCCCC TGGCA ATGCA CTGAA—3'
3 结果
3.1 各组大鼠血脂和肝功能的比较 与模型组相比,东宝肝泰能明显降低 NASH大鼠的 TG,TCH水平(P<0.05)。加减王氏连朴饮组大鼠血清TG,TCH,ALT,AST明显降低(P<0.01),作用优于东宝肝泰组(P<0.05)。结果见表1。
表1 各组大鼠血脂和肝功能的比较(±s)
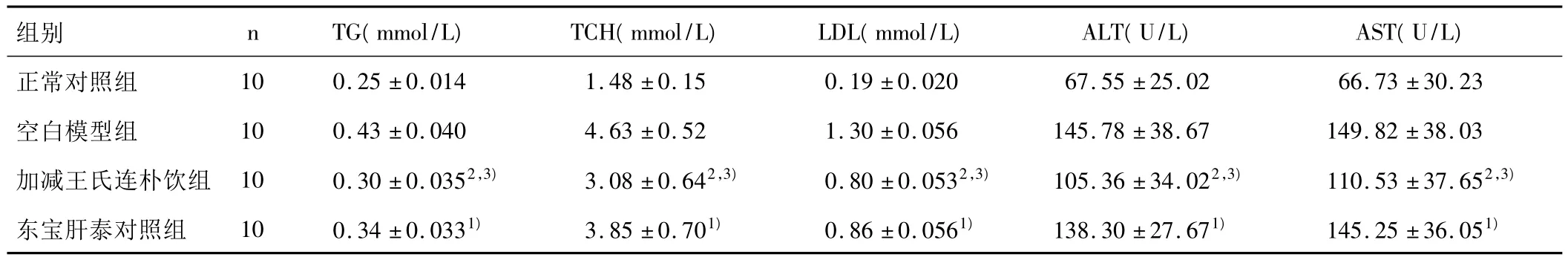
表1 各组大鼠血脂和肝功能的比较(±s)
注:与空白模型组比较,1)P <0.05,2)P <0.01;与东宝肝泰对照组比较,3)P <0.05。
组别 nTG(mmol/L)TCH(mmol/L)LDL(mmol/L)ALT(U/L)AST(U/L)正常对照组 10 0.25 ±0.014 1.48 ±0.15 0.19 ±0.020 67.55 ±25.02 66.73 ±30.23空白模型组 10 0.43 ±0.040 4.63 ±0.52 1.30 ±0.056 145.78 ±38.67 149.82 ±38.03加减王氏连朴饮组 10 0.30 ±0.0352,3) 3.08 ±0.642,3) 0.80 ±0.0532,3) 105.36 ±34.022,3) 110.53 ±37.652,3)东宝肝泰对照组 10 0.34 ±0.0331) 3.85 ±0.701) 0.86 ±0.0561) 138.30 ±27.671) 145.25 ±36.051)
3.2 PPARα mRNA 表达
原位杂交切片光镜下观察:各组大鼠肝组织切片PPARα mRNA皆有表达,于胞浆内弥散分布(图1),正常组表达最明显。图像分析结果见表2。
表2 各组大鼠肝组织PPARα mRNA表达的比较(±s)
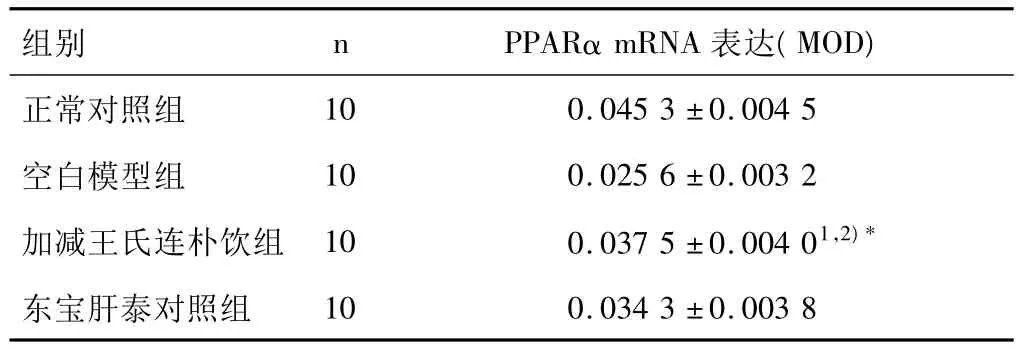
表2 各组大鼠肝组织PPARα mRNA表达的比较(±s)
注:与空白模型组比较1)P<0.01;与东宝肝泰组比较,2)P>0.05。
组别 nPPARα mRNA表达(MOD)正常对照组10 0.0453 ±0.0045空白模型组 10 0.0256 ±0.0032加减王氏连朴饮组 10 0.0375 ±0.00401,2)*东宝肝泰对照组10 0.0343 ±0.0038


图1 各组大鼠肝组织PPARα mRNA原位杂交染色
4 讨论
过氧化物酶体增殖物激活受体(PPARs)是一类由配体激活的核转录因子,有 PPARα、β(或 δ)和 γ3种亚型[5],是调节脂质代谢、胰岛素敏感性、炎症反应、细胞生长和分化的重要因子[6]。PPARα主要分布于与脂肪酸代谢密切相关的组织如肝脏、肾脏、心脏、肌肉等,PPARα可通过3种机制调节脂肪代谢,通过与配体结合后活化而发挥作用。和配体结合后被激活的PPARα和视黄醇X受体(retinoid X receptor,RXR)形成异二聚体,再与靶基因启动区域的过氧化物增殖反应元件(proxisome proliferator response element,PPRE)结合发挥转录调控作用[7]。目前认为,PPARα在脂质代谢中起着重要调节作用。PPARα不仅能诱导线粒体、过氧化物酶体及微粒体氧化酶体的产生,还能促使参与脂肪重新合成及与糖异生相关的酶的生成,从而加速肝脏脂肪酸的氧化,减少肝脏脂肪酸的含量[8-9]。PPARα 缺乏不仅加重 TG 在肝脏的沉积,还可引起脂质和碳水化合物的代谢紊乱。PPARα表达减少可导致与脂质代谢相关的酶基因转录水平降低,致使脂肪酸在肝脏氧化减少,加速脂质在肝脏沉积,从而促发 NASH 的发生发展[10-11]
笔者实验证实,NASH模型组大鼠肝组织PPARα mRNA表达明显减弱(P<0.01),血清 TG、TCH、LDL、ALT、AST水平却明显高于正常,表明PPARα的减少导致肝内脂肪酸代谢失衡,引起肝内脂质堆积,这可能是NASH发生的原因之一。与空白模型组相比,加减王氏连朴饮组血清TG、TCH、LDL、ALT、AST明显降低(P<0.01),脂肪变性和炎症活动程度明显改善(P<0.01),大鼠肝组织PPARα mRNA表达明显增强(P<0.05),提示加减王氏连朴饮可能通过激活 PPARα mRNA表达来调节脂质代谢及其他功能发挥防治NASH的作用。
[1] Fan J S,Zhuang H,Li YG,et al.Serotyping and genotyping of hepatitits B among HBsAg positive and negative hepatitis B patients in 8 cities of China[J].Zhonghua Weishengwuxue He Mianyixue Zazhi,1998,18:88-91.
[2] 黄颖秋.非酒精性脂肪性肝炎发病机制的研究进展[J].世界华人消化杂志,2009,17(31):3181-3188.
[3] 钟岚,范建高.非酒精性脂肪肝动物模型[J].国外医学·消化系疾病分册,1999,19(3):175-178.
[4] 谢晶日,杨芳,陈飞,等.保肝消脂颗粒对非酒精性脂肪肝大鼠肝组织瘦素的影响[J].中医药学报,2010,38(4):31-33.
[5] Issemann I,Green S.Activation of a number of the steroid receptor superfamily by peroxisome proliferators[J].Nature,1990,347:645-650.
[6] Guan Y,Breyer MD.Targeting peroxisome proliferator-activated receptors(PPARs)in kidney and urologic disease[J].Minerva Urol Nefro1,2002,54:65-79.
[7] Juge-Auhry CE,Cottlicher M,Schmidt A,et al.Peroxisome proliferator-activated receptor mediates cross-talk with thyroid receptor by competition for retinoid X receptor[J].J Biol Chem,1995,270(30):18117-18120.
[8] Kallwitz ER,McLachlan A,Cotler SJ.Role of peroxisome proliferators-activated receptors in the pathogenesis and treatment of nonalcoholic fatty liver disease[J].World J Gastroenterol,2008,14:22-28.
[9] Tanaka T,Masuzaki H,Nakao K.Role of PPARs in the pathophysiology of nonalcoholoic fatty liver disease[J].Nippon Rinsho,2005,63:700-706.
[10] Akbiyik F,Cinar K,Ozsullu E,et al.Peroxisome Proliferator Activated Receptor-Alpha(PPAR-alpha)Expression Is Induced But Peroxisomal Enzyme Response To Clofibrate Is Blunted In a Rat Mod el Of Fatty Liver[J].Tuesday,2003,4:30.
[11] Kageyama H,Hirano T,Okada K,et al.Lipoprotein lipase mRNA in white adipose tissue but not inskeletal muscle is increased by pioglitazone through PPAR-gamma[J].Biochem Biophys Res Commun,2003,305(1):22.

