以离体肝灌流技术研究当归对黄药子肝毒性的保护作用
刘海洋,路瑞华,李伟,王加志
(1.黑龙江中医药大学佳木斯学院,黑龙江 佳木斯 154007;2黑龙江省中医研究院,黑龙江 哈尔滨 150036)
离体肝灌流技术最初由英国生理学家Trowell[1]于1942年创立,1951年Miller[2]改进了灌流方法。近年来,离体肝灌流(ILP)技术被广泛用于药理毒理学研究,在进行离体肝灌流实验时,灌流液中的药物未经肠道菌群代谢、消化酶及消化道上皮细胞的影响,化合物均以原形存在于灌流液中,直接与肝细胞相接触产生作用,排除体内其他细胞因子、激素等的影响。
1 实验材料
1.1 药物与试剂
受试药物购于黑龙江省药材公司,黄药子产地河北,经黑龙江省药检所鉴定为薯蓣科植物黄独(Dioscorea bulbifera L)的块茎。当归产地四川,经黑龙江省药检所鉴定本品为伞形科植物当归(Angelica sinensis(Oliv.)Diels)的干燥根。
黄嘌呤氧化酶测定试剂盒(南京建成生物工程研究所,20100929);ALT(长春汇力生物技术有限公司,2010042)。
供试溶液的制备:黄药子、当归饮片,头煎10倍量水,浸泡2h后,煎煮1h,二煎8倍量水,煎煮1h,合并煎液,浓缩为含黄药子0.44g/ml;当归0.88g/ml。并分别以相同条件制备黄药子配伍当归水煎液,1∶2配伍组1.32g/ml。
乳酸钠林格氏液(天津市大冢制药有限公司,8J79C);1640(德国贝尔);医用氧气(纯度大于99%,黑龙江佳木斯医用气体公司);EDTA(上海华舜生物工程有限公司);磷酸二氢钾、硫酸镁、碳酸氢钠、葡萄糖(天津市凯通化学试剂有限公司,GR)。
1.2 实验动物
雄性SD大鼠,50只,体质量(250±20)g,由黑龙江中医药大学药物安全评价中心(GLP)提供,动物质量合格证书号:医动字第01-10-2号。
1.3 Krebs-Ringer灌流液的配制
取市售的乳酸钠林格氏液1000ml,加入碳酸氢钠2100.25mg、EDTA-Na2186.12mg、葡萄糖 2199.68mg、磷酸二氢钾163.31mg、硫酸镁295.78mg,超声溶解,即得,4℃保存,临用前预热至37℃。
1.4 仪器
恒流泵(河北保定兰格恒流泵有限公司BQ50-1J,泵头WX10);752型分光光度计(上海第二分析仪器厂);电子pH计(上海康仪仪器有限公司PHB-8型);水浴锅(天津市泰斯特仪器有限公司,DK-98-1型,加热功率500W加热温度37~100℃,波动度±5℃)。
1.5 统计学处理
2 方法与结果
2.1 最佳灌流条件考查
以经氧气饱和及加热至37℃的灌流液非循环性灌流冲洗肝脏中的血液。分别以不同流速进行灌流,同时测定流出液pH值及ALT酶活性。见表1、表2。
表1 不同流量下各灌流组流出液的pH值变化情况(±s)
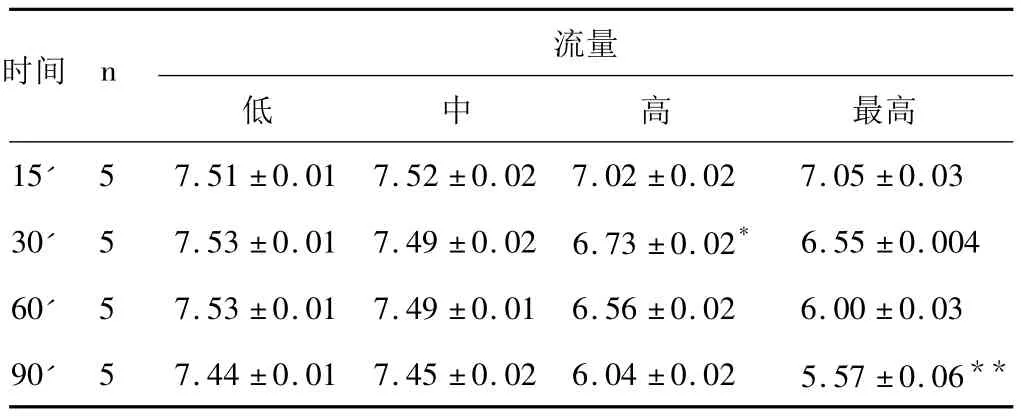
表1 不同流量下各灌流组流出液的pH值变化情况(±s)
注:高流速组与中低流速组相比,*P <0.05,**P <0.01。使用中低流速灌流过程中,pH值相对稳定,对肝组织内部结构基本无损伤。
时间n最高15' 5 7.51 ±0.01 7.52 ±0.02 7.02 ±0.02 7.05 ±0.03流量低中高30' 5 7.53 ±0.01 7.49 ±0.02 6.73 ±0.02* 6.55 ±0.00460' 5 7.53 ±0.01 7.49 ±0.01 6.56 ±0.02 6.00 ±0.0390' 5 7.44 ±0.01 7.45 ±0.02 6.04 ±0.02 5.57 ±0.06**
表2 不同灌流速度下各组流出液中ALT酶活性(U/L,±s)

表2 不同灌流速度下各组流出液中ALT酶活性(U/L,±s)
注:各流速组相比,*P <0.05,**P <0.01。以高流速灌流,在90分钟内,受试肝脏产生明显损害,差异有统计学意义。
组别90中 5 33.55 ±5.76 35.24 ±5.36 39.14 ±5.67 44.85 ±4.57高 5 41.24 ±3.67 51.94 ±4.67*65.24 ±7.67* 69.26 ±7.97*最高 5 52.49 ±3.81**63.24 ±5.83**67.34 ±8.97** 71.41 ±12.67 n15' 30' 60' 90'低 5 34.57 ±5.18 34.36 ±4.21 38.26 ±5.17 41.29 ±3.**
灌流90min后,中流量组肝脏外观呈土黄色,颜色均一,质柔软,无肿胀且在整个灌流过程中流出液pH值保持相对恒定,最适宜肝灌流研究。
2.2 离体肝灌流
离体大鼠肝灌流模型建立参照丁选胜的方法[3]。
2.3 取样时间
给药前为 0,给药后 15'、30'、60'、90'分别取样0.5ml,立即补入相应剂量的1640灌流液。
2.4 黄嘌呤氧化酶(XOD)测定方法按试剂盒说明
取样品0.1ml,加入各种试剂,混匀,置37℃水浴20min,加终止液1mL,混匀,于530nm,1cm 光径,以蒸馏水调吸光度零点,用752分光光度计读取各管的OD值。
2.5 结果
2.5.1 黄药子单煎液对大鼠灌流肝脏XOD活性的影响
取大鼠30只,随机分为三组,分别为高剂量组(4.4mg/ml)、中剂量组(2.2mg/ml)、低剂量组(1.1mg/ml)。结果见表3。黄药子单煎组不同剂量下酶活性相比较,XOD活性差异显著,有统计学意义。黄药子单煎液在低剂量时即可产生肝毒性,随着作用时间的延长,损伤作用更加明显。
表3 黄药子单煎液对大鼠灌流肝脏XOD活性的影响(±s)

表3 黄药子单煎液对大鼠灌流肝脏XOD活性的影响(±s)
注:高、中、低各剂量组各时间点 XOD 活性比较,*P <0.05,**P <0.01。
15' 30' 60' 90'低剂量 10 3.01 ±0.51 10.15 ±3.32 15.29 ±2.59 16.67 ±4.72 19.08 ±5.49组别n 0*中剂量 10 3.10 ±1.01 11.27 ±4.21 16.60 ±5.28 19.37 ±3.27 27.65 ±5.51**高剂量 10 3.00 ±0.87 12.65 ±3.94 17.98 ±3.25 23.56 ±3.49 38.55 ±6.30**
2.5.2 黄药子与当归配伍混煎液对大鼠灌流肝脏XOD活性的影响 结果见表4。
表4 配伍混煎液对大鼠灌流肝脏XOD活性的影响(±s)
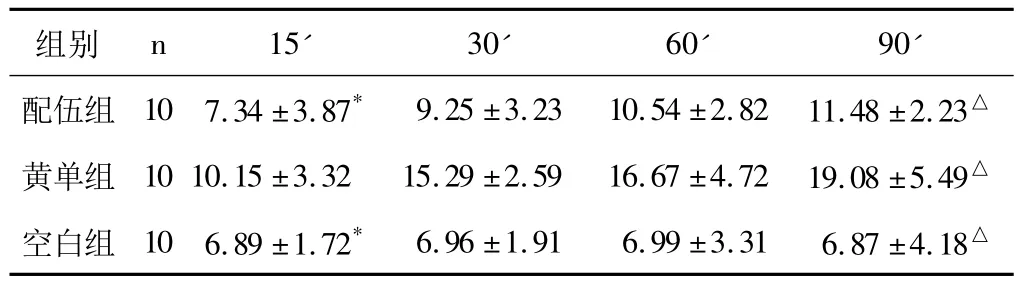
表4 配伍混煎液对大鼠灌流肝脏XOD活性的影响(±s)
注:配伍组与空白组相比较,*P>0.05;配伍组与黄药子组灌流30'-90'的酶活性比较,△P<0.05;说明黄药子与当归1∶2为减毒最佳配伍比例,具有保护肝细胞、降低肝损伤的作用。
n15' 30' 60' 90'配伍组 10 7.34 ±3.87* 9.25 ±3.23 10.54 ±2.82 11.48 ±2.23组别△黄单组 1010.15 ±3.32 15.29 ±2.59 16.67 ±4.72 19.08 ±5.49△空白组 10 6.89 ±1.72* 6.96 ±1.91 6.99 ±3.31 6.87 ±4.18△
2.5.3 灌流肝脏病理组织切片的光学显微镜观察结果见图1。
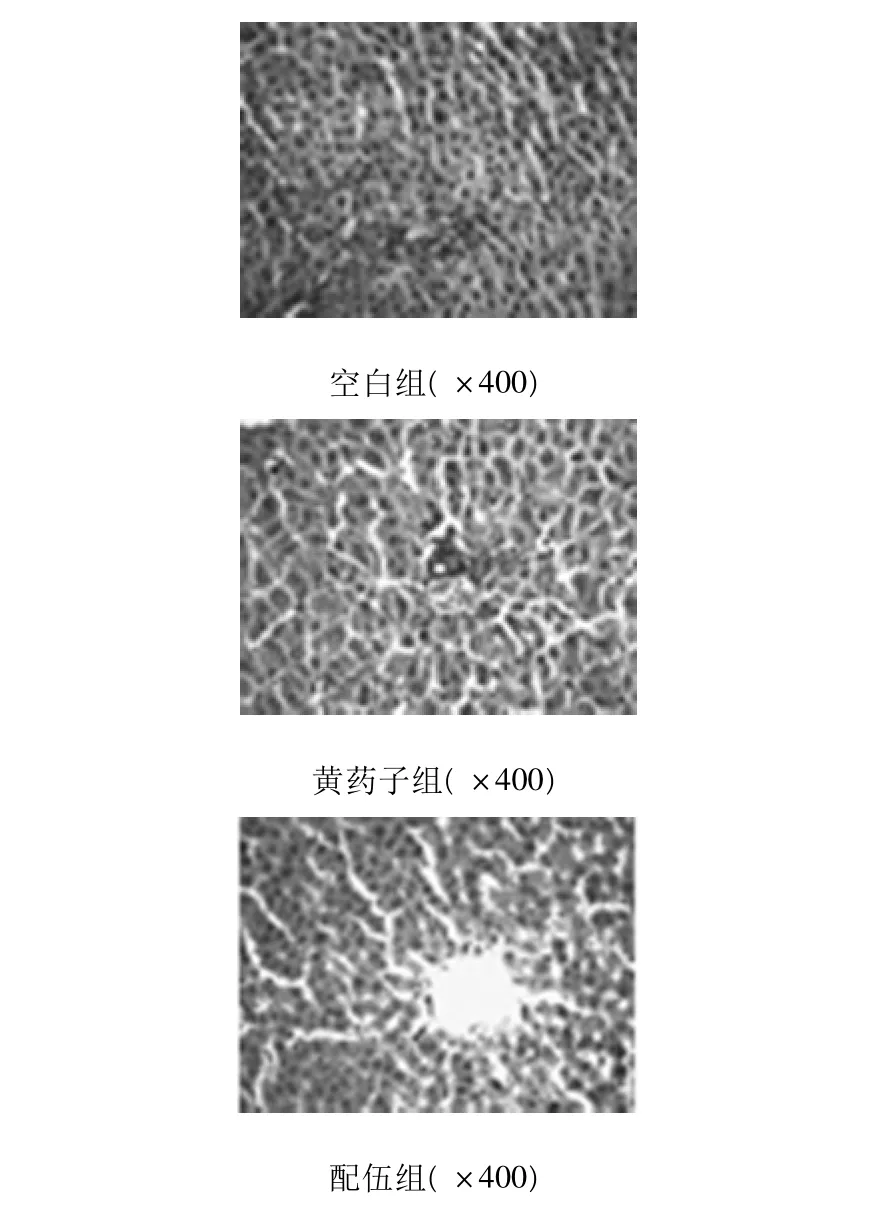
图1 灌流肝脏HE染色光学显微镜图
由图可知,空白组肝细胞索排列整齐,胞质染色均一,中央静脉结构清晰;黄药子组肝细胞肿胀溶合、排列紊乱、肝板消失、细胞界限不清、细胞核固缩、胞浆染色不均一、汇管区空泡变,小胆管扩张、水肿、并有大量炎症细胞浸润和脂肪滴形成。配伍组肝板沿中央静脉辐射状排列,肝板与肝血窦较清晰,病变呈局灶性,肝细胞个别出现肿胀及炎细胞浸润。
3 讨论
黄嘌呤氧化酶(XOD)是体内核酸代谢中一种重要的酶,其广泛分布于心、肺、肝脏、小肠粘膜等组织细胞浆膜内,血清中的 XOD主要来自于肝细胞,可反映肝细胞损伤且有特异性诊断意义[4]。肝组织内氧自由基增加愈明显,XOD活性明显降低,脂质过氧化物生成明显增加,对肝组织的损伤也越重。
超氧阴离子自由基的生成与黄嘌呤氧化酶活性呈正相关,自由基的大量生成造成严重的氧化损伤。结合病理组织学,本研究结果表明,黄药子中含有损伤肝细胞提高XOD活性的化合物,打破了机体对自由基生成和消除的平衡,造成肝组织的受损和细胞毒作用;以1∶2进行黄药子与当归进行配伍使用时,具有显著降低XOD活性的作用[5]。
[1] Trowell OA.The establishment and app lication of iso lated perfused rat liver preperation[J].J Physiol(London),1942,100:432.
[2] Miller LL.Biological synthesis of serum protein by the iso lated perfused rat liver[J].J Exp Med,1951,94:431.
[3] 丁选胜,李欧.海藻甘草及其相配伍后的水提取物的肝毒性研究[J].江苏中医药,2002,23(10):51-54.
[4] 赵远红,邵凤珍.黄嘌呤氧化酶与肝病关系的探讨[J].中西医结合肝病杂志,2005,15(3):188-190.
[5] 于栋华.黄药子配伍当归的减毒及机理的研究[D].哈尔滨:黑龙江中医药大学,2007:27-32.

