山羊绒毛干中线粒体DNA和核DNA的提取与PCR扩增
耿荣庆,周光现,韩旭峰,李 伟,李碧波,王小龙,陈玉林*
(1.西北农林科技大学动物科技学院,陕西杨凌712100;2.盐城师范学院生命科学与技术学院,江苏盐城224051)
动物毛发中不仅含有较为丰富的线粒体DNA(mtDNA),而且存在微量的核DNA(nuDNA)[1-3]。因此,毛发可以作为在DNA 分子水平上开展物种或个体鉴别、遗传多样性评估、分子进化分析等方面研究的重要生物材料。
羊绒是生长在山羊外表皮层,掩在山羊粗毛根部的一层薄薄的细绒,属于稀有的特种动物纤维。羊绒来源丰富,可以在活体上通过非损伤性取样直接获得,是一种非常易于采集、运输和保存的样品。有关羊绒DNA 的研究主要集中在运用mtDNA 标记鉴别山羊绒与绵羊毛方面,尚无nuDNA 提取与应用的相关报道[4-7]。本文探索从山羊绒毛干中样品中提取DNA(包括mtDNA 和nuDNA)的简便方法,结合采用PCR 扩增和电泳检测技术验证其可行性,为拓展羊绒样品在个体识别、遗传资源评价、分子进化和分子标记辅助育种等研究领域中的应用奠定基础。
1 材料与方法
1.1 毛样的采集与处理
用剪刀剪取陕北白绒山羊和太行黑山羊不同个体的体侧部毛样(不含毛囊)各8份,装入样品袋并编号,常温保存3d后-20 ℃冷冻备用。
1.2 羊绒毛干DNA 提取
从保存的16份毛样中分别取出一小份,将每份样品放入高压灭菌后的玻璃烧杯中;往每个装有毛样的烧杯中加入20mL 70%乙醇溶液,用镊子夹住毛样洗涤1~2min,夹出毛样用吸水纸吸干乙醇溶液;再将毛样用蒸馏水洗涤3次,夹出毛样用吸水纸吸去水份。从每份洗涤干净后的毛样中剔除羊毛,只保留羊绒,再将羊绒剪碎(约1~2mm)备用。
每份羊绒准确称取0.0001g,放入高压灭菌后的PCR 管中,加入50μL DNA 提取液。每100μL DNA 提取液包括10×PCR 缓冲液10μL(pH 8.4的Tris-HCl 100mM;KCl 500mM)、25mM MgCl28μL、10mg/mL 蛋白酶K 2μL 以及ddH2O 补足体积至80μL。
在PCR 扩增仪上设置单个循环程序(65 ℃30 min,95 ℃15min,4 ℃10 min),然后将含羊绒和DNA 提取液的PCR 管在PCR 扩增仪上运行该程序。程序运行结束后将PCR 管瞬时离心,Thermo NanoDrop ND-1000核酸蛋白定量仪测定溶液中的DNA 浓度,样品置于-20 ℃保存。
1.3 PCR 引物设计、扩增与检测
根据Kocher等[8]报道的通用引物,优化设计后用于扩增线粒体基因组上的12SrRNA 基因片段(目标大小为439bp),上、下游引物序列分别为5′-AAACTGGGATTAGATACCCCACTAT-3′和5′-GAGGGTGACGGGCGGTGTGT-3′。
根据Klungland等[9]发表的基因序列,设计用于扩增核基因组上的MC1R 基因片段(目标大小为267bp),上、下游引物序列分别为5′-CTCGTTGGCCTCTTCATAGC-3′和5′-GAAGTTCTTGAA GATGCAGCC-3′。
PCR 扩增体系为25μL,其中10×buffer 2.5 μL,25mmol/L MgCl22μL,10 mmol/L dNTP 2 μL,10pmol/L 引物各1μL,5 U/μL Taq 酶0.3 μL,DNA 模板1μL,剩余体积用灭菌超纯水补足。PCR 扩增条件为:94℃3 min;94℃1 min,60℃1 min,72℃1min,共35个循环;72℃延伸10min。
取2μL PCR 扩增产物经1%琼脂糖凝胶电泳检测是否有特异性目标条带后,采用凝胶回收纯化试剂盒(北京天根生化科技有限公司)纯化,送南京金斯瑞生物科技有限公司双向测序,结合观察测序峰图人工核对测序结果。
2 结果与分析
2.1 羊绒毛干DNA 提取结果
通过将清洗干净的羊绒无毛囊剪碎至1~2 mm 长度,在65℃温度和PCR 缓冲液作用条件下,一定浓度的蛋白酶K 就能够消化羊绒,使其释放出DNA 分子。核酸蛋白定量仪检测表明,从16个羊绒中都能够提取出一定量的DNA,且不同个体间的提取总量差异不显著,平均DNA 含量约为59.43±1.96ng/mL。
2.2 PCR 扩增与检测情况
从线粒体12SrRNA 基因扩增结果显示(图1),从16个DNA 样品中都能够特异性地扩增出明亮、单一的条带,而且与预期的大小一致。从核基因组的MC1R 基因扩增结果显示(图2),从16 个DNA 样品中都能够特异性地扩增出明亮、单一的目标条带,而且与预期的大小一致。
将扩增的12SrRNA 和MC1R 基因片段回收纯化后,直接进行双向测序。测序结果分别与山羊12SrRNA 和MC1R 基因全序列比对表明,所扩增的条带即为目标基因片段。

图1 12SrRNA 基因扩增片段的电泳图Fig.1 Electrophoresis picture of amplification fragment of 12SrDNA gene
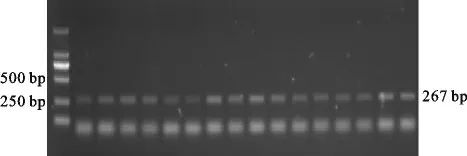
图2 MC1R 基因扩增片段的电泳图Fig.2 Electrophoresis picture of amplification fragment of MC1Rgene
3 讨论
动物毛发由毛干和毛根构成,其毛干由髓质层、皮质层和角质层共同组成。毛干中90%以上是由蛋白质组成,DNA 含量极低,导致DNA 提取与纯化困难,从而使得毛干这种极易取得的生物样品在分子生物学研究领域得不到有效利用。综合相关的文献报道表明[10-17],毛干DNA 提取的主要方法包括经典的酚-氯仿法、Chelex 100法、试剂盒法、PCR缓冲液-蛋白酶K 法以及多种组合方法。除了PCR缓冲液-蛋白酶K 法以外,其它方法都涉及到纯化、富集等步骤,比较繁琐且耗时较长,甚至部分方法试剂费用也相对较为昂贵。特别是由于多次使用各种化学试剂,会影响到后续PCR 扩增实验,试验稳定性较差,使相关分子生物学试验受到很大的限制。
本试验建立了一种从常温保存的山羊绒毛干中提取总DNA 的稳定试验流程,以PCR 缓冲液、MgCl2溶液和蛋白酶K 为裂解提取液,整个DNA的获取过程在PCR 扩增仪上完成,裂解后的溶液直接作为模板用于PCR 反应,具有方便、快速、高效的特点。由于所用的裂解提取液和后续PCR 扩增体系的成份相似,其中含有的Tris碱和PCR 缓冲液的pH 值能够在DNA 提取过程中起到保护DNA、防止降解的作用。由于简化了试验步骤,大大减少了DNA 在操作过程中的损失,提高了DNA 得率。此外,在提取之前的样品处理过程中,首先要用70%乙醇溶液漂洗去羊绒上附着的皮屑、油脂和杂物,防止提取出皮屑样品的DNA,然后再用蒸馏水洗涤羊绒3 次,以消除残留乙醇对DNA 的损伤。因此,通过PCR 扩增和测序验证表明,建立的提取方法不仅能够从羊绒毛干中提取出mtDNA 和nuDNA,而且能够有效地进行基因的扩增,将大大扩展无毛囊的羊绒作为生物材料的用途。
[1]Nozawa H,Yamamoto T,Uchihi R,et al.Purification of nuclear DNA from single hair shafts for DNA analysis in forensic sciences[J].Legal Medicine,1999,1(2):61-67.
[2]Andreasson H,Nilsson M,Budowle B.Nuclear and mitochondrial DNA quantification of various forensic materials[J].Forensic Science International,2006,164(1):56-64.
[3]Bekaert B,Larmuseau M H D,Vanhove M P M.Automated DNA extraction of single dog hairs without roots for mitochondrial DNA analysis[J].Forensic Science International Genetics,2012,6(2):277-281.
[4]金美菊,阮 勇,石东亮,等.单核苷酸多态性技术在羊绒、羊毛纤维鉴别中的应用[J].毛纺科技,2007,11:10-13.
[5]邵碧英,林志武,陈文炳,等.快速、高效的羊绒羊毛织品DNA提取方法的建立[J].生物技术,2009,19(5):38-39.
[6]Ji W,Bai L,Ji M,Yang X.A method for quantifying mixed goat cashmere and sheep wool[J].Forensic Science International,2011,208(1-3):139-142.
[7]Geng R Q,Yuan C,Chen Y L.Identification of goat cashmere and sheep wool by PCR-RFLP analysis of mitochondrial 12S rRNA gene[J].Mitochondrial DNA,2012,23(6):466-70.
[8]Kocher T D,Thomas W K,Meyer A et al.Dynamics of mitochondrial DNA evolution in animals:amplification and sequencing with conserved primers[J].Proceedings of the National Academy of Sciences of the United States of America,1989,86(16):6 196-6 200.
[9]Klungland H,Røed K H,NesbøC L,et al.The melanocytestimulating hormone receptor(MC1-R)gene as a tool in evolutionary studies of Artiodactyles[J].Hereditas,1999,131:39-46.
[10]Schreiber A,Amtmann E,Storch V,et al.The extraction of high-molecular-mass DNA from hair shafts[J].FEBS Letters,1988,230(1-2):209-211.
[11]Kalbe J,Kuropka R,Meyer-Stork L S,et al.Isolation and characterization of high-molecular mass DNA from hair shafts[J].Biological chemistry Hoppe-Seyler,1988,369(5):413-416.
[12]Takayanagi K,Asamura H,Tsukada K.Investigation of DNA extraction from hair shafts[J].International Congress Series,2003,1239:759-764.
[13]Mcnevin D,Wilson-Wilde L,Robertson J.Short tandem repeat(STR)genotyping of keratinised hair.Part 2.An optimised genomic DNA extraction procedure reveals donor dependence of STR profiles[J].Forensic Science International,2005,153(2-3):247-259.
[14]Barbaro A,Cormaci P,Barbaro A.Multiplex STRs amplification from hair shaft:validation study[J].International Congress Series,2006,1288:676-678.
[15]徐怀亮,汪宴廷,姚永芳,等.藏酋猴毛干DNA 的3种提取方法[J].东北林业大学学报,2010,38(2):58-61.
[16]Almeida M,Betancor E,Fregel R.Efficient DNA extraction from hair shafts[J].Forensic Science International Genetics Supplement Series,2011,3(1):e319-e320.
[17]管 政,陈爱亮.毛干DNA 提取方法概述[J].中国生物工程杂志,2012,32(10):128-134.

