辅色剂提高紫甘薯红色素的稳定性研究
孙晓侠,马 龙,王改玲,吴珊珊,许 晖
(蚌埠学院生物与食品工程系,安徽蚌埠233030)
紫甘薯(Ipornoea batatas L.)属旋花科一年生草本植物,薯肉呈深紫红色,富含天然红色素,是甘薯中特有的品种。文献报道,紫甘薯色素的主要成分是花青素及甲基花青素形成糖苷后的酰基化衍生物[1-2],紫甘薯花色苷具有抗氧化、抗肿瘤、抗突变、抗菌、抗衰老、保护肝脏、缓解高血压、高血糖和高血脂等生理功能[3-4],是一种很有开发利用前景的天然食药兼备的“功能性色素”资源。但紫甘薯红色素在实际应用中因存在应用不稳定性而限制了其使用范围,如热、光、氧气、酶、食品添加剂等均能引起色素的降解褪色[4],因此提高花色苷的稳定性成为研究热点。人们通过各种办法提高花色苷的稳定性,如利用辅色作用[5-6]、通过结构修饰[7]以及微胶囊化技术[8]等,目前的研究热点之一是在花色苷溶液中添加氨基酸、有机酸、生物碱、类黄酮、多酚、香豆素、肉桂酸衍生物等辅色剂来提高其稳定性[9-10]。目前,利用辅色剂提高紫甘薯红色素的稳定性的研究尚未见报道。为此,本研究从氨基酸、有机酸和类黄酮等中预选3种辅色效果较好的辅色剂,采用正交实验对辅色剂的组合和用量进行了优化,并对辅色前后色素的稳定性进行了比较,旨在为开发利用紫甘薯红色素提供理论依据。
1 材料与方法
1.1 材料与仪器
紫甘薯 市售;盐酸-L-半胱氨酸、单宁酸、没食子酸、柠檬酸、酒石酸、L-苹果酸、对羟基苯甲酸、蔗糖、L-谷氨酸、异抗坏血酸钠、苯甲酸钠、亚硫酸钠、L-脯氨酸、L-赖氨酸 均为市售;磷酸氢二钠、过氧化氢、FeCl3、A lCl3、CuCl2、CaCl2、FeCl2均为分析纯。
LSY型数显电热恒温水浴锅 北京医疗设备厂;722S型可见分光光度计 上海菁华科技仪器有限公司;T-214电子天平 北京赛多利斯仪器系统有限公司。
1.2 实验方法
1.2.1 紫甘薯红色素的制备流程[11]紫甘薯→清洗→切片→0.5%盐酸溶液浸提→过滤→AB-8大孔树脂纯化→真空浓缩→喷雾干燥→样品→备用
1.2.2 紫甘薯红色素辅色剂的预选 向1g/L色素水溶液中分别加入单宁酸、异抗坏血酸钠、柠檬酸、酒石酸、对羟基苯甲酸、L-苹果酸、没食子酸、蔗糖、L-谷氨酸、L-脯氨酸、盐酸-L-半胱氨酸、L-赖氨酸,以上试剂添加剂量均为1g/L,同时以1g/L色素水溶液为空白对照。室温放置30min,分别在400~600nm波长范围内进行光程扫描,记录最大吸光度值。
1.2.3 色素辅色剂组合及用量的确定 在辅色剂预选实验的基础上进行L9(33)正交实验,对提高紫甘薯红色素稳定化的辅色剂组合及用量进行确定。辅色剂用量的设计参考我国食品添加剂使用卫生标准(GB 2760-2011)[12]和文献[6]。正交实验因素水平设计见表1。
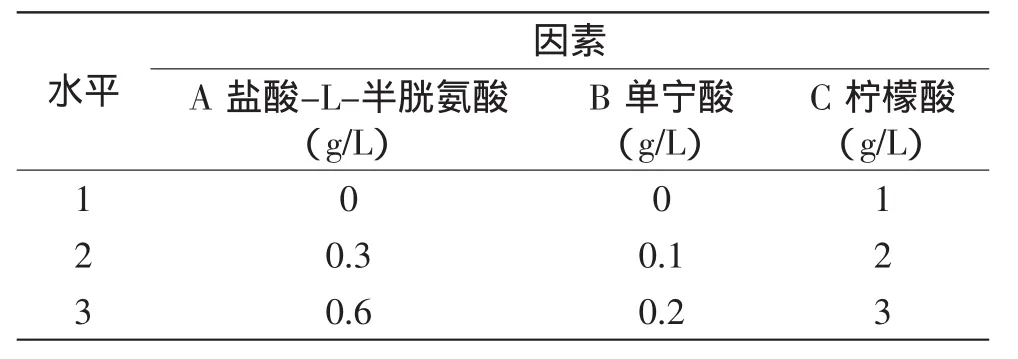
表1 正交实验因素水平表Table1 Table of factors and levels
1.2.4 加入辅色剂后紫甘薯红色素的稳定性 配制1g/L色素水溶液,分成两份,向其中一份加入最佳配方的辅色剂,进行稳定性对比实验。食品添加剂最大添加剂量的设计参考我国食品添加剂使用卫生标准(GB 2760-2011)[12]。
1.2.4.1 热对色素稳定性的影响 取1g/L色素水溶液,置于20、40、60、80、100℃下处理1h,每隔30m in取样1次,冷却至室温后,测定其在最大吸收波长处的吸光度值,并计算色素保存率R:R(%)=末吸光度值/初吸光度值×100。
1.2.4.2 光照对色素稳定性的影响 取1g/L色素水溶液分别置于室外自然光照射和室内暗处放置8h,每隔2h取样1次,测其在最大吸收波长处的吸光度值,并计算色素保存率R。
1.2.4.3 防腐剂对色素稳定性的影响 以苯甲酸钠作为防腐剂,分别配制剂量0~1g/L苯甲酸钠的色素溶液,室温放置2h,定期取样,测其在最大吸收波长处的吸光度值,并计算色素保存率R。
1.2.4.4 氧化剂对色素稳定性的影响 以H2O2作为氧化剂,分别配制剂量0~0.5g/L H2O2的色素溶液,室温放置2h,定期取样,测其在最大吸收波长处的吸光度值,并计算色素保存率R。
1.2.4.5 还原剂对色素稳定性的影响 以Na2SO3作为还原剂,分别配制剂量0~0.6g/L Na2SO3的色素溶液,室温放置1.5h,定期取样,测其在最大吸收波长处的吸光度值,并计算色素保存率R。
1.2.4.6 金属离子对色素稳定性的影响 分别配制剂量0~0.5g/L Fe3+、A l3+、Fe2+、Cu2+和Ca2+的色素溶液,室温放置1h,测其在最大吸收波长处的吸光度值,并计算色素保存率R。
2 结果与分析
2.1 色素辅色剂的预选实验结果与分析
由表2可见,在实验剂量下,与空白相比吸光度值增大最多的3种辅色剂依次为盐酸-L-半胱氨酸、单宁酸和柠檬酸。紫甘薯红色素溶液中加人单宁后产生了分子间辅色效应,稳定性得到提高,这与朱洪梅[5]、Bakowska[13]的研究结果一致。大量研究结果也表明柠檬酸能起到稳定花色苷构型的作用。花色苷一般可与类黄酮、生物碱、氨基酸和有机酸等产生分子间共色效应,使自身的稳定性大大增加,两者通过非共价结合,主要以氢键和疏水键为主,此种结合具有饱和性[10]。因此选用盐酸-L-半胱氨酸、单宁酸和柠檬酸做进一步实验。
2.2 色素辅色剂组合及用量的确定
正交实验结果与分析见表3。由表3可知,实验所考察的3个因素对色素的稳定性的影响程度依次为A>B>C,即盐酸-L-半胱氨酸>单宁酸>柠檬酸,色素辅色剂最佳组合及用量为A3B3C3,即盐酸-L-半胱氨酸0.6g/L、单宁酸0.2g/L、柠檬酸3g/L,按照此工艺参数进行验证实验,室温放置30m in时的吸光度值为0.668,这与正交实验中的各组相比,其吸光度值最大,即辅色效果最佳。
2.3 辅色剂对紫甘薯红色素稳定性的影响
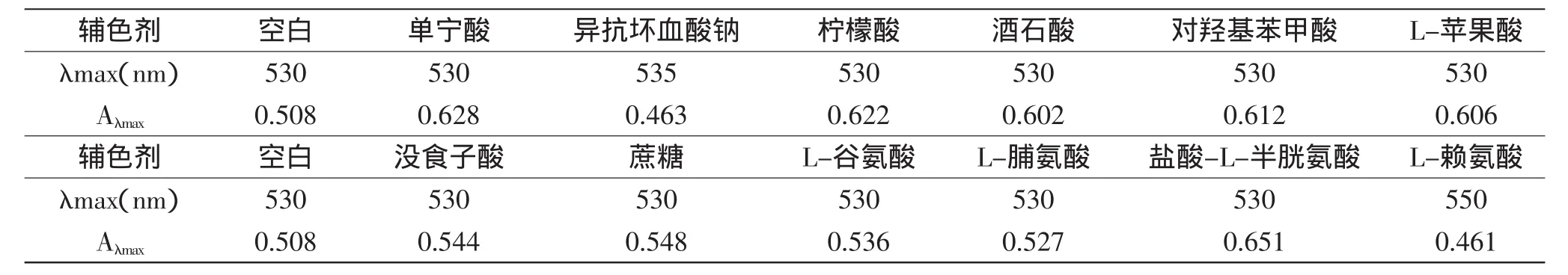
表2 色素辅色剂预选实验结果Table2 Results of preliminary experimenton co-pigments
2.3.1 热对色素稳定性的影响 由图1可知,随着温度的升高和加热时间的延长,色素的保存率下降,且当温度高于60℃时,其下降明显,色素的耐热性较差;加入辅色剂后,色素保存率均比对照有提高,在高温时较为明显,且随着加热时间的延长其下降趋势比对照也小。因此,加入辅色剂后,可以有效地提高色素对热的耐受性。
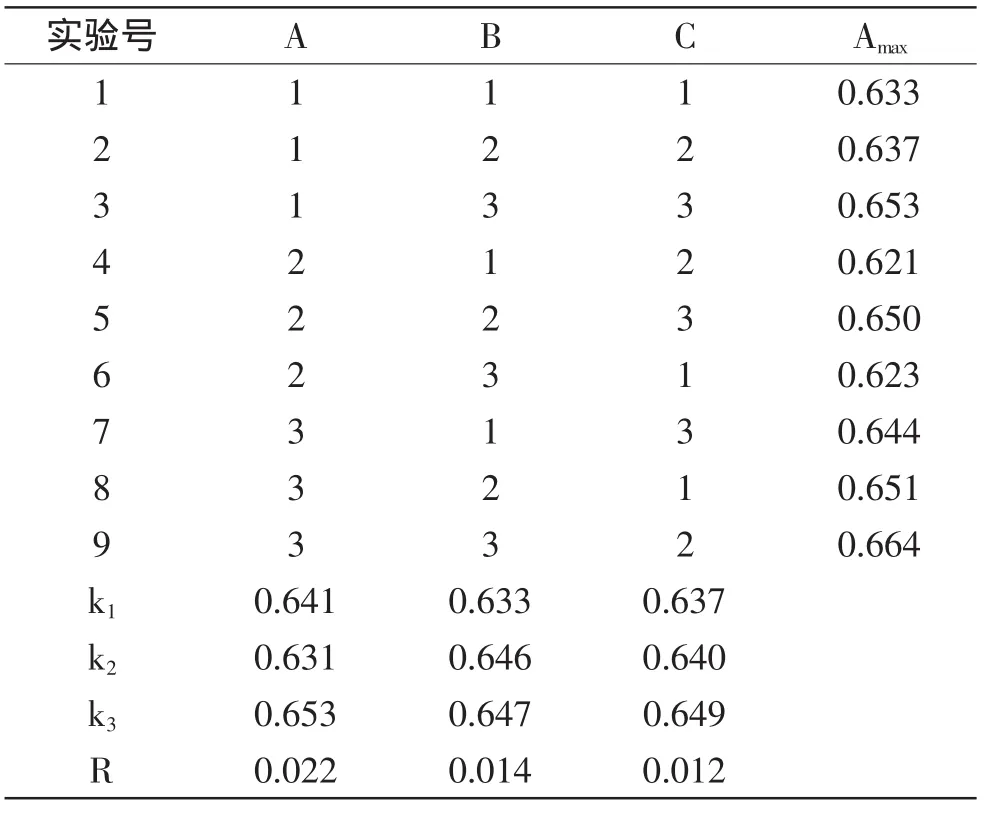
表3 L9(33)正交实验结果Table3 Results of L9(33)orthogonal experiment
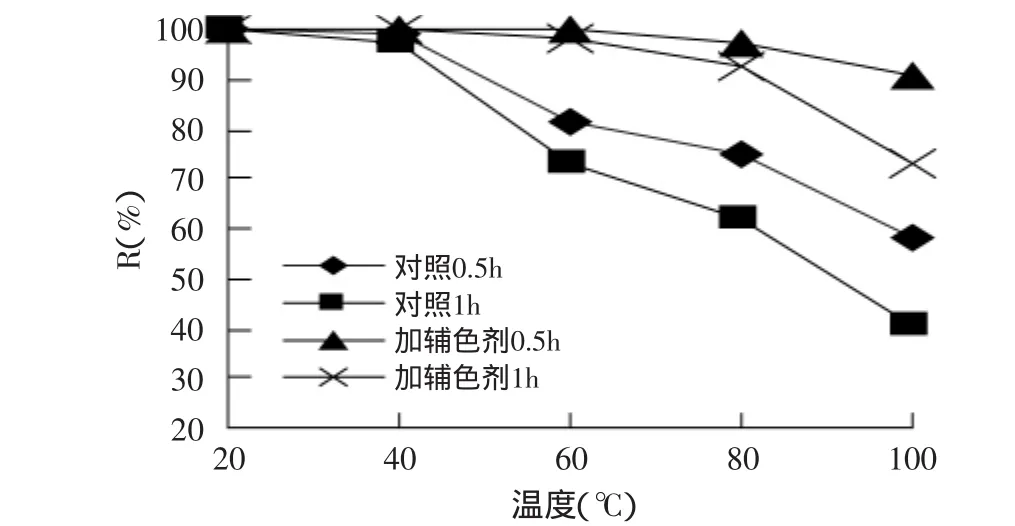
图1 加热对色素稳定性的影响Fig.1 Effect of heating on the stability of pigment
2.3.2 光照对色素稳定性的影响 由图2可知,色素样品在室内暗处条件下放置8h时,保存率为96.8%,加入辅色剂后保存率可达98.8%。不加辅色剂室外自然光下,随着照射时间延长,色素保存率急剧下降,8h时保存率仅为72.1%,可知色素耐光性较差,需避光贮存;加入辅色剂后,色素保存率始终高于对照,且下降趋势减缓,增加了色素的耐光性,照射8h时保存率为88.2%,比对照增加16.1%。
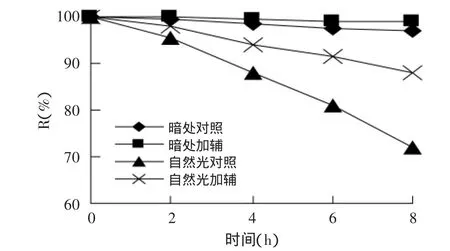
图2 光对色素稳定性的影响Fig.2 Effectof light on the stability of pigment
2.3.3 防腐剂对色素稳定性的影响 由图3可知,在实验剂量范围内苯甲酸钠对色素没有明显减色作用,尤其低剂量时对色素稳定性影响较小;加入辅色剂后,色素保存率略有提高,表明辅色剂对提高色素对苯甲酸钠的耐受性有一定作用,且随着时间的延长,这种作用越微弱。

图3 苯甲酸钠对色素稳定性的影响Fig.3 Effectof benzoate sodium on the stability of pigment
2.3.4 氧化剂对色素稳定性的影响 由图4可知,随着H2O2剂量的升高,色素保存率下降,且随着时间的延长,下降趋势变明显,但色素在低H2O2剂量下稳定性好;加入辅色剂后,色素保存率增大,表明辅色剂对提高色素的耐氧化性有一定作用。
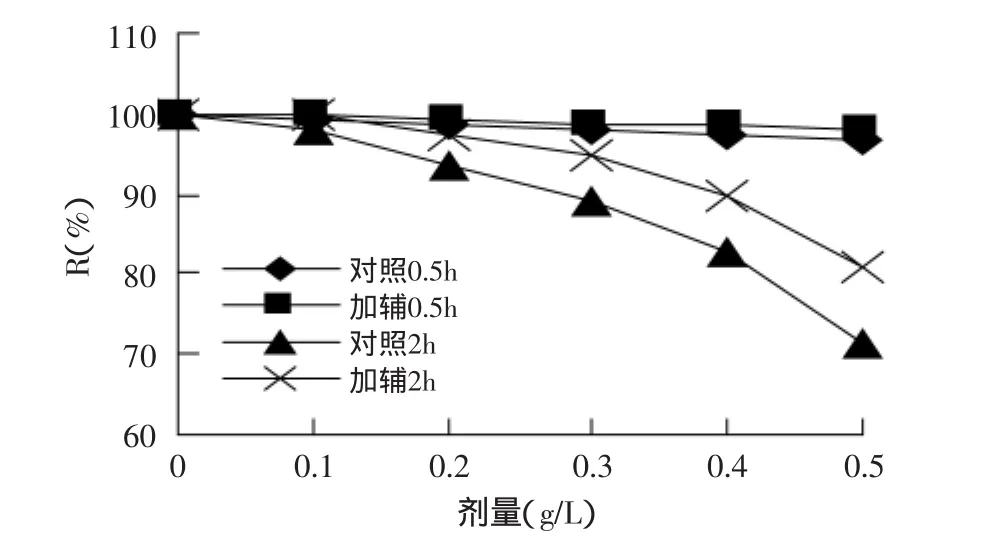
图4 H2O2对色素稳定性的影响Fig.4 Effectof H2O2 on the stability of pigment
2.3.5 还原剂对色素稳定性的影响 由图5可知,随着Na2SO3剂量的升高,色素保存率下降,且随着时间的延长,下降趋势越明显,褪色现象越严重,表明在实验剂量范围内,还原剂Na2SO3对色素的稳定性影响很大;加入辅色剂后,色素保存率变化不大,表明辅色剂对提高色素的耐还原性作用不大。
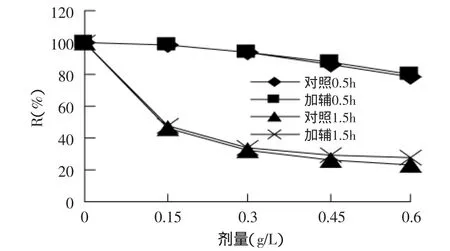
图5 Na2SO3对色素稳定性的影响Fig.5 Effectof Na2SO3 on the stability of pigment

表4 金属离子对色素稳定性的影响Table4 Effect ofmetal ions on the stability of pigment
2.3.6 金属离子对色素稳定性的影响 由表4可见,未加辅色剂时,Fe3+和A l3+对色素具有增色作用,且剂量越大,增色作用越明显,Fe2+和Cu2+对色素具有减色作用,且随着剂量增大,减色作用增强,Fe2+使色素保存率下降更明显,Ca2+对色素稳定性的影响不大;加入辅色剂后,均可提高色素对实验金属离子的稳定性,尤其减弱了Fe2+和Cu2+对色素的不良影响。
3 结论
辅色剂预选实验结果表明,辅色效果最好的3种辅色剂依次为盐酸-L-半胱氨酸、单宁酸和柠檬酸;正交实验优化的色素辅色剂最佳配方为盐酸-L-半胱氨酸0.6g/L、单宁酸0.2g/L、柠檬酸3g/L;加入最佳配方的辅色剂后,显著地提高了色素对热和光照的耐受性,提高了Fe3+和A l3+的对色素的增色效果,减弱了Fe2+和Cu2+对色素的不良影响,对防腐剂苯甲酸钠的耐受性影响不大,对提高色素的耐氧化和耐还原性稍有增加。使用辅色剂对紫甘薯红色素的稳定性有了较大的改进和提高,因此大大提高了其市场应用价值。
[1]TERAHARA Norihiko,SHIMIZU Takashige,KATOYoshiaki,etal.Six diacylated anthocyanins from the storage roots of purple sweet potato,Ipomoea batatas[J].Bioscience,Biotechnology and Biochemistry,1999,63(8):1420-1424.
[2]OKI Tomoyuki,MIYOSHI Ayako,GOTO Kazuhisa,et al.Determination of major anthocyanins in processed foods madefrom purple-fleshed sweet potato[J].Nippon Shokuhin Kagaku Kogaku Kaishi,2010,57(3):128-133.
[3]彭强,高彦祥,袁芳.紫甘薯及其花色苷的研究与开发进展[J].食品科学,2010(23):401-405.
[4]程琤,刘超,贺炜,等.紫甘薯花青素的稳定性及抗氧化性研究[J].营养学报,2011,33(3):291-296.
[5]朱洪梅,韩永斌,顾振新,等.单宁对紫甘薯花色苷的辅色作用研究[J].南京农业大学学报,2006,29(3):98-102.
[6]张智,宋静,王振宇,等.辅色素对蓝靛果花色苷稳定性的影响[J].食品工业科技,2011(4):320-323.
[7]李颖畅,李冰心,吕春茂,等.酰基化蓝莓花色苷的稳定性和对氧自由基清除能力[J].食品工业科技,2012,33(6):212-214.
[8]李颖畅,齐凤元,樊严蓝.莓花色苷的微胶囊化[J].食品与发酵工业,2010,36(6):71-75.
[9]李颖畅,齐凤元,樊严.提高花色苷稳定性的研究进展[J].中国调味品,2009,34(11):88-90.
[10]王锋,邓洁红,谭兴和,等.花色苷及其共色作用研究进展[J].食品科学,2008,29(2):472-475.
[11]吕晓玲,孙晓侠,姚秀玲.采用荧光化学发光法分析紫甘薯花色苷产品的抗氧化作用[J].食品与发酵工业,2005,31(9):53.
[12]卫生部卫生标准委员会.GB2760-2011食品添加剂使用卫生标准[S].北京:中国标准出版社,2011.
[13]Bakowska A.The effects of heating,UV irradiation,and storage on stability of the anthocyanin-polyphenol copigment complex[J].JFood Chem,2003,81(6):349-355.
