成年小鼠氯胺酮慢性中毒后脑细胞凋亡
杨菊,李小静,张志湘,陆凯明,卞士中
(1.复旦大学附属上海市第五人民医院病理科,上海 200240;2.苏州大学医学部法医系,江苏苏州 215123)
成年小鼠氯胺酮慢性中毒后脑细胞凋亡
杨菊1,李小静1,张志湘2,陆凯明2,卞士中2
(1.复旦大学附属上海市第五人民医院病理科,上海 200240;2.苏州大学医学部法医系,江苏苏州 215123)
目的研究不同持续时间和剂量下氯胺酮慢性中毒对成年小鼠脑细胞凋亡发生的影响。方法氯胺酮按不同剂量(4、10、20、30mg/kg)每周2次于成年小鼠尾静脉注射,建立小鼠氯胺酮滥用慢性中毒模型,氯胺酮连续注射1、2、4、8、12周后处死。采用透射电镜进行细胞凋亡的定性检测,以Caspase-3免疫荧光染色法和脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling,TUNEL)定量检测凋亡细胞数,推断凋亡发生的时间,并统计分析实验结果。结果氯胺酮染毒1周后,在透射电镜下见到脑组织海马及纹状体区域有明显的神经元凋亡,并持续至8周后;染毒1周可见Caspase-3高表达,4周后呈持续低水平表达;染毒1周后可见TUNEL阳性细胞较对照组明显增加,4周时仍处于高水平表达。结论氯胺酮尾静脉注射可致成年小鼠神经元凋亡。
法医病理学;中毒;氯胺酮;物质滥用,静脉内;细胞凋亡;Caspase-3;小鼠
氯胺酮作为一种新型毒品,目前被广泛滥用于各类休闲娱乐场所,并呈逐年增长的趋势[1-2]。目前关于滥用氯胺酮的相关文献报道较少,其慢性毒性作用的机制还不十分清楚。本研究采用成年小鼠尾静脉注射给药的方法,建立小鼠氯胺酮滥用慢性中毒模型,通过Caspase-3免疫荧光染色法和脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling,TUNEL)对小鼠脑细胞凋亡进行检测,研究不同持续时间和剂量下氯胺酮慢性中毒小鼠脑组织细胞凋亡的趋势及可能的途径。
1 材料与方法
1.1 材料
1.1.1 试剂
兔抗鼠Caspase-3多克隆抗体(武汉博士德生物工程有限公司),驴抗兔IgG(美国Sigma公司),TUNEL试剂盒(南京凯基生物科技发展有限公司),氯胺酮注射液(国药准字H32022820,批号KH071004,2mL:0.1g,江苏恒瑞医药公司)。
1.1.2 实验动物
昆明成年小鼠100只,雌雄不限,体质量22~28g,清洁级,由苏州大学医学部实验动物中心提供。
1.2 中毒模型的建立及分组
取健康成年昆明小鼠,氯胺酮经尾静脉注射,每周2次,建立小鼠氯胺酮滥用慢性中毒模型。按随机原则分为不同注射剂量(4、10、20、30mg/kg)的实验组以及1组对照组共5组,每组20只小鼠。各实验组在氯胺酮连续注射1、2、4、8和12周各取4只行断头处死。对照组在相同体积的生理盐水注射后1、2、4、8 和12周行断头处死。观察氯胺酮中毒小鼠的行为学表现。
1.3 方法
1.3.1 光镜检测
在小鼠断头处死后,取出脑组织并经生理盐水冲洗后投入10%中性甲醛溶液中固定24h,切取脑组织断面包埋,行石蜡包埋切片(4 μm),常规脱蜡至水,HE染色。采用Olympus BX45显微镜观察组织学形态。
1.3.2 透射电镜检测
在小鼠断头处死后,快速取海马及纹状体部约1mm×1mm×1mm大小的组织块,投入4%戊二醛中及1%锇酸双重固定。丙酮逐级脱水,树脂包埋。LKB-1型切片机(瑞典LKB公司)做超薄切片,厚度为50nm。枸橼酸铅染色。采用日立60型透射电镜(日本日立高新技术公司)观察氯胺酮注射后神经细胞凋亡的形成并进行摄片。
1.3.3 Caspase-3免疫荧光染色检测
已制作的脑组织石蜡包埋切片(4 μm),常规脱蜡至水。按试剂说明书进行Caspase-3免疫荧光染色检测,阳性物质呈红色荧光。
1.3.4 TUNEL检测
同1.3.3组织制备。按TUNEL试剂盒说明书操作,进行DNA原位末端标记,阳性物质呈绿色荧光。
1.4 图像分析及统计学处理
将Caspase-3免疫荧光染色及TUNEL检测结果用TCS SP2激光共聚焦显微镜(德国Leica公司)分析,对实验各组分别取5个视野进行细胞计数,统计阳性细胞数,数据用x ±s表示,并应用SPSS 10.0统计软件对结果进行t检验,检验水准α=0.05。
2 结果
2.1 氯胺酮中毒小鼠行为学表现
对照组小鼠无明显异常反应;实验组小鼠在氯胺酮注射后0~15 s内均呈现下述特征性的行为改变,持续时间10~300s。
随注射剂量不同,4 mg/kg组注射后出现口角和面部抽动,兴奋性增加;10mg/kg组出现口角和面部抽动及点头,兴奋性增加;20 mg/kg组出现口角和面部抽动及点头,前肢阵挛,有时出现后腿站立;30mg/kg组出现全身阵挛,跌倒,几乎不能站立。
在随时间改变的注射中,各实验组的行为强度减弱。4~20mg/kg组出现反应的时间更晚,持续时间变短。30mg/kg组出现的时间及持续时间变化不明显。
2.2 光镜及透射电镜检测结果
光镜下氯胺酮慢性中毒所致的一般组织病理学改变并不典型:脑组织结构正常,见少量出血,未见明显水肿,细胞形态结构正常,见胞核深染或无核改变。
透射电镜下观察见:对照组小鼠脑组织海马及纹状体组织正常。各实验组在首次注射1周后均可见处于不同时期的凋亡细胞。神经元细胞核内呈空泡样结构,细胞核固缩、边缘化,细胞核裂解为碎片(图1)。在4~20 mg/kg各组2~12周时,均可观察到海马及纹状体神经元凋亡。在30mg/kg组2~12周时,均未观察到明显的凋亡细胞。以上结果表明:小鼠氯胺酮中毒后可引起神经元凋亡,而在大剂量组(30mg/kg)至实验后期时,未观察到有细胞凋亡的进一步趋势。
2.3 Caspase-3免疫荧光染色结果
对照组小鼠脑组织海马及纹状体神经元Caspase-3的激活较少,而实验组在氯胺酮首次注射1周后神经元Caspase-3激活增加(P<0.05),主要表现在阳性细胞数的增加及荧光强度的增加。在8~12周,30mg/kg组中活化的Caspase-3的激活细胞数与对照组差异不明显(P>0.05)。而其他各实验组,与同时间点的对照组比较,差异均具有统计学意义(P<0.05)。阳性荧光物质呈粗大颗粒状,主要分布于细胞质中,细胞核内也有少量表达。其后Caspase-3的激活呈时间依赖性减少,4周后呈持续性低水平表达(表1、图2)。
2.4 TUNEL检测结果
对照组小鼠脑组织神经元TUNEL阳性细胞较少,而实验组在氯胺酮首次注射1周神经元阳性细胞数增加(P<0.05),主要表现在阳性细胞数的增加及荧光强度的增加,其后各组脑组织TUNEL阳性细胞计数呈时间依赖性减少,且阳性物质荧光强度减弱,但4周时仍处于高水平表达(图3、表2)。
在8~12周,30 mg/kg组中细胞凋亡数与对照组差异不明显(P>0.05)。而其他实验组,与同时间点的对照组比较,差异均具有统计学意义(P<0.05)。各时间点细胞凋亡结果显示,给予10mg/kg氯胺酮时,细胞凋亡数最多,给予4~10mg/kg氯胺酮时,神经元凋亡数有呈剂量依赖性增多趋势,在20~30mg/kg组,量效关系不明显(表2)。
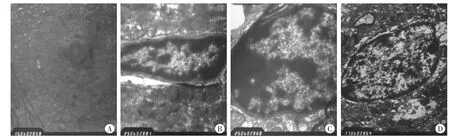
图1 氯胺酮中毒小鼠脑组织透射电镜观察结果×20000
表1 氯胺酮中毒小鼠神经元Caspase-3激活细胞数(n=4,±s)
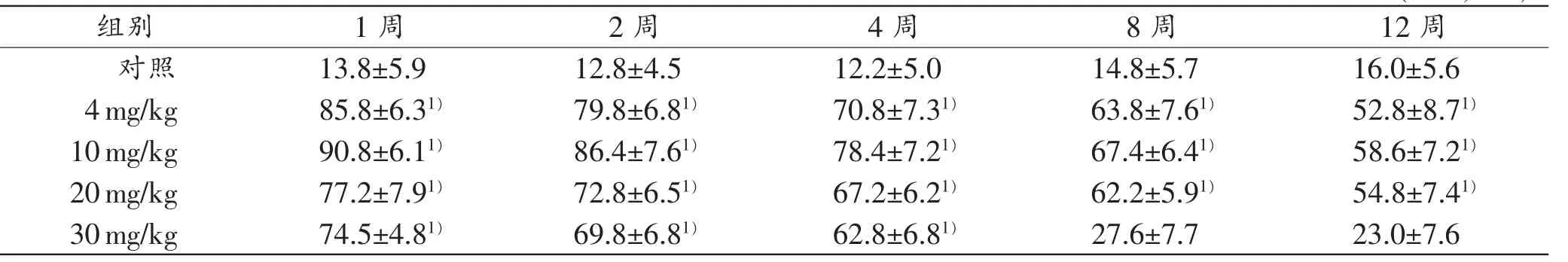
表1 氯胺酮中毒小鼠神经元Caspase-3激活细胞数(n=4,±s)
注:1)与相同时间点对照组比较,P<0.05
组别1周2周4周8周12周对照13.8±5.912.8±4.512.2±5.014.8±5.716.0±5.6 4mg/kg85.8±6.31)79.8±6.81)70.8±7.31)63.8±7.61)52.8±8.71)10mg/kg90.8±6.11)86.4±7.61)78.4±7.21)67.4±6.41)58.6±7.21)20mg/kg77.2±7.91)72.8±6.51)67.2±6.21)62.2±5.91)54.8±7.41)30mg/kg74.5±4.81)69.8±6.81)62.8±6.81)27.6±7.723.0±7.6

图2 氯胺酮中毒小鼠脑组织Caspase-3免疫荧光染色结果×400

图3 氯胺酮中毒小鼠脑组织TUNEL荧光染色结果×400
表2 氯胺酮中毒小鼠脑组织细胞凋亡数(n=4,±s)

表2 氯胺酮中毒小鼠脑组织细胞凋亡数(n=4,±s)
注:1)与相同时间点对照组比较,P<0.05
组别1周2周4周8周12周对照7.4±3.68.8±3.38.2±3.59.4±3.511.6±4.4 4mg/kg59.2±6.81)45.6±8.11)40.6±6.61)35.2±5.81)31.2±5.71)10mg/kg64.8±6.61)60.4±7.01)52.4±4.81)39.6±5.31)34.2±5.61)20mg/kg57.4±7.91)55.4±8.31)49.4±6.61)44.8±6.31)41.8±6.21)30mg/kg52.8±8.91)49.6±6.91)45.4±7.61)22.6±10.121.0±8.6
3 讨论
氯胺酮长期滥用者可造成记忆缺失、认知功能损害和各种精神损害[3]。氯胺酮进入血液循环后,大部分进入脑组织。动物实验表明,氯胺酮作用于幼年动物后可引起神经细胞的凋亡[4-6],持续使用NMDA受体拮抗剂氯胺酮导致持久性的认知障碍[7]。
3.1 Caspase与细胞凋亡
近年来,细胞凋亡的分子机制研究已取得了突破性进展,人们提出了细胞凋亡的主要信号传导通路:细胞凋亡的线粒体依赖途径、死亡受体途径和内质网激活途径。Caspase家族是重要的凋亡相关蛋白,参与线粒体依赖途径与死亡受体途径。Caspase-3正常以酶原的形式存在于胞浆中,在凋亡的早期阶段被激活,活化的Caspase-3由两个大亚基和两个小亚基组成,裂解相应的胞浆胞核底物,最终导致细胞凋亡。活化的Caspase-3仅在凋亡细胞中发现,因而检测Caspase-3的活性有助于发现早期的凋亡细胞。
本研究中,观察到小鼠氯胺酮中毒1周激活的Caspase-3表达即增加,高峰在氯胺酮注射后1周,其后逐渐减少,呈一定的时间依赖性。表明凋亡程序在首次注射后1周即已启动,在其后的过程中,仍有细胞不断地进入凋亡程序。至第12周时,在4~20mg/kg各实验组仍可见大量活化的Caspase-3表达。但在30mg/kg组,至第4周时,Caspase-3的激活已开始减少,至第8周时,检测到Caspase-3的阳性物质与对照组差异无统计学意义(P>0.05),说明在30mg/kg组第4周时,进入凋亡程序的细胞在减少,至8周时氯胺酮对细胞的凋亡作用已不明显,不能诱导细胞进入凋亡程序。同时还发现,各时间点氯胺酮中毒小鼠活化的Caspase-3在10mg/kg剂量时表达最多,给予小鼠4~10mg/kg氯胺酮时,Caspase-3的激活细胞数与剂量有一定的相关性;20~30 mg/kg组剂量相关性不明显。
3.2 氯胺酮滥用与脑细胞凋亡
海马是脑边缘系统中最重要的结构之一,是情感、行为、学习和记忆等高级神经活动的重要部位,在学习与记忆功能方面发挥着关键作用,参与学习、记忆、情绪和条件反射的形成。以上结果显示,氯胺酮慢性中毒可诱导小鼠海马及纹状体部神经元凋亡,与氯胺酮长期使用造成记忆缺失、认知功能损害结论相一致[3,8]。
本研究中,透射电镜检测结果证实了氯胺酮慢性中毒诱导小鼠神经元凋亡。TUNEL实验结果表明氯胺酮慢性中毒诱导小鼠神经元凋亡的趋势与活化的Caspase-3的表达趋势相一致,故有理由相信,小鼠氯胺酮慢性中毒时,神经元发生凋亡是依赖Caspase-3的激活发生的。Caspase-3的激活增加说明了细胞凋亡的发生通过了Caspase-3激活途径。最近研究[9]表明,氯胺酮可能诱导细胞凋亡的线粒体依赖途径,但其具体的作用机制,是否有其他途径参与其中,都有待于进一步研究。
本研究中,氯胺酮诱导的细胞凋亡在4~10mg/kg时与剂量有一定的相关性,但在20~30mg/kg时细胞凋亡与剂量的关系不明确。在30mg/kg组至第4周时凋亡显著减少,至第8周时与对照组差异无统计学意义。有研究[10]表明,存活的神经元对细胞内的最适“钙调定点”有极强的依赖性,氯胺酮对钙通道有剂量依赖性调节作用[11]。另有研究报道,大剂量的氯胺酮可抑制内毒素诱导的肺损伤,而在低剂量时没有抑制[12]。是否大剂量的作用机理与小剂量不同,还有待进一步的研究证明。
综上所述,氯胺酮滥用慢性中毒可诱导成年小鼠脑细胞凋亡,并呈一定的剂量相关性,但在大剂量时,细胞凋亡与剂量的关系不明确。氯胺酮诱导脑细胞凋亡的机制尚不清楚,有待进一步的研究。
[1]Mozayani A. Ketamine--Effects on human performance and behavior[J]. Forensic Science Review,2002,14(1):123-131.
[2]Maxwell JC. The response to club drug use[J]. Current Opinion in Psychiatry,2003,16(3):279-289.
[3]Morgan CJ,Riccelli M,Maitland CH,et al. Longterm effects of ketamine:evidence for a persisting impairment of source memory in recreational users[J]. Drug Alcohol Depend,2004,75(3):301-308.
[4]Dong C,Rovnaghi CR,Anand KJ.Ketamine alters the neurogenesis of rat cortical neural stem progeni-tor cells[J]. Crit Care Med,2012,40(8):2407-2416.
[5]Brambrink AM,Evers AS,Avidan MS,et al. Ketamine-induced neuroapoptosis in the fetal and neonatal rhesus macaque brain[J]. Anesthesiology,2012,116(2):372-384.
[6]Liu F,Paule MG,Ali S,et al. Ketamine-induced neurotoxicity and changes in gene expression in the developing rat brain[J]. Curr Neuropharmacol,2011,9(1):256-261.
[7]Curran HV,Morgan C.Cognitive,dissociative and psychotogenic effects of ketamine in recreational users on the night of drug use and 3 days later[J]. Addiction,2000,95(4):575-590.
[8]Soriano SG,Liu Q,Li J,et al. Ketamine activates cell cycle signaling and apoptosis in the neonatal rat brain[J]. Anesthesiology,2010,112(5):1155-1163.
[9]Bosnjak ZJ,Yan Y,Canfield S,et al. Ketamine induces toxicity in human neurons differentiated from embryonic stem cells via mitochondrial apoptosis pathway[J]. Curr Drug Saf,2012,7(2):106-119.
[10]Johnson EM Jr,Deckwerth TL.Molecular mechanisms of developmental neuronal death[J]. Annu Rev Neurosci,1993,16:31-46.
[11]Sinner B,Friedrich O,Zink W,et al. The toxic effects of s(+)-ketamine on differentiating neurons in vitro as a consequence of suppressed neuronal Ca2+oscillations[J]. Anesth Analg,2011,113(5):1161-1169.
[12]Yang J,Li W,Duan M,et al. Large dose ketamine inhibits lipopolysaccharide-induced acute lung injury in rats[J]. Inflamm Res,2005,54(3):133-137.
(本文编辑:刘宁国)
Apoptosis in Adult Mouse Brain after Chronic Poisoning of Ketamine
YANG Ju1,LI Xiao-jing1,ZHANG Zhi-xiang2,LU Kai-ming2,BIAN Shi-zhong2
(1.Department of Pathology,the Fifth People’s Hospital of Shanghai,Fudan University,Shanghai 200240, China;2.Department of Forensic Medicine,Medical College of Soochow University,Suzhou 215123,China)
ObjectiveTo study the effect of chronic poisoning of ketamine on brain cell apoptosis in adult mouse under different duration and doses.MethodsThe mouse model of chronic poisoning of ketamine was established on adult mouse by tail vein injection of ketamine twice every week with different doses (4,10,20 and 30mg/kg).The mice were sacrificed after continuous injection of ketamine of 1,2,4,8 and 12 weeks.The qualitative assessment of apoptosis was made by transmission electron microscope and the quantitative assessment was made by Caspase-3 immumofluorescence staining method and terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling(TUNEL)to estimate the time point of apoptosis.All the experimental results were statistically analyzed.ResultsThe neuron apoptosis was observed in hippocampus and corpus striatum by transmission electron microscope one week after administration,and continued for eight weeks.High level of Caspase-3 expression was observed one week after administration,but with a low level expression after 4 weeks.The number of TUNEL positive cells obviously increased one week after administration and maintained in a high number at 4 weeks.ConclusionKetamine by tail vein injection could induce neuron apoptosis in adult mouse.
forensic pathology;poisoning;ketamine;substance abuse,intravenous;apoptosis;Caspase-3;mice
DF795.1
A
10.3969/j.issn.1004-5619.2013.05.002
1004-5619(2013)05-0325-05
杨菊(1982—),女,湖北荆州人,硕士,主要从事临床病理学研究;E-mail:yangju_33@126.com
卞士中,男,主任法医师,副教授,硕士研究生导师,主要从事法医毒理学研究;E-mail:bianshizhong@suda.edu.cn
2012-10-12)

