MRS和DTI对放疗前后脑胶质瘤瘤周水肿的观察与分析
黄仁华,廖志军,徐 欣,陈海燕,胡 斌,沈加林,白永瑞
(1.上海交通大学医学院附属仁济医院,上海200127;2.上海交通大学医学院附属新华医院崇明分院肿瘤科,上海202150)
脑胶质瘤是最常见的颅内原发肿瘤,约占全身肿瘤的1.8%[1],具有弥漫浸润性生长、边界不清等生物学特点。常规MRI多表现为颅内占位性病灶伴周边水肿区域,高级别胶质瘤增强扫描后明显强化,但肿瘤强化边缘并非肿瘤的真实边界[2],瘤周水肿区域仍有肿瘤细胞浸润。随着MRI技术的迅速发展,MRS和DTI已经广泛应用于胶质瘤的诊断、治疗及随访中。MRS通过检测活体组织内器官能量代谢、生化改变以及化合物定量分析,获得脑胶质瘤代谢边界[3]。DTI可定量测定生物组织内水分子弥散的程度和方向性,从微观层面反映组织的病理及解剖变化[4]。本研究应用GE公司3.0 T高场MR仪,在常规扫描序列基础上,加行多体素波谱及DTI,对脑胶质瘤瘤周近侧水肿区域放疗前、后变化进行分析。
1 资料与方法
1.1 一般资料 收集2010年8月~2012年1月在上海交通大学医学院附属仁济医院行放疗的31例脑胶质瘤患者,其中男17例,女14例;年龄26~65岁,平均(47.03±12.60)岁。31例均行肿瘤部分切除术,并经病理证实。按WHO标准病理分级,其中WHOⅡ级9例,Ⅲ级7例,Ⅳ级15例。
1.2 仪器与方法
1.2.1 MRI检查 采用 GE Signa 3.0 T 超导型MR仪。全部患者除行常规MRI平扫+增强外,放疗前1周内均行MRS+DTI检查,放疗后1周内复查MRS+DTI。常规 MRI扫描序列包括Ax-MPRGE:TE 2.0 ms,TR 6.4 ms;T2FSE:TE 116.9 ms,TR 4 480.0 ms;T2FLAIR:TE 153.3 ms,TR 9 002.0 ms,行轴位扫描,层厚5 mm,间距2.0 mm,FOV 260 mm×260 mm,矩阵312×512。Ax-MPRGE增强扫描使用马根维显,经前臂静脉注射。MRS检查采用多体素氢质子波谱脑检查自动MRI波谱检测技术,PRESS序列,TR 1 500 ms,TE 144 ms,多体素相位矩阵扫描,层厚10 mm,层间距2 mm,FOV 160 mm×160 mm。DTI采用单次激发回波平面(single-short echo-planar,SS-EPI)成像序列,b值为0 s/mm2和1 000 s/mm2,弥散方向为所有弥散方向,TR 10 825 ms,TE 88 ms,回波链长度1,层厚3 mm,层距1 mm,反转角15°,采集时间为184 s。
1.2.2 放疗方法 所有患者放疗采用6~8 MV X射线和三维治疗计划系统。使用可塑面模进行头部固定,激光灯摆位,然后行CT连续增强扫描。扫描层厚5 mm,获得影像资料,传入计划系统,勾画治疗靶区残存病灶为肿瘤靶区(GTV)、临床靶区(CTV)范围:GTV+周围2.5~3 c m,计划靶区(PTV):CTV+0.5 c m。照射给予3~5个共面或非共面野(三维适形放疗),若肿瘤距离眼球、脑干等重要器官较近则采用调强放疗,要求90%~93%等剂量曲线包括PTV范围,经CT扫描校位验证后实施。剂量为2 Gy/(次·d),5次/周,40 Gy后缩小至PTV,总剂量为60 Gy。
1.3 资料分析与统计学方法 GE自带软件包Functool同时获得化学移位图、波谱图、代谢图、代谢与解剖图的叠加图。在肿瘤周围近侧水肿区域、对侧正常脑组织区设置ROI,其大小均为1.0 c m×1.0 c m×1.0 c m~2.0 c m×2.0 c m×2.0 c m。瘤周近侧水肿区域定义为瘤周T2WI高信号、T1WI增强无强化区,距离增强区域2.0 c m内。用自带软件分别计算胆碱(Cho)/肌酐(Cr)、Cho/N-乙酰天门冬氨酸(NAA)、NAA/Cr比值,结果采用均数±标准差表示。同时在GE工作站ADW4.4上对弥散张量数据进行处理,FA图、ADC图由MRI系统自动计算生成。在FA图测量瘤周近侧水肿区域部分各向异性值(fractional anisotropy,FA),在 ADC图测量瘤周近侧水肿区域值ADC,测量时每个部位取3个ROI(10~15 mm3),取其平均值。上述数据利用SPSS 16.0统计学软件包分析,对所得数据均采用配对样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 MRS测得31例脑胶质瘤术后放疗前近侧瘤周水肿区域波谱与对侧正常区域明显不同,近侧瘤周水肿区Cho/Cr、Cho/NAA比值升高,与对侧正常区域比较差异有统计学意义,NAA值较对侧正常下降(见表1)。DTI的量化指标FA及ADC值也显示出近侧瘤周水肿区域与正常脑组织存在差别,见表1(图1,见封2)。
表1 肿瘤周围水肿区域放疗前观察指标±s)
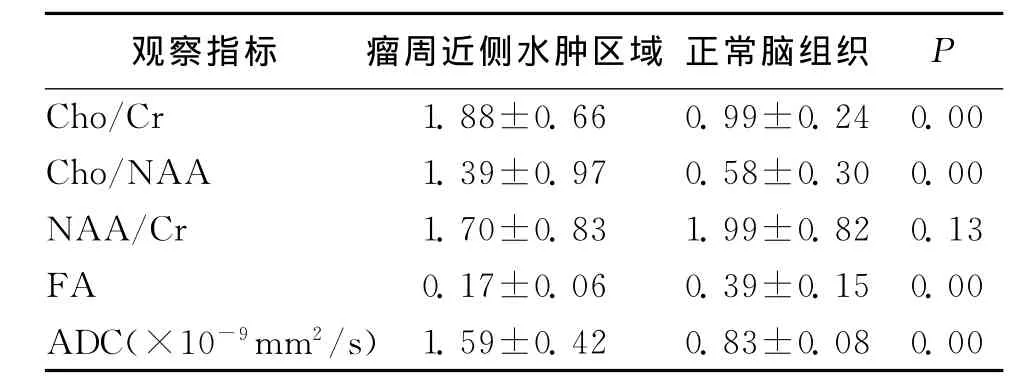
表1 肿瘤周围水肿区域放疗前观察指标±s)
注:Cho:胆碱;Cr:肌酐;NAA:N-乙酰天门冬氨酸;FA:部分各向异性
观察指标 瘤周近侧水肿区域 正常脑组织P Cho/Cr 1.88±0.66 0.99±0.24 0.00 Cho/NAA 1.39±0.97 0.58±0.30 0.00 NAA/Cr 1.70±0.83 1.99±0.82 0.13 FA 0.17±0.06 0.39±0.15 0.00 ADC(×10-9 mm2/s)1.59±0.42 0.83±0.08 0.00
2.2 近侧瘤周水肿区域代谢物及其比值放疗前后比较(见表2)
表2 近侧瘤周水肿区域代谢物比值比较±s)

表2 近侧瘤周水肿区域代谢物比值比较±s)
组别 Cho/Cr Cho/NAA NAA/Cr放疗前1.88±0.66 1.39±0.97 1.70±0.83放疗后 1.53±0.55 1.29±0.88 1.40±0.59 P 0.01 0.68 0.1
表2表明,放疗后近侧瘤周水肿区域的Cho/Cr、Cho/NAA、NAA/Cr值均较放疗前下降,Cho/Cr、NAA/Cr差异无统计学意义,Cho/Cr值差异有统计学意义(P<0.05)。
2.3 近侧瘤周水肿区域FA值、ADC值放疗前后结果见表3(图2,见封2)。
表3 近侧瘤周水肿区域FA值、ADC值放疗前后结果(±s)

表3 近侧瘤周水肿区域FA值、ADC值放疗前后结果(±s)
组别 FA ADC(×10 mm/s)放疗前0.17±0.06 1.59±0.42放疗后 0.19±0.06 1.29±0.31 P 0.20 0.005
表3表明,近侧瘤周水肿区域放疗后FA值上升,差异无统计学意义(P >0.05),而ADC值下降,差异有统计学意义(P<0.05)。
3 讨论
胶质瘤早期就向周围正常组织浸润性生长,形成隐匿病灶,这些病灶是复发的根源。瘤周水肿是由于血脑屏障遭到肿瘤细胞浸润、破坏所致而不是单纯的血管源性水肿。瘤周水肿发生机制包括胶质瘤新生血管血脑屏障形态不规则、结构不完整,内皮细胞缺氧退变,连接处有间隙或开口;肿瘤细胞分泌的血管内皮生长因子促进新生血管生成及血管通透性增强;高级别胶质瘤分泌缓激肽、白三烯、血小板活性因子、一氧化氮和酶等生物活性因子,导致血脑屏障通透性增加等。本研究中瘤周近侧水肿区域放射治疗前表现为病理性波谱,提示肿瘤细胞浸润。在接受常规三维适形放疗后,近侧瘤周水肿区域的Cho/Cr较放疗前明显下降,差异有统计学意义,P=0.01;Cho/NAA、NAA/Cr较放疗前下降,但差异无统计学意义。Cho是细胞膜磷脂代谢中间产物,是髓鞘形成、细胞代谢和胶质增生的指标,反映了细胞膜的转运,Cho浓度升高反映肿瘤细胞膜的转换增强[5]。研究[6]发现,Cho浓度升高,肿瘤细胞增殖活跃,反之,浓度下降,意味着肿瘤增殖减弱,肿瘤对放疗的反应可以Cho减少作为标准。
本研究中放疗后近侧瘤周水肿区域ADC值下降,考虑原因为放疗后瘤周组织水肿加重,大部分患者使用类固醇激素治疗,稳定细胞膜,使弥散受限,故ADC值降低。对于瘤周水肿区ADC值治疗前后变化文献报道不一,Sinha等[8]报道激素治疗后瘤周水肿ADC值增加,同时也发现激素治疗后瘤周水肿ADC值降低。而 Minamikawa等[9]却发现激素治疗后ADC值无明显变化。大部分研究[10-11]证实使用激素后ADC值降低,与本研究结果相似。
瘤周水肿区域往往是胶质瘤术后放疗后复发的根源,对胶质瘤瘤周水肿区的密切关注具有临床价值。MRS及DTI能显示近侧瘤周水肿区域放疗后的早期代谢变化,较早反映放疗效果,值得临床推广。
[1]Louis DN,Ohgaki H,Wiestler OD,et al.The 2007 WHO classification of t u mours of t he central ner vous syste m[J].Acta Neur opat hol,2007,142:97-109.
[2]Henson JW,Gaviani P,Gonzalez RG.MRI in treat ment of adult glio mas[J].Lancet Oncol,2005,6:167-175.
[3]LikavcanováK,Dobrota D,Liptaj T,et al.In vitr o study of astrocytic tu mour metabolism by proton magnetic resonance spectroscopy[J].Gen Physiol Biophys,2005,24:327-335.
[4]Stadlbauer A,Ni msky C,Gr uber S,et al.Changes in fiber integrity,diff usivity,and metabolis m of t he pyra midal tract adjacent to gliomas:a quantitative diff usion tensor fiber tracking and MR spectroscopic i maging study[J].AJNR,2007,28:462-469.
[5]Law M,Cha S,Knopp EA,et al.High-grade glio mas and solitar y metastases:differentiation by using perf usion and pr oton spectroscopic MR i maging[J].Radiology,2002,222:715-721.
[6]Tedeschi G,Lundbo m N,Ra man R,et al.Increased choline singal coinciding wit h malignant degeneration of cerebral glio mas:a serial proton magnetic resonance spectr oscopy i maging study[J].J Neurosurg,1997,87:516-524.
[7]Sinha S,Bastin ME,Whittle IR.Rapid clinical deterioration in a patient wit h multi-focal glio ma despite corticoster oid t herapy:a quantitative MRI study[J].Br J Neurosurg,2003,17:537-540.
[8]Sinha S,Bastin ME,War dlaw JM,et al.Effects of dexamet hasone on perit u moural oedemat ous brain:a DT-MRI st udy[J].J Neurol Neur osur g Psychiatry,2004,75:1632-1635.
[9]Minamikawa S,Kono K,Nakayama K,et al.Glucocorticoid treat ment of brain tu mor patients:changes of apparent diff usion coefficient values measured by MR diff usion i maging[J].Neuroradiology,2004,46:805-811.
[10]Bastin ME,Car penter TK,Ar mitage PA,et al.Effects of dexamet hasone on cerebral perf usion and water diff usion in patients wit h high-grade glio ma[J].AJNR Am J Neuroradiol,2006,27:402-408.
[11]Ar mitage PA,Sch windack C,Bastin ME,et al.Quantitative assess ment of intracranial t u mor response t o dexa met hasone using diff usion,perf usion and per meability magnetic resonance i maging[J].Magn Reson Imaging,2007,25:303-310.

