马铃薯SSR-PCR体系的优化与建立
李建武,李高峰,胡新元,文国宏*,魏子杰
(1.甘肃省农业科学院马铃薯研究所,甘肃兰州730070;2.农业部西北旱作马铃薯科学观测实验站,甘肃渭源748201;3.甘肃省农业科学院生物技术研究所,甘肃兰州730070;4.甘肃农业大学生命科学技术学院,甘肃兰州730070)
马铃薯SSR-PCR体系的优化与建立
李建武1,2,3,李高峰1,2,胡新元1,2,文国宏1,2*,魏子杰4
(1.甘肃省农业科学院马铃薯研究所,甘肃兰州730070;2.农业部西北旱作马铃薯科学观测实验站,甘肃渭源748201;3.甘肃省农业科学院生物技术研究所,甘肃兰州730070;4.甘肃农业大学生命科学技术学院,甘肃兰州730070)
以马铃薯叶片DNA为模板,采用单因素试验的方法,对影响马铃薯SSR-PCR反应体系的主要成分模板DNA、dNTP浓度、引物浓度、Mg2+浓度、Taq酶浓度及退火温度进行了优化,并建立最优化的马铃薯SSR扩增反应体系。结果表明:在20μL反应体系中,模板DNA用量为60 ng,dNTP为0.3125 mmol∕L,引物浓度为2.4 pmol,Mg2+为1.5 mmol∕L,Taq酶为0.5 U,筛选各引物最适宜的退火温度,经2.0%琼脂糖凝胶电泳检测,扩增条带清晰,优化后的SSR反应体系稳定性好,可用于马铃薯遗传多样性分析。
马铃薯;SSR-PCR;优化
在生产上应用的栽培种马铃薯均为同源四倍体,以无性方式繁殖,由于其高度杂合,遗传背景狭窄,基因分离复杂,常规杂交育种效率较低。杂交育种过程中亲本的选择至关重要,要求亲本携带目的基因,同时亲本间存在较大的遗传差异,依据亲本的农艺性状和系谱关系确定其遗传差异易受环境的影响和经验的限制,效率较低[1]。分子标记技术的快速发展,为从DNA分子水平鉴定马铃薯不同基因型的遗传差异提供了有利工具。简单重复序列(Simple sequence repeat,SSR)分子标记自1991年创立以来,在马铃薯构建遗传连锁图谱、研究群体遗传学、进行分子标记辅助育种、系谱分析、品种指纹图谱绘制、品种纯度检测等研究方面也得到了广泛应用[2-5]。本研究对影响SSR-PCR反应体系的各因素进行了优化,以期建立一套适宜的马铃薯SSR反应体系,为利用SSR标记研究马铃薯遗传多样性和杂交育种亲本选配提供依据。
1 材料与方法
1.1 材料
试验采用的6份马铃薯基因型为品种‘大西洋’,品系‘M’、‘F’、‘LZ219’、‘LZ205’、‘LZ302’,将各材料种植于大田,在马铃薯现蕾期采集幼嫩叶片。其中,在马铃薯SSR-PCR优化试验中均采用‘大西洋’叶片DNA为模板,在优化体系的应用试验中采用以上6个基因型DNA为模板。
1.2 试剂和仪器
PCR反应所使用的Taq酶、dNTPs、Buffer(含Mg2+)均购自天根生化科技(北京)有限公司,SSR引物(表1)由生工生物工程(上海)股份有限公司合成。试验仪器为∶Heraeus台式高速离心机,XW-80A漩涡混合仪、Mini-P25离心机、S1000 PCR仪、FTI-500凝胶成像分析系统。

表1 SSR引物序列及退火温度Table 1 Pimers and annealing temperature of SSR
1.3 PCR反应体系
本试验采用20μL反应体系进行PCR扩增,根据Taq酶说明书建议用量10×Buffer(含Mg2+)2 μL,2.5 mmol∕L dNTPs(dATP,dGTP,dCTP,dTTP各2.5 mmol∕L)2 μL,5.0 U∕μL Taq酶0.25 μL,20 pmol∕μL引物1.00 μL,50 ng∕μL DNA模板1.00 μL建立初始体系,当其中某一成分进行浓度梯度变化时,其他成分不变,比较不同处理对PCR扩增的影响。
1.4 PCR反应程序及检测
95℃预变性4 min;95℃变性30 s,53℃退火30 s,72℃延伸1 min,共35循环,最后72℃延伸10 min;5℃保存备用,产物用2.0%琼脂糖凝胶电泳检测,0.05%EB染色,用DS 2000 Marker(含100,250,500,750,1 000,2000 bp 6条带)作为分子量梯度的标准,120 V下电泳20 min,在凝胶成像系统下观察,并照相分析。
1.5 PCR反应体系的优化
PCR反应体系的优化采用SSR引物S001,模板采用‘大西洋’叶片基因组DNA。在20 μL反应体系下进行PCR的扩增,各成分的初始浓度需要提前配置,根据体积变化而形成不同的终浓度,5种PCR主要成分体积变化各设置8个浓度梯度,其中10×Buffer(含Mg2+)(3 mmol∕L MgCl2)体积依次为∶0.50,1.00,1.50,2.00,2.50,3.00,3.50,4.00 μL;dNTPs(2.5 mmol∕L)体积依次为∶0.50,1.00,1.50,2.00,2.50,3.00,3.50,4.00μL;引物(20 pmol∕μL)体积依次为∶0.40,0.80,1.20,1.60,2.00,2.40,2.80,3.20 μL;DNA(50 ng∕μL)体积依次为∶0.40,0.80,1.20,1.60,2.00,2.40,2.80,3.20 μL;Taq酶(5.0 U∕μL)体积依次为∶0.05,0.10,0.15,0.20,0.25,0.30,0.35,0.40μL。
1.6 引物退火温度筛选
退火温度的筛选采用4对Tm值不同的引物,退火温度设置8个梯度,根据PCR仪特点,运行前设定最高和最低退火温度,中间6个梯度的退火温度在PCR扩增结束后确定。PCR反应程序以及扩增产物检测均按1.4方法。
2 结果与分析
2.1 Buffer(含Mg2+)对SSR-PCR扩增的影响
如图1所示,泳道1,7,8均没有扩增条带的产生;而泳道2至6中都有清晰完整的扩增片段出现,其中2,3,4,5,6泳道中的条带亮度均能达到试验要求,其中4泳道条带亮度最强,即当Buffer(含Mg2+)体积为2.00 μL时最亮,扩增效果较好,也较经济,为最适反应体积。

图1 Buffer(含Mg2+)对SSR-PCR扩增的影响Figure 1 Effects of Buffer(containing Mg2+) concentrations on SSR patterns
2.2 dNTPs对SSR-PCR扩增的影响
如图2所示,随着dNTPs体积的增加,其终浓度增大,PCR扩增条带逐渐变亮,至7泳道即dNTPs体积为3.5 μL时条带最亮,第8泳道条带亮度降低,与目的扩增条带亮度变化趋势相同还有产生的二聚体,综合考虑,选用5泳道即为2.50 μL时扩增效果较好,为最适反应体积。
2.3 引物对SSR-PCR扩增的影响
如图3所示,随着引物浓度的增加,目的扩增条带亮带逐渐增强,至泳道6亮度最强,以后随着引物终浓度的增大,亮度逐步减弱,其中2至6泳道条带亮度均可满足实验要求。随着引物终浓度用量的增大,二聚体条带亮度逐渐增强,但总体而言,二聚体条带较暗,引物终浓度过高也会增加成本,综合考虑,选择引物体积用量1.20 μL为宜。
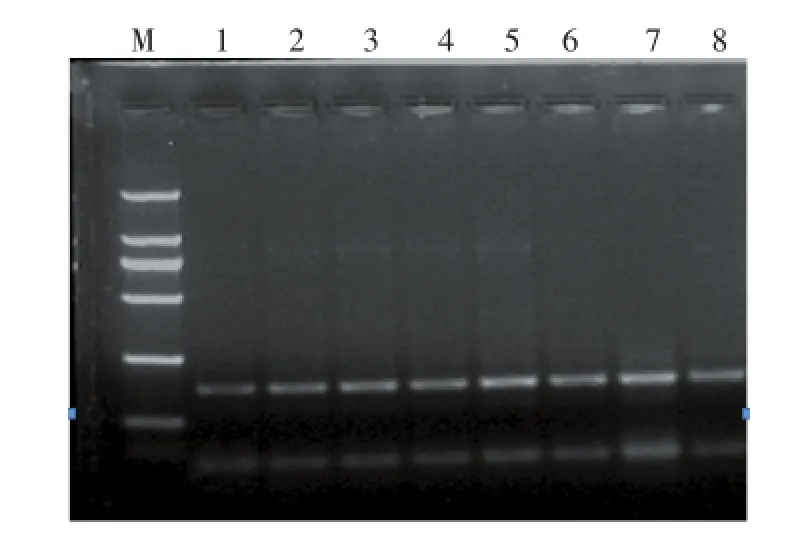
图2 dNTPs浓度对SSR-PCR扩增的影响Figure 2 Effects of dNTPs concentrations on SSR patterns
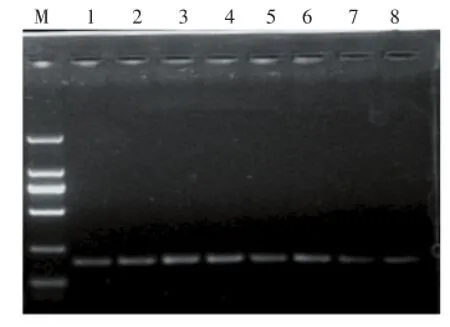
图3 引物浓度对SSR-PCR扩增的影响Figure 3 Effects of primer concentrations on SSR patterns
2.4 模板DNA浓度对SSR-PCR扩增的影响
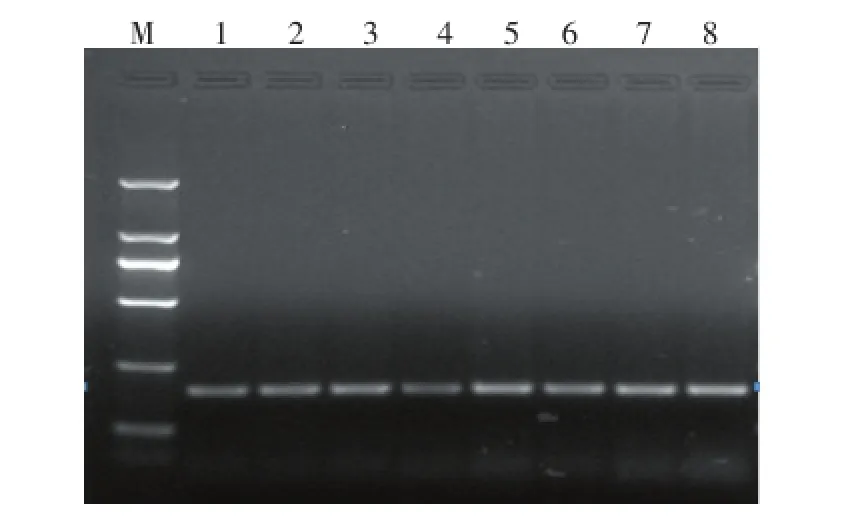
图4 模板DNA浓度对SSR-PCR扩增的影响Figure 4 Effects of template DNA concentrations on SSR patterns
如图4所示,随着模板DNA终浓度的增大,扩增目的条带亮度逐渐增强,为防止过高的模板DNA浓度引起非特异性条带产生,综合考虑,选择模板DNA体积用量1.20 μL为宜。
2.5 Taq酶对SSR-PCR扩增的影响
如图5所示,随着Taq酶体积的增加,其终浓度增大,1至5泳道扩增条带亮度逐渐增强,6和7泳道条带亮度逐渐变暗,8泳道没有目的条带出现。2至8泳道均出现了非特异性条带,这是由于Taq酶浓度过高发生较高的错配率而产生非特异性条带的原因造成的,Taq酶浓度过低则导致产物合成减少,综合考虑,确定Taq酶适宜用量为20 μL体系中加入0.10 μL。

图5 Taq酶浓度对SSR-PCR扩增的影响Figure 5 Effects of Taq enzyme concentrations on SSR patterns
2.6 引物退火温度的筛选
如图6~9所示,4对引物各设置了8个退火温度梯度,分别为62.0,61.1,59.3,56.1,52.2,49.2,47.0,46.0℃。在图6中,引物S002在8个退火温度下均有目的条带产生,随着退火温度的降低,条带亮度逐渐增强后减弱,至52.2℃条带亮度最强,同时随温度降低非特异性条带数量增多、亮度增强,综合考虑该引物的适宜退火温度为52.2℃。
在图7中,引物S003在62.0,61.1℃下没有目的条带出现,其它退火温度下均出现目的条带,在52.2℃时目的条带亮度最强,综合考虑,该引物的最适退火温度为56.1℃。
在图8中,引物S004在8个退火温度下均出现目的条带(在59.3℃时,条带亮度较弱),温度较高条带亮度较弱,无非特异性条带出现,但当温度较低时,特异性条带亮度较弱,同时非特异性条带数量增多、亮度增强,当温度为56.1℃时,特异性条带亮度最强,该引物的最适退火温度为56.1℃。
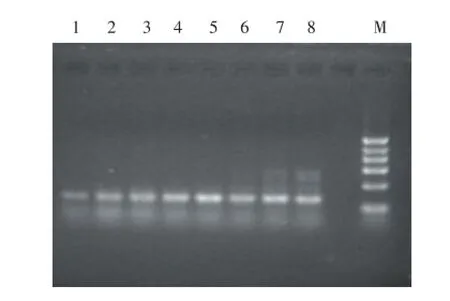
图6 引物S002不同退火温度对PCR扩增的影响Figure 6 Effects of S002 primer annealing temperatures on SSR patterns

图7 引物S003不同退火温度对PCR扩增的影响Figure 7 Effects of S003 primer annealing temperatures on SSR patterns
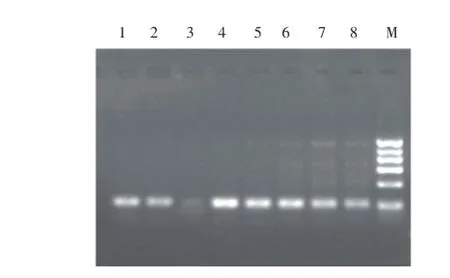
图8 引物S004不同退火温度对PCR扩增的影响Figure 8 Effects of S004 primer annealing temperatures on SSR patterns

图9 引物S005不同退火温度对PCR扩增的影响Figure 9 Effects of S005 primer annealing temperatures on SSR patterns
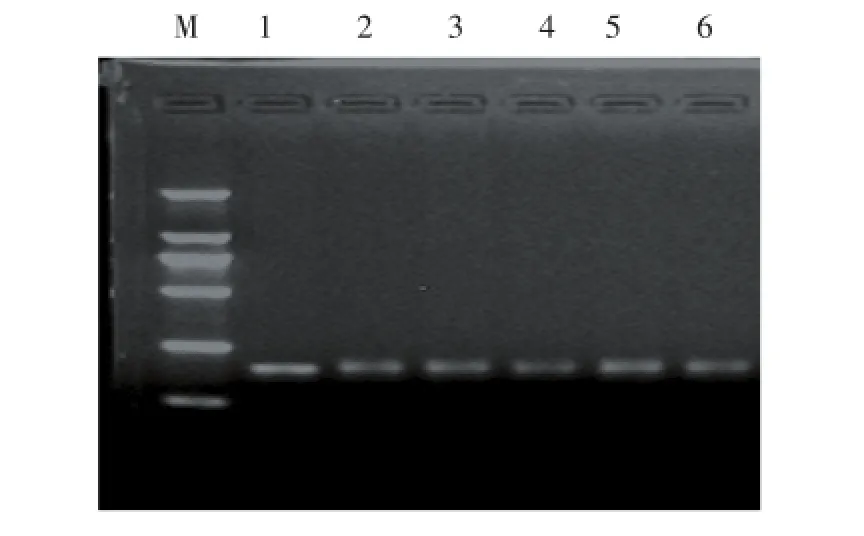
图10 引物S003对6个马铃薯基因型PCR扩增结果Figure 10 Amplification results by primer S003 for six potato genotypes
在图9中,引物S005在8个退火温度下均出现目的条带,温度较高或较低时条带亮度较弱,当温度为61.1,59.3,56.1℃时,特异性条带亮度最强,综合各因素,该引物的最适退火温度为59.3℃。
2.7 优化体系的应用
利用上述优化后的反应体系,20 μL反应体系含10×Buffer(含Mg2+)2.00 μL,2.5 mmol∕L dNTPs 2.50 μL,5.0 U∕μL Taq酶0.10 μL,20 pmol∕μL引物1.20 μL,50 ng∕μL DNA模板1.20 μL。选择确定好的退火温度的引物S003对6份马铃薯基因型进行PCR扩增。如图10所示,条带清晰、完整,无非特异性条带与二聚体出现,有较好的稳定性和可重复性。结果表明,本试验优化的SSR-PCR反应体系稳定性、重复性好,适用于马铃薯分子标记。
3 讨论
PCR反应是SSR技术中的重要环节,反应体系中各组成成分均影响扩增效果。Mg2+离子浓度对PCR扩增效率影响较大,浓度过高可降低PCR扩增的特异性,浓度过低则影响PCR扩增产量甚至使PCR扩增失败。引物是关键,PCR产物的特异性取决于引物与模板DNA互补的程度,在优化过程中以最低引物量产生所需要的结果为好,引物浓度偏高会引起错配和非特异性扩增,且可增加引物之间形成二聚体的机会。dNTPs浓度过高会导致聚合酶错误的渗入,与Taq酶竞争Mg2+,使Taq酶活性下降,扩增结果受到影响,同时提高了成本;dNTPs浓度过低时影响合成效率,甚至会因为dNTPs过早消耗而导致产物单链化。Taq酶的使用量过高,使成本增加,并容易产生非特异性产物,过低导致其合成效率的下降。
本试验建立的马铃薯SSR-PCR反应体系为∶在20 μL反应体系中,模板DNA用量为60 ng,dNTPs为0.3125 mmol∕L,引物浓度为2.4 pmol,Mg2+为1.5 mmol∕L,Taq酶为0.5 U。经验证,该体系稳定性、重复性好,非特异扩增少,扩增效果良好,可适用于马铃薯的分子标记。
[1]Carrasco A,Chauvin J,Trognitz B,et al.Marker-assisted breeding for disease resistance in potato[J].Potato Res,2009,52:245-248.
[2]Barone A.Molecular marker-assisted selection for potato breeding[J]. Am J Potato Res 2004,81:111-117.
[3]Feingold S,Lloyd J,Norero N,et al.Mapping and characterization of new EST-derived microsatellites for potato(Solanum tuberosum L.).Theor Appl Genet,2005,111:456-466.
[4]Ghislain M,Trognitz B,Herrera Ma del R,et al.Genetic loci associated with field resistance to late blight in offspring of Solanum phureja and S.tuberosum grown under short-day conditions[J].Theor Appl Genet,2001,103:433-442.
[5]Ghislain M,Núñez J,Rosario Herrera M,et al.Robust and highly informative microsatellite-based genetic identity kit for potato[J]. Mol Breeding,2009,23:377-388.
[6]Milbourne D,Meyer R C,Collins A J,et al.Isolation,characterisation and mapping of simple sequence repeat loci in potato[J].Mol Gen Genet,1998,259:233-245.
[7]Provan J,Powell W,Waugh R.Microsatellite analysis of relationships within cultivated potato[J].TheorApplGenet,1996,92:1078-1084.
Establishment and Optimization of SSR-PCR Reaction System of Potato
LI Jianwu1,2,3,LI Gaofeng1,2,HU Xinyuan1,2,WEN Guohong1,2*,WEI Zijie4
(1.Institute of Potato,Gansu Academy of Agricultural Sciences,Lanzhou,Gansu 730070,China;2.Scientific Observing and Experimental Station of Potato Dry Farming in Northwest China,Ministry of Agriculture,Weiyuan,Guansu 748201,China; 3.Institute of Biotechnology,Gansu Academy of Agricultural Sciences,Lanzhou,Gansu 730070,China; 4.College of Life Science and Technology,Gansu Agricultural University,Lanzhou,Gansu 730070,China)
ract:The main component which affects SSR-PCR reaction system on potato,including template DNA,dNTPs concentration,primer concentration,buffer concentration,Taq enzyme concentration and annealing temperature,were optimized in a single factor experiment,and the optimized SSR amplification reaction system was established.The results indicated that 20µL volume SSR-PCR system containing 60 ng template DNA,0.3125 mmol/L dNTPs,2.4 pmol primer,1.5 mmol/L Mg2+,and 0.5 U Taq polymerase,combined with optimal annealing temperature for each primer,performed well,and the optimized system of SSR-PCR,which was steady and reproducible,could be applied to the study of genetic diversity of potato afterPCRresults were run by 2.0%agarose gel.
rds:potato;SSR-PCR;optimization
S532
B
1672-3635(2013)06-0331-05
2013-10-20
国家自然基金“四倍体马铃薯分子遗传图谱的构建与淀粉含量等重要农艺性状的QTL定位研究”(31160299)。
李建武(1978-),男,助理研究员,研究方向为马铃薯遗传育种。
文国宏,研究员,主要从事马铃薯育种研究,E-mail∶wgh1966@126.com。

