斑马鱼A型γ-氨基丁酸受体同源模建及分子对接
巨修练,王黎丽,李 科
(武汉工程大学化工与制药学院,绿色化工过程教育部重点实验室,湖北 武汉 430074)
0 引 言
γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种中央神经系统(CNS)抑制性神经递质,它的传递作用是由GABA受体介导的.人的许多神经性疾病都与GABA受体有关,包括帕金森氏症、失眠、精神分裂症等,同时,GABA受体也是硫丹、六六六等有机氯类、氟虫腈及安维菌素类等杀虫剂的重要作用靶标.因此GABA受体一直为人们所关注.
哺乳动物GABA受体根据其结构和药理作用的不同可以分为两类,一类为离子型受体,另一类为代谢型受体.GABAA受体是离子型受体,存在于哺乳动物的CNS和脊椎,并与一个内在的氯离子通道相耦联.GABAB受体是代谢型受体,通过G蛋白与第二信使耦联,在神经末端引起GABA流量的下降,可出现前突出抑制,从而引起神经递质释放下降[1-3].GABAC受体也是离子型受体,是由β亚基组成的同源多聚体,主要分布于脊椎动物的视网膜.对GABAC受体的功能特性了解不多,近年将ρ受体亚单位组成的GABAC受体归为GABAA受体.GABAA受体是3种亚型中最重要的一种[3-4].
GABAA受体为五聚体,是配体门控离子通道受体超家族的一个成员,该家族还包括nAChR、甘氨酸受体(strychnine-sensitive glycine receptor)和5-HT3受体(serotonergic 5-HT3receptor).通过cDNA克隆和基因组技术已鉴定了21个哺乳动物大脑中GABAA受体亚基,依据氨基酸顺序相似程度,将亚基系列分为α1-6,β1-4,γ1-3,δ ,ε ,π ,ρ1-3,θ 8个亚基族[1-5].不同亚基族间氨基酸序列的同源性约为20%~40%,而同一亚基族间的同源性高达60%~80%.GABAA受体的每个亚基由400~550个氨基酸残基组成,包括三个区域:约220个氨基酸残基组成的胞外N端疏水域;4个疏水的跨膜螺旋顺序(Ml-M4)构成的跨膜区域,每个跨膜序列长度为22个氨基酸残基,其中M2形成氯离子通道,能选择性地通过带负电荷的氯离子;处于细胞内基质的环,对这部分的结构和功能研究较少[2-6].
GABAA受体可由不同的亚基按不同方式组合,但不是所有的亚基都能彼此有效地组装成功能性受体.研究表明,存在于哺乳动物大脑中的天然GABAA受体主要由α,β,γ亚基组成,常见的亚型组合式有α2β3γ2,α1β2γ2和α3β3γ2[5-8].
哺乳动物GABAA受体存在多个与配体结合的活性位点,已发现的GABA受体与配体的结合点有五个:GABA位点、巴比士盐酸(Barbiturate)位点、苦毒宁(Picrotoxinin)位点、苯二氮卓(Benzodiazepine)位点及类固醇类(Steroid)位点.每个结合位点与药物分子结合产生的药理作用不同.例如作用于GABA结合位点的药物,可开启Cl-通道,使Cl-内流而导致细胞内电位增加,进而产生超极化抑制神经兴奋性.作用于Barbiturate结合位点的药物,可增加GABA活化Cl-通道的通透性,表现出明显的麻醉效应.Picrotoxinin 位点是GABAA受体非竞争性的抑制结合位点,主要起关闭Cl-通道、阻断GABA受体的作用.而与Benzodiazepine位点结合的药物,可增加Cl-通道开放的频率,使Cl-通道开放时间延长,产生抑制作用,从而产生镇静、催眠及抗惊厥现象.神经活性甾类化合物与Steroid位点结合,可选择性的调节GABAA受体机能[9-14].GABA受体不同结合位点产生的药理作用不同,对开发高选择性低毒性的药物分子有重大意义.
昆虫GABA受体的研究远落后于哺乳动物GABAA受体的研究.仅有几种类型的配体门控氯离子通道的亚基已在昆虫中鉴定,其中包括黑腹果蝇和烟蚜夜蝇的RDL、黑腹果蝇中的GRD和LCCh3.RDL是抗狄氏剂(resistance to dieldrin)的同系物;GRD是GABA和甘氨酸样受体(GABA and glycine-like receptor of D. Melanogaster,GRD);LCCh3是配体门控氯离子通道同系物3(ligand-gate chloride channel homologue 3)[5].
作用于GABA受体的药物分子氟虫腈((R,S)-5-氨基-1-(2,6-二氯-4a-三氟甲基苯基)-4-三氟甲基亚磺酰基吡唑-3-腈)是GABA-氯离子通道抑制剂,可以和GABA受体结合,干扰氯离子通道,进而导致神经信号的损失,进而死亡,是一种重要的杀虫剂.但对于某些非靶标生物水生生物却有很高的毒性,因此,本实验通过计算机辅助手段对斑马鱼GABA受体与氟虫腈及其衍生分子的对接模拟,从理论上解释氟虫腈对斑马鱼产生毒性的原因[15-18].
1 实验部分
本实验中所有计算工作都是基于windows平台的sybyl8.0软件(Tripos Inc.)而完成的,除特别介绍外,所有参数均采用默认值.
1.1 同源模建
1.1.1 序列的选择 为了构建斑马鱼GABA受体,首先从Swiss-Prot/TrEMBL数据库获得斑马鱼GABAA受体ρ亚基的序列:Q5RIM2.然后对这些亚基进行编辑,删去无需构建结构的膜外配体结合区域和膜内环区的氨基酸序列.
1.1.2 模板的选择 模板的选择在同源模建中起关键作用,直接决定了靶结构的折叠与质量.在本实验中,选用秀丽隐杆线虫谷氨酸门控离子通道受体跨膜段作为模板,PDB数据库编号为3RHW,然后对模板进行编辑,删去膜外区和膜内区,这样就得到跨膜段的模板.
1.1.3 构建亚基 首先将靶序列与模板序列进行比对(sequence alignment),采用Needleman&Wunsch 方法,得到一个多序列比对文件(multiple sequence format,MSF).接下来将MSF文件导入到ORCHESTRAR模块中,可以使模板的序列与三维结构对应起来,然后采用BATON方法将模板结构和靶序列进行结构比对.最后就可以构建出靶肽链的结构,包括识别结构保守区域(structure conserved regions,SCR),搜索环区和添加侧链.
1.1.4 模型的组合 需要将构建的斑马鱼的GABAA受体跨膜段的各个亚基一一对应叠合到模板上.再使用MERGE模块合成一个五聚体斑马鱼ρ5 GABAA受体跨膜段.
1.1.5 模型的优化与修正 采用分子力学和分子动力学的方法对斑马鱼GABA受体跨膜段的模型进行修正.在AMBER7 FF99立场下,首先将整个体系进行共轭梯度法优化至能量梯度的RMS小于5 kcal/mol/nm,此外采用分子动力学(molecular dynamics,MD)的方法来优化模型,以检验模型是否具有稳定的构象,在300 K的恒温条件下,计算总长为500 ps,步长1fs.
1.2 分子对接
分子对接方法关键在于定义正确的受体结合口袋.由于目前并未获得GABA受体的三维结构,更没有复合物的任何报道,所以配体的对接采用残基模式来定义结合口袋,即指定一些氨基酸残基,设定其周围一定范围内的氨基酸残基为活性位点.在分子对接(Surflex-docking)模块下,活性位点被称为原型分子(protomol).另外,有两个参数可以设置原型分子的形状与大小:Threshold设置原型分子的大小;Bloat值设置原型分子渗入蛋白空隙的程度.
试验中选择了一系列苯基吡唑类化合物,通过将这些化合物与斑马鱼GABAA受体跨膜段分子对接,确定对接中的优势构象和产生结合效应的基团.
通过Surflex-docking 模块进行分子对接后,Csorce模块会对每一个配体的对接结果进行打分,包括D-score、PMF-score、G-score、Chemscore这四个函数.打分函数基于受体-配体复合物的结合亲和力,将会考虑疏水、极性、排斥、熵、溶剂化作用.最后,可以根据以下函数换算得到受体与配体的结合自由能(kcal/mol):Free Energy of Binding=RTlnKd[19-20].
2 结果与讨论
2.1 同源模建
斑马鱼的序列与模板序列比对的结果见图1,3RHW为同源五聚体,仅比对一条链即可,从图1中可知,受体通道部分保守区域序列的同源性很高,目标序列与模板序列的整体一致度在表1中给出,从表1中可知,整体同源性高达37.5%,当要构建的蛋白质序列与模板序列同源性达到30%时,构建蛋白质一级结构的相似性可达到80%.因而所选的模板是合理的.
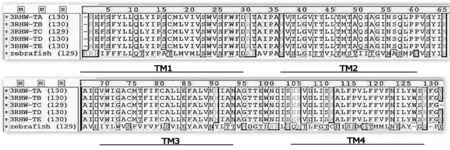
图1 序列比对结果Fig.1 Result of sequence alignment
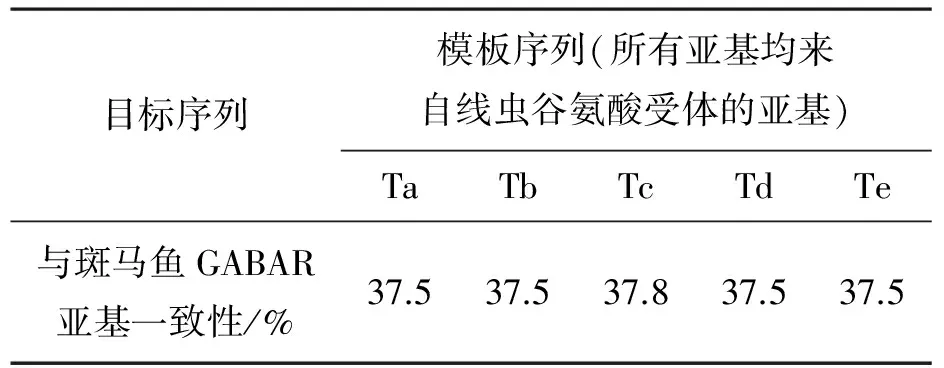
目标序列模板序列(所有亚基均来自线虫谷氨酸受体的亚基)TaTbTcTdTe与斑马鱼GABAR亚基一致性/%37.537.537.837.537.5
经过序列比对、搜索保守区域、构建环区、添加侧链、能量优化后,得到了斑马鱼的各亚基.最终斑马鱼GABAA受体通道区结构见图2,从图2中可清晰的观察到斑马鱼GABAA受体跨膜段是五聚体,TM2组成离子通道.
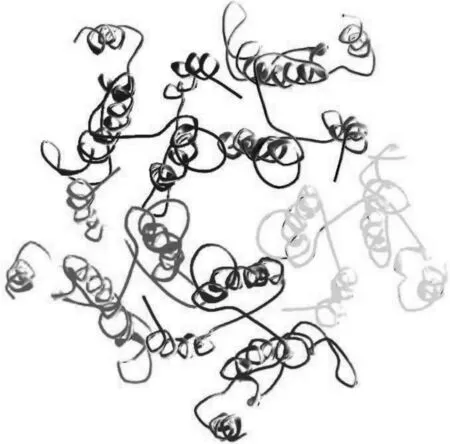
图2 斑马鱼GABAA受体跨膜段三维结构Fig.2 Three-dimensional(3D) molecular structure of the TMD of zebrafish GABAA receptor
为了验证模型的准确性,对构建的斑马鱼GABAA受体跨膜段进行一系列的能量优化和结构修正.利用sybyl软件的Dynamics模块进行分子动力学能量优化后,能量-时间图见图3,斑马鱼的GABAA受体跨膜段模型在开始的150 ps里能量有较大的降低,在随后的350 ps里能量趋于稳定.经过分子动力学能量验证发现,模型是稳定可靠的.
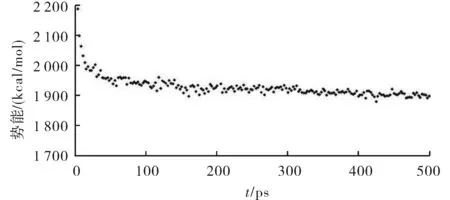
图3 斑马鱼GABAA受体跨膜段500 ps分子动力学计算能量-时间图Fig.3 Potential energy with respect to simulation time for 500 ps molecular dynamics on the zebrafish GABAA receptor
实验中还运用ProTable模块对模型的立体化学性质进行验证.在斑马鱼的GABAA受体跨膜段的拉氏构象图4中,可发现大量的氨基酸残基聚集在值-60、-45度处,这恰恰与模型具有大量α螺旋结构的特点吻合.因为根据氨基酸残基构象的统计结果,构成α螺旋结构的氨基酸残基正好处于拉氏构想图这一区域.通过计算,斑马鱼的GABAA受体模型中99.7%的氨基酸残基处于一般允许区域或者最大允许区域.通过拉氏构象图验证,可以进一步确定模型的合理性.因此在实验中通过同源模建构建得到的GABAA受体跨膜段是可以作为后面实验中分子对接所采用的模型[16].
2.2 分子对接
氟虫腈是一种苯基吡唑类杀虫剂,杀虫广谱,对害虫以胃毒作用为主,兼有触杀和一定的内吸作用,其杀虫机制在于阻滞昆虫GABA受体,是一个比较典型的杀虫剂,具有一个独特的优点即不同的生物物种对其表现出不同的选择性.它对蚜虫、叶蝉、蝇类等重要害虫有很高的杀虫活性,但随着氟虫腈的大量使用,它对水生生物毒性大的弊端暴露出来.因此,研究氟虫腈及其衍生物与水生生物斑马鱼GABAA受体的对接模式,以期从分子角度解释氟虫腈对水生生物产生毒性的原因.
通过对氟虫腈不同基团的取代,得到下列氟虫腈衍生物,将氟虫腈及其衍生物与斑马鱼GABAA受体跨膜区作用位点对接,对接打分及氢键个数如表2所示.
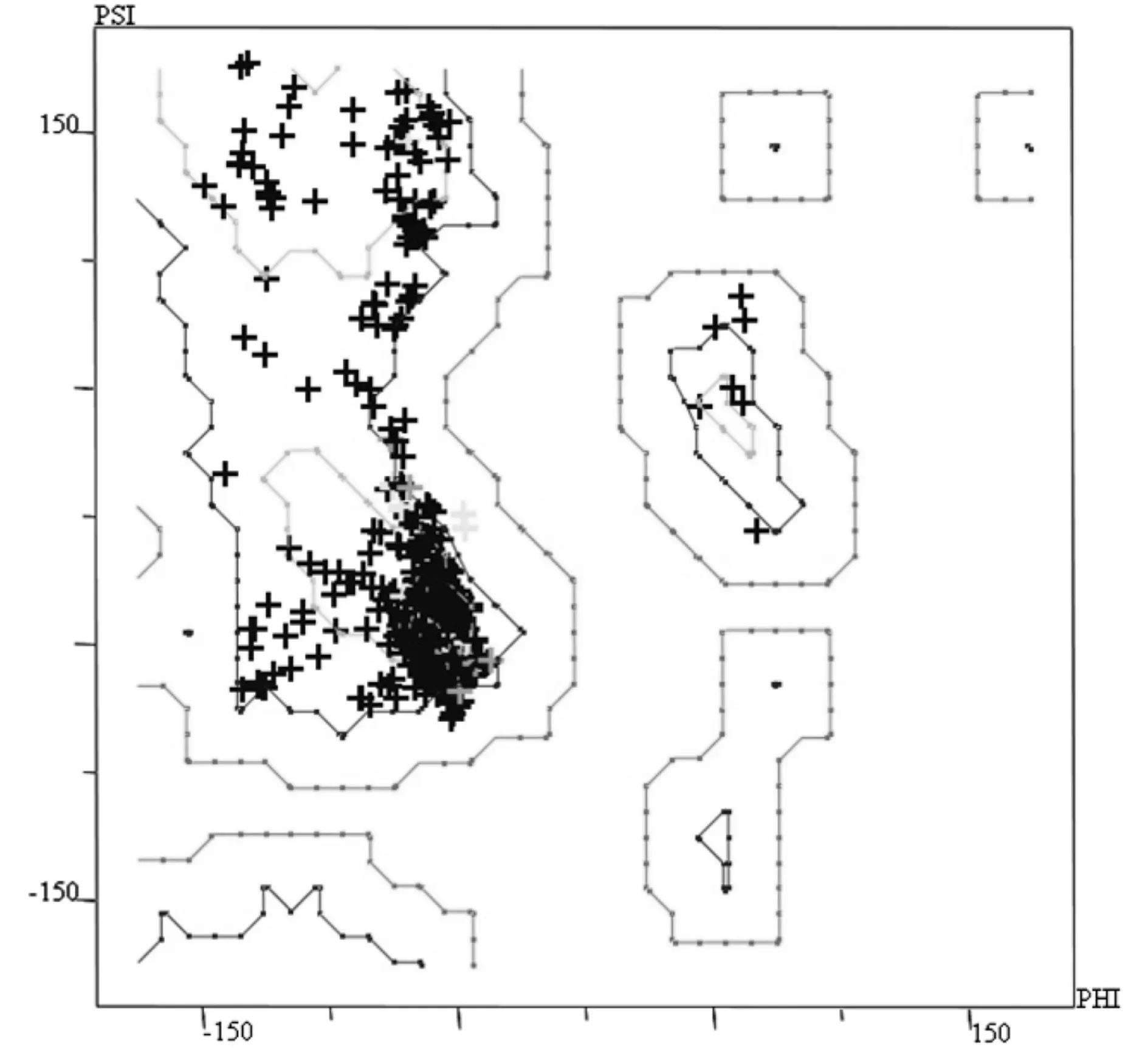
图4 斑马鱼GABAA受体跨膜段氨基酸Ramachandran图Fig.4 φ-ψ Graph of the backbone of zebrafish GABAA receptor
通过对接比较分析可知,苯基上R1、R2、R3、R5分别被CF3,Cl,Cl,SOCF3或SO2CF3取代时,化合物与斑马鱼GABAA受体跨膜段结合较好.说明这些基团是产生作用必不可少的基团.通过在一组对接实验,找到在对斑马鱼GABAA受体跨膜段对接中起关键作用的基团.在此基础上,在NCI-2000数据库中基于氟虫腈结构相似性80%筛选出以下化合物,见图5,将以下化合物分别与斑马鱼GABAA受体对接,得到结果如图5所示.
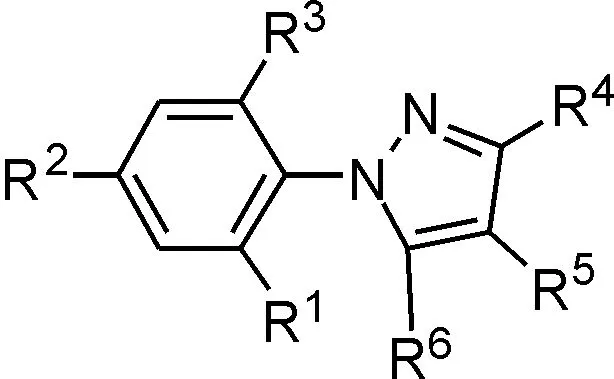

化合物结构编号R1R2R3R4R5R6与斑马鱼GABAA受体对接打分氢键数/个结合自由能/(kcal/mol)1ClCF3ClCNSOCF3NH24.353-5.792ClCF3ClHSOCF3NH24.254-5.673ClCF3ClCNSOCF3H4.034-5.534ClCF3ClCNHNH23.033-4.155ClCF3ClCNSO2CF3NH25.324-6.786ClCF3ClCNSCF3NH23.153-4.227HCF3ClCNSOCF3NH23.124-4.228HCF3HCNSOCF3NH23.843-4.899HHClCNSOCF3NH22.742-3.54续表2 苯基吡唑类化合物结构与斑马鱼GABAA受体跨膜段的对接结果Table2 StructuresofphenylpyrazolederivatesanddockingresultwithzebrafishGABAArceptor10HCF3ClHSOCF3NH23.983-5.2411HCF3ClCNSOCF3H3.483-4.6612HCF3ClCNHNH23.273-4.1313HCF3ClCNSCF3NH23.763-4.7514HCF3ClCNSO2CF3NH23.154-4.2215ClHClCNHNH22.511-3.4216ClHClCNSCF3NH21.980-3.2317ClHClCNSO2CF3NH22.152-3.3318ClHClHSOCF3NH21.750-2.8619ClHClCNSOCF3H2.541-3.4220ClCF3ClHSOCF3H4.442-5.8621ClCF3ClHHNH24.452-5.8622ClCF3ClHSO2CF3NH24.684-6.0523ClCF3ClHSCF3NH24.323-5.8024ClCF3ClCNHH4.082-5.5325ClCF3ClCNSO2CF3H4.315-5.7926ClCF3ClCNSCF3H4.903-6.4527HHHCNSOCF3NH21.492-2.7828HCF3HCNSOCF3H3.722-4.7929HCF3HHSOCF3NH23.563-4.6230HCF3HCNHNH23.962-5.5031HCF3HCNSCF3NH23.073-4.6532HCF3HCNSO2CF3NH23.214-4.3233HCF3ClHSOCF3H3.214-4.3234HCF3ClHHNH22.421-3.3135HCF3ClHSO2CF3NH24.365-5.8036HCF3ClHSCF3NH23.833-4.7537HCF3ClCNHH3.462-4.6638HCF3ClCNSO2CF3H4.015-5.53
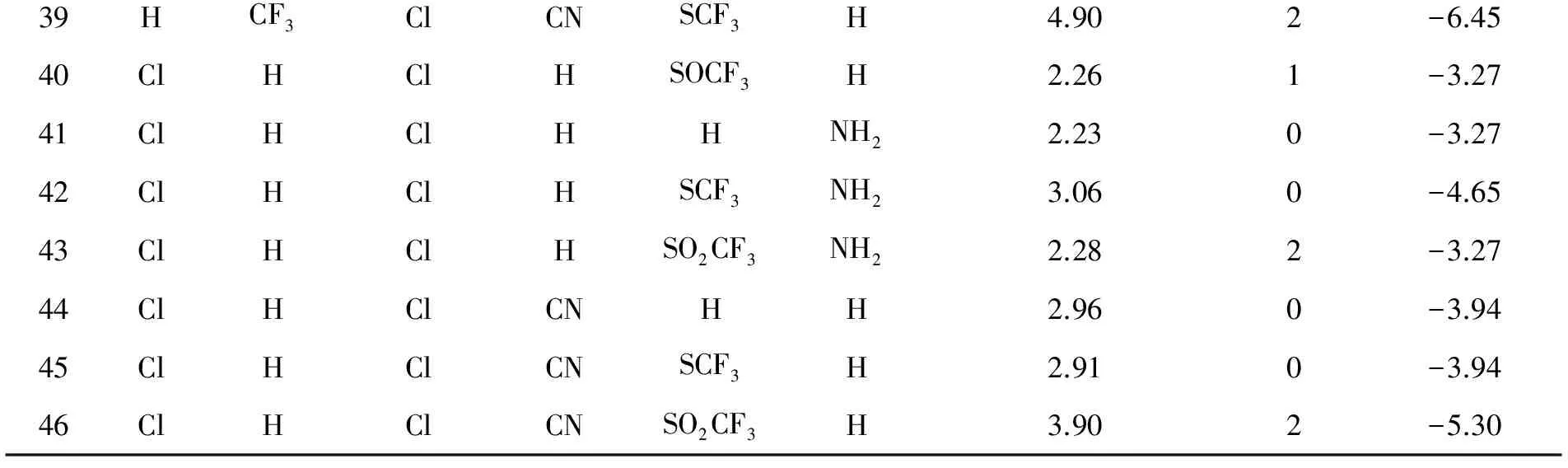
39HCF3ClCNSCF3H4.902-6.4540ClHClHSOCF3H2.261-3.2741ClHClHHNH22.230-3.2742ClHClHSCF3NH23.060-4.6543ClHClHSO2CF3NH22.282-3.2744ClHClCNHH2.960-3.9445ClHClCNSCF3H2.910-3.9446ClHClCNSO2CF3H3.902-5.30

图5 氟虫腈及其虚拟筛选的化合物结构Fig.5 Structures of fipronil and its analogues by virtual sereening
利用surflex-docking将氟虫腈及其虚拟筛选的化合物对接至斑马鱼GABAA受体的结合口袋,在表3中,列出了对接的打分,结合自由能及氢键的个数,将表3中的对接结果与氟虫腈和斑马鱼对接的结果进行比较,经过对一系列化合物对接模式、结合氢键、综合打分等进行分析,可以将化合物分为两组,一组为化合物1,47~59,另一组为60~71:
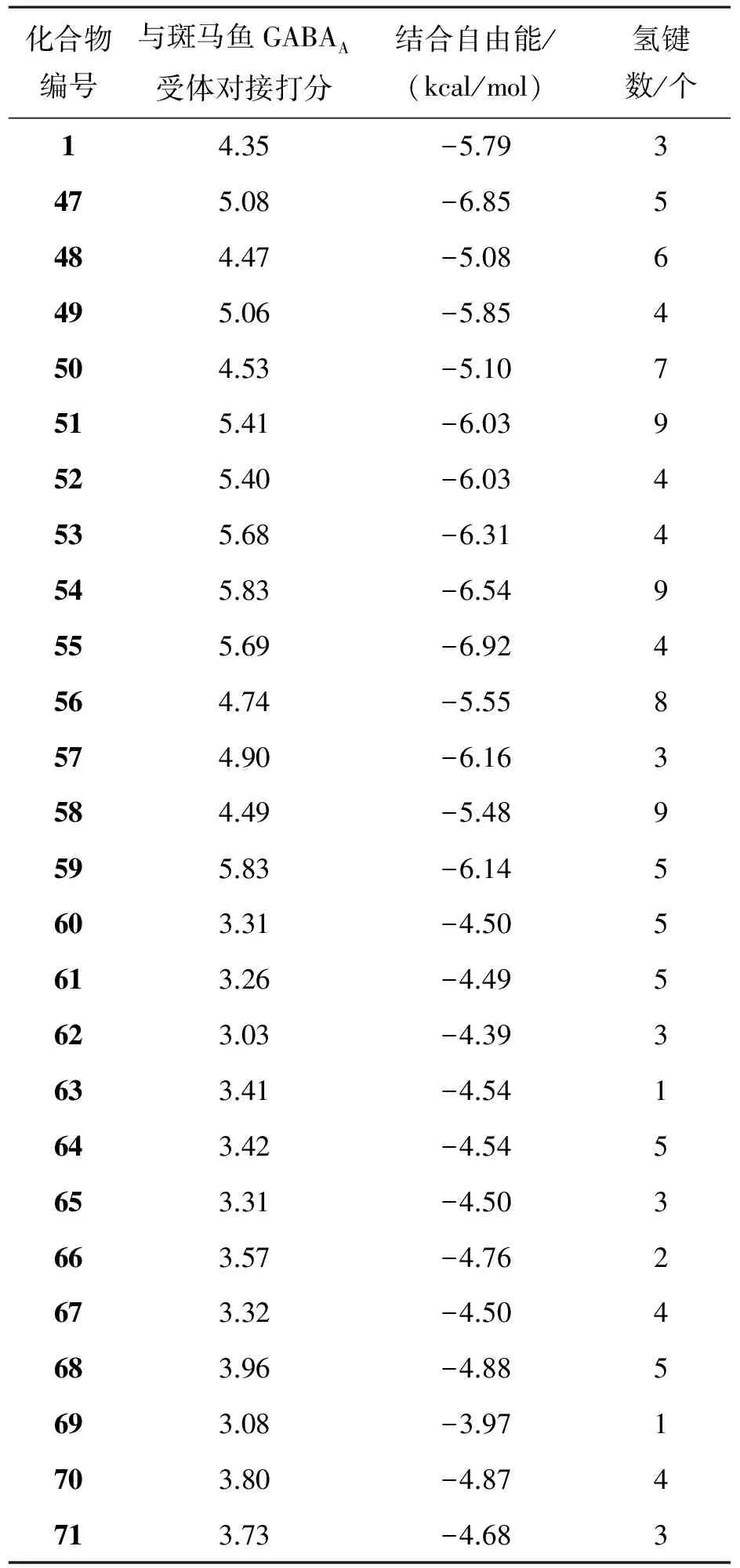
表3 斑马鱼GABAA受体与氟虫腈及其衍生物对接结果Table 3 Docking results of zebrafish GABAA receptor with fipronil and its derivatives
a.在第一组化合物中,从氟虫腈和斑马鱼GABAA受体对接模式,可以解释氟虫腈对斑马鱼的毒性,通过观察其他化合物,发现评分较高的化合物1,47~59都具有相似的结合模式.氟虫腈垂直地定位于TM2的胞质端,两个亚基即链C和D构成了主要的结合口袋.这与之前研究的氟虫腈与家蝇GABAA受体对接的模式相同.另外在图6中可观察到,斑马鱼GABAA受体与氟虫腈对接中,斑马鱼GABAA受体的C/ARG38侧链为氰基的氮原子提供氢键;D/ASN28为氨基的氮原子提供氢键,与化合物47~59的对接中,吡唑环上3位氰基氮原子以及苯甲基氟原子作为氢键受体.
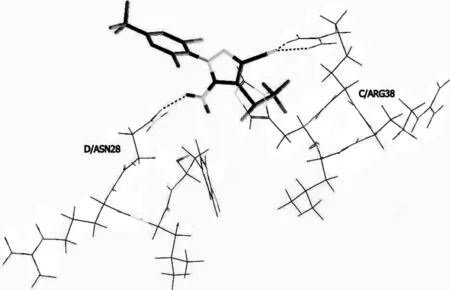
图6 化合物1氟虫腈与斑马鱼GABAA受体对接模式Fig.6 Docking mode of the fipronil with Zebrafish GABAA receptor
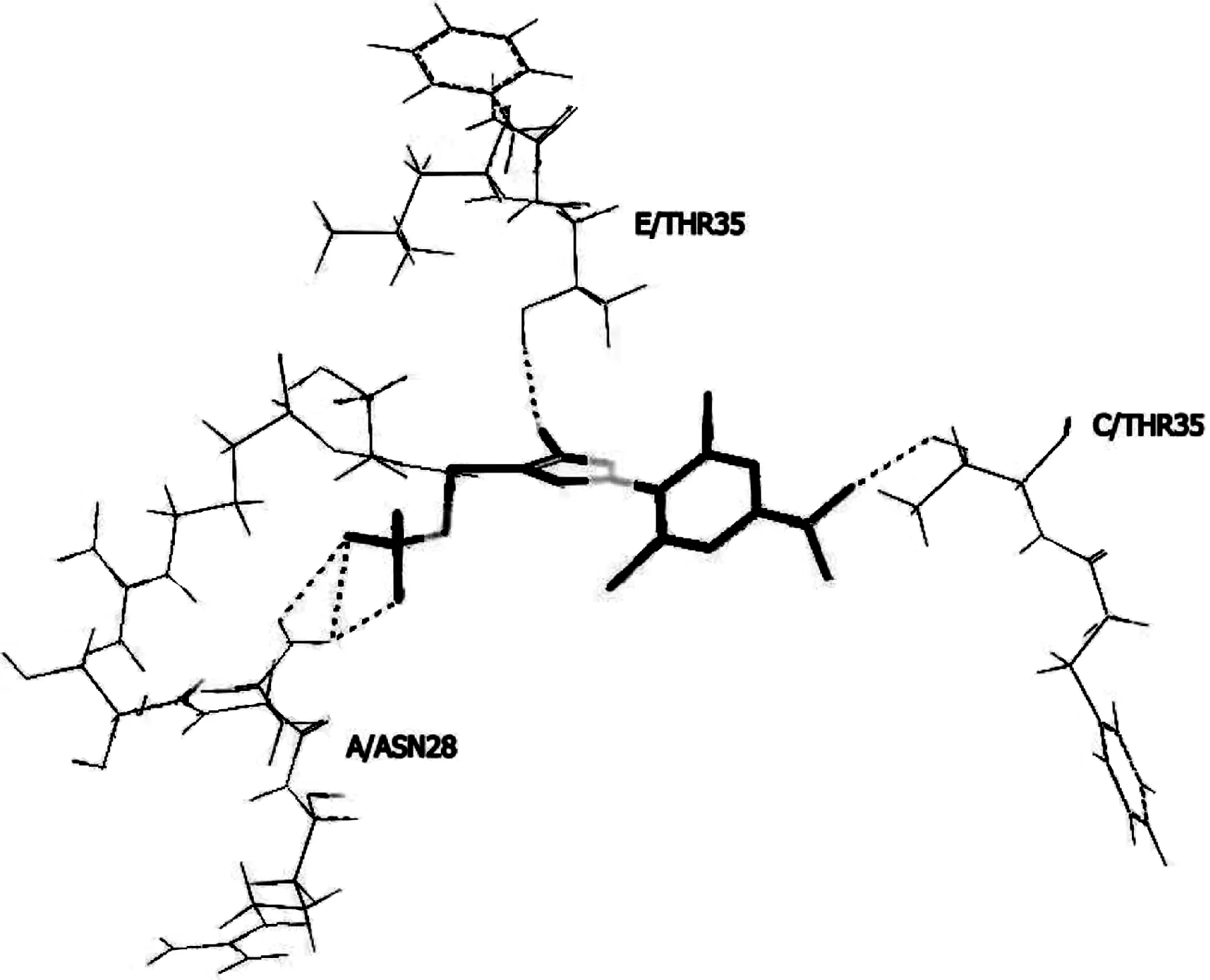
图7 化合物68与斑马鱼GABAA受体对接模式Fig.7 Docking mode of the compound 68 with Zebrafish GABAA receptor
b.第二组化合物与斑马鱼GABAA受体对接评分较低,,一是与第一组化合物比较它们的分子体积较小,因而对接模式与第一组化合物不同,它们不是垂直定位于离子通道,而是横向定位于离子通道,以这种模式对接时,受体与药物分子间作用力较弱,第二组化合物对斑马鱼不产生毒性.图7中斑马鱼GABAA受体与化合物68对接,斑马鱼GABAA受体的C/THR35和E/THR35侧链为三氟甲基上的氟原子和氰基的氮原子提供氢键;A/ASN28为氨基的氮原子提供氢键.从自由结合能上也进一步得到验证[21-22].这一组对接实验验证了苯基吡唑类化合物与斑马鱼GABAA受体对接的最优模式.两组对接实验共同解释了氟虫腈对斑马鱼GABAA受体的对接结合机理.
表4显示了氟虫腈与斑马鱼GABAA受体对接产生的氢键,氢键作用分析确定了在亚基TM2区域C/ARG38和D/ASN28产生关键作用,在斑马鱼GABAA受体与其它氟虫腈衍生物对接过程中,氢键也都是产生于ARG38 和ASN28这两个氨基酸残基.
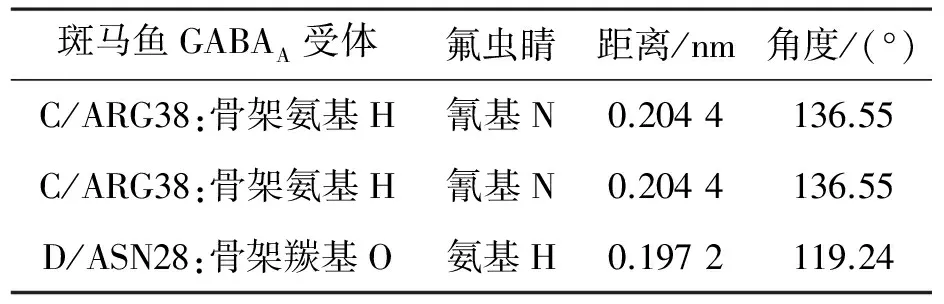
表4 斑马鱼GABAA受体与氟虫睛形成的氢键距离和角度Table 4 Distance and angle of H-bonds formed between zebrafish GABAA receptor and fipronil
在分子对接时,每个配体会产生一系列不同构象与受体结合,并且对每种对接模式进行打分评价,打分排在前10位的构象被保存.从表5可以知道,10个不同构象氟虫腈分子与斑马鱼GABAA受体结合时,对接总打分值较高,D打分、PMF打分、G打分、化学打分这四个打分函数计算的结合能量较低,10个构象的各个打分都比较稳定,这说明在能量上看,氟虫腈和斑马鱼GABAA受体结合稳定,因而氟虫腈对斑马鱼产生毒性.
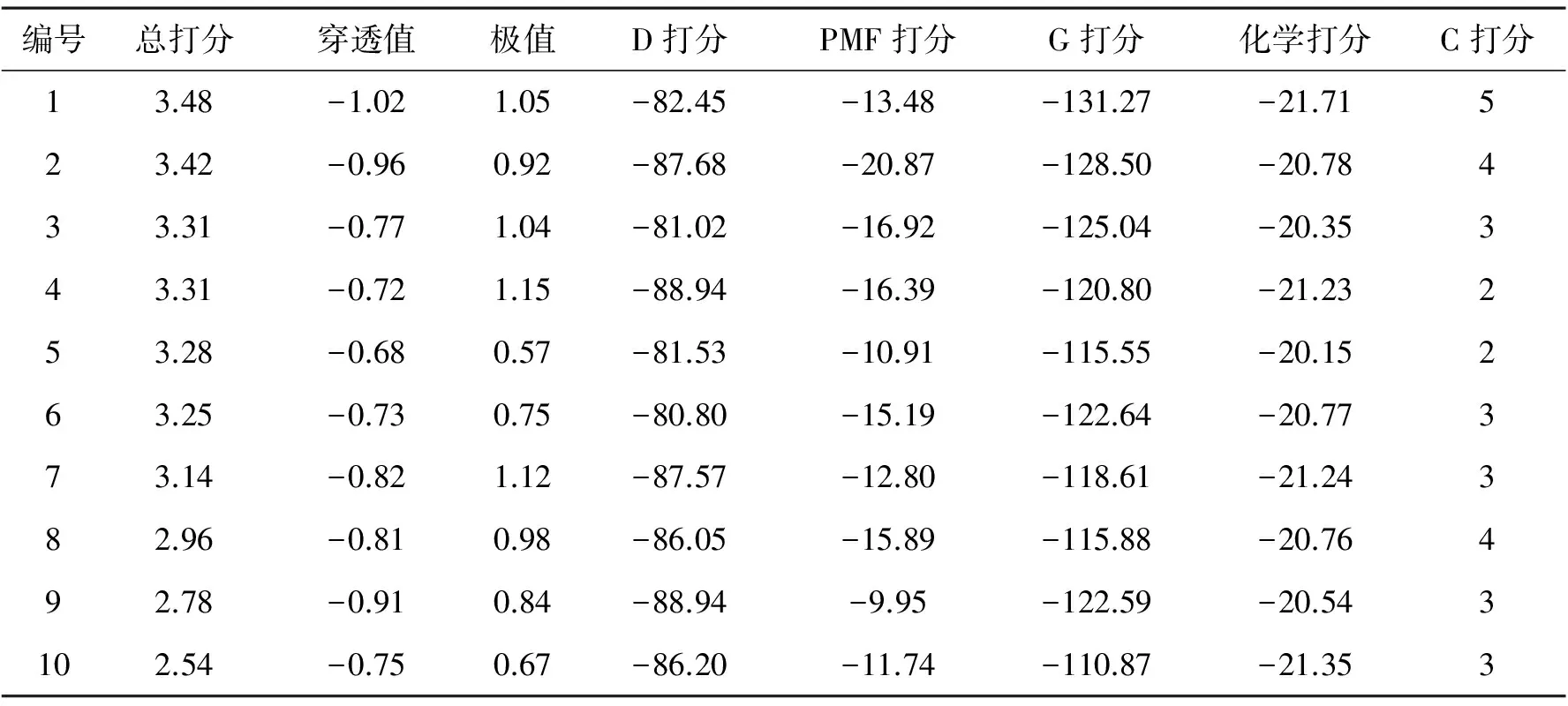
表5 10个不同构想氟虫睛与斑马鱼GABAA受体对接结果Table 5 Docking result of 10 different conformations of fipronil with zebrafish GABAA receptor
3 结 语
本研究通过同源模建构建了斑马鱼GABAA受体跨膜通道区的三维结构,通过能量优化和动力学优化确定了所构建的模型的稳定性和可靠性,进一步利用构建的模型与氟虫腈及其衍生物进行分子对接,通过对对接结果的分析,得知当苯环上R1、R2、R3分别被Cl,CF3和Cl取代时,吡唑环上R5被SOCF3或SO2CF3取代时,化合物与斑马鱼GABAA受体结合稳定,即分子对斑马鱼可能产生毒性.当分子体积较大时,化合物1,47~59垂直地定位于TM2的胞质端,这种结合模式更稳定,而分子体积相对较小的化合物60~71则横向定位于离子通道结合模式也相对不稳定,因而氟虫腈衍生物对斑马鱼产生毒性的一个重要原因是分子体积应该足够大.
综上所述,在对氟虫腈分子的进一步研究中,可以从分子体积大小与苯环和吡唑换上的取代基基上做一些改变,从而开发出对害虫高选择性,而对其他水生生物低毒的杀虫剂.
致谢
感谢武汉工程大学化工与制药学院为本实验提供的研究平台!
参考文献:
[1] 巨修练.GABAA受体及其非竞争性拮抗剂的研究进展[J].世界农药,2007,29(1):28-33.
JU Xiu-lian. Progress in Study of GABAA Receptor and Its Noncompetitive Antagonists[J].World Pesticides, 2007,29(1):28-33.(in chinese)
[2] 王秀坤.NIELSEN M.GABAA受体药理学研究进展[J].国外医学药学分册,2001,28(1):29-34.
WANG Xiu-kun, NIELSEN M .Progress in Study of GABAA Receptor pharmacology[J].Foreign Medical Sciences section on Pharmacy, 2001,28(1):29-34.(in chinese)
[3] 王世明,张颖奇,李晓立.GABAA受体研究进展[J].中国局解手术学杂志,2001,10(3):307-308.
WANG Shi-ming, ZHANG Ying-qi, Li Xiao-li.Progress in Study of GABAA Receptor[J].Chin J Regional Anat & Operative Surg, 2001,10(3):307-308.(in chinese)
[4] O'MARA M, CROMER B, PARKER M, et al. Homology model of the GABAA receptor examined using Brownian dynamics[J]. Biophysical Journal, 2005, 88(5): 3286-3299.
[5] HOSIE A M, ARONSTEIN K, SATTELLE D B, et al. Molecular biology of insect neuronal GABA receptors[J]. Trends in Neurosciences, 1997, 20(12): 578-583.
[6] PERRET P, SARDA X, WOLFF M, et al. Interaction of non-competitive blockers within the gamma-aminobutyric acid type A chloride Channel using chemically reactive probes as chemical sensors for cysteine mutants[J]. Journal of Biological Chemistry, 1999, 274(36): 25350-25354.
[7] CHEBIB M, JOHNSTON G A. GABA-Activated ligand gated ion channels: medicinal chemistry and molecular biology[J]. Journal of Medicinal Chemistry, 2000, 43(8): 1427-1447.
[8] FUCILE S, DE SAINT JAN D, DAVID-WATINE B, et al. Comparison of glycine and GABA actions on the zebrafish homomeric glycine receptor[J]. The Journal of Physiology, 1999, 517 ( Pt 2)(2): 369-383.
[9] GUSTAV A, LI Ping, BRACAMONTES J, et al. Pharmacology of structural changes at the GABAA receptor transmitter binging site[J]. Birtish Journal of Pharmacology, 2011, 162: 840-850.
[10] 张瑞华,李丽琴,王惠芳,等.A型γ-氨基丁酸受体结构及其有关药物[J].生命的化学,2003,23(6):441-443.
ZHANG Rui-hua, LI Li-qin, WANG Hui-fang, et al. Structure and Related Drugs to GABAA Receptors[J]. Chemistry of life, 2003,23(6):441-443.(in chinese)
[11] ZHANG Rong-wei, WEI Hong-ping, XIA Yi-meng, et al. Development of light response and GABAergic excitation-to-inhibition Switch in zebrafish retinal ganglion cells[J]. The Journal of Physiology, 2010, 588(Pt 14): 2557-2569.
[12] GOLDSCHEN-OHM M P, WAGNER D A, PET-ROU S, et al. An epilepsy-related region in the GABA(A) receptor mediates long-distance effects on GABA and benzodiazepine binding sites[J]. Molecular Pharmacology, 2010, 77(1): 35-45.
[13] CHEN Ligong, DURKIN K A, CASIDA J E. Spontaneous mobility of GABAA receptor M2 extracellular half relative to noncompetitive antagonist action[J]. The Journal of Biological Chemistry, 2006, 281(50): 38871-38878.
[14] TASNEEM A, IYER L M, JAKOBSSON E, et al. Identification of the prokaryotic ligand-gated ion channels and their implications for the mechanisms and origins of animal Cys-loop ion channels[J]. Genome Biology, 2005, 6(1): R4.
[15] HINZ F I, DIETERICH D C, TIRRELL D A, et al. Non-canonical amino acid labeling in vivo to visualize and affinity purify newly synthesized proteins in larval zebrafish[J]. ACS Chemical Neuroscience, 2012, 3(1): 40-49.
[16] OGGIER D M, WEISBROD C J, STOLLER A M, et al. Effects of diazepam on gene expression and Link to physiological effects in different Life stages in zebrafish Danio rerio[J]. Environmental Science & Technology, 2010, 44(19): 7685-7691.
[17] ZHOU Pei, LU Yitong, LIU Baofeng, et al. Dynamics of fipronil residue in vegetable-field ecosystem[J]. Chemosphere, 2004, 57(11): 1691-1696.
[18] ZHAO X L, YEH J Z, SALGADO V L, et al. Fipronil is a potent open Channel blocker of glu-tamate-activated chloride channels in cockroach neurons[J]. The Journal of Pharmacology and Exp-erimental Therapeutics, 2004, 310(1): 192-201.
[19] CORRINGER P J, BAADEN M, BOCQUET N, et al. Atomic structure and dynamics of pentameric ligand-gated ion channels: new insight from bacterial homologues[J]. The Journal of Physiology, 2010, 588(Pt 4): 565-572.
[20] CHEN Ligong, DURKIN K A, CASIDA J E. Structural model for gamma-aminobutyric acid receptor noncompetitive antagonist binding: widely diverse structures fit the same site[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(13): 5185-5190.
[21] MITEVA M A, LEE W H, MONTES M O, et al. Fast structure-based virtual ligand screening combining FRED, DOCK, and Surflex[J]. Journal of Medicinal Chemistry, 2005, 48(19): 6012-6022.
[22] CHENG Jin, JU Xiu-lian, CHEN Xiang-yang, et al. Homology modeling of human α1β2γ2 and house fly β3 GABA receptor channels and Surflex-docking of fipronil[J]. Journal of Molecular Modeling, 2009, 15: 1145-1153.

