清火栀麦片中化学成分的SPE—HPLC—ESI—MSn快速识别与鉴定
张加余,乔延江,高晓燕,张倩,马群,卢建秋
[摘要] 目的:建立一种固相萃取-高效液相色谱-电喷雾串联质谱(SPE-HPLC-ESI-MSn)分析方法,对清火栀麦片中主要的化学成分进行快速识别与鉴定。方法:根据HPLC-ESI-MSn负离子模式下的分子离子峰以及碎片离子获得化合物的结构信息,并通过与文献数据或对照品对照,确定化合物可能的结构。结果:通过对清火栀麦片及其组方药味进行比较分析,归属并鉴定了其中的39个化学成分,包括7个咖啡酰奎尼酸、7个环烯醚萜、6个二萜内酯、5个高异黄酮、13个甾体皂苷以及1个黄酮类成分。结论:该研究为鉴别清火栀麦片中的化学成分提供了一种简便、快速的方法。
[关键词] 高效液相色谱-电喷雾串联质谱;固相萃取;清火栀麦片;化学成分鉴定
中药是通过“多成分、多靶点、多途径”模式来发挥整体药效的。因此,阐明中药药效物质基础是中药现代研究的重点基础性工作。近年来,液相色谱-电喷雾质谱(HPLC-ESI-MS)联用技术将高效液相色谱优秀的分离能力与质谱高灵敏度和高专属性的检测有机地结合在一起,为中药复杂体系中化学成分的快速识别和鉴定提供了重要的方法[1-7]。
清火栀麦片收载于2010年版《中国药典》一部,由穿心莲、栀子、麦冬3味药组成,方中穿心莲清热解毒、凉血消肿,栀子泻火除烦、清肝明目,麦冬养阴生津、润肺清心,3味药合用共奏清热解毒、凉血消肿之功效,主要用于肺胃热盛所致的咽喉肿痛、发热、牙痛、目赤等[8]。目前,该制剂的物质基础研究工作比较薄弱,仅有数篇针对制剂中主要成分穿心莲内酯、脱水穿心内酯、栀子苷的含量测定方法研究[9-10]。为了阐明清火栀麦片的药效物质基础,本研究采用SPE-HPLC-ESI-MSn对其中主要的化学成分进行了快速归属和鉴定。
1 材料
Agilent 1100 series液相色谱仪系统;Agilent XCT plus型电喷雾离子阱质谱仪系统;KQ-300DE型医用数控超声波清洗器(昆山市超声仪器有限公司), Waters Sep-Pak-C18固相萃取柱。色谱级乙腈和甲醇均购自Fisher Scientific,乙酸购自Sigma Aldrich,超纯水由Milli-Q超纯水系统(Millipore, USA)制得。
栀子苷(批号 110749-200714),穿心莲内酯(批号 110797-200307),脱水穿心莲内酯(批号 110854-200306)购自中国食品药品检定研究院;绿原酸,新绿原酸,异绿原酸A,异绿原酸C,山栀苷,京尼平苷等对照品购自成都普瑞法科技开发有限公司,纯度均大于98%;麦冬皂苷D,麦冬皂苷C,sprengerinin C,14-hydroxy sprengerinin C,麦冬黄烷酮A,甲基麦冬高异黄酮A,甲基麦冬二氢高异黄酮B等对照品均为从麦冬药材中分离得到,其结构经1H-NMR,13C-NMR等手段得以确定,经HPLC归一化法检测,纯度均大于95%,可作对照品使用。清火栀麦片购自广西圣民制药有限公司,批号110301;穿心莲Andrographis paniculata和栀子Gardenia jasminoides Ellis购自北京同仁堂药店,麦冬Ophiopogon japonicus购自四川新荷花中药饮片股份有限公司,经北京中医药大学中药学院乔延江教授鉴定,均符合2010年版《中国药典》规定。
2 方法
2.1 色谱条件
采用Agilent-Zorbax Extend C18(4.6 mm×250 mm,5 μm)色谱柱;流动相A为乙腈-甲醇(3∶1)混合溶液,B为0.2%乙酸水溶液;线性梯度洗脱,0~5 min,2%~8% A;5~10 min,8%~12% A;10~20 min,12%~15% A;20~25 min,15%~21% A;25~36 min,21%~24% A;36~42 min,24%~24% A;42~56 min,24%~36% A;56~72 min,36%~36% A;72~90 min,36%~49% A;90~120 min,49%~81% A。流速1.0 mL·min-1;柱温30 ℃;二极管阵列检测器(DAD)记录200~400 nm紫外光谱图,检测波长为254 nm。
2.2 质谱条件
负离子模式检测;雾化气和干燥气均为氮气,碰撞气为氦气;干燥气流速11 L·min-1;雾化室压力275.79 kPa;雾化温度350 ℃;毛细管电压3 500 eV;目标质量数m/z 500,全扫描范围为m/z 100~1 400;多级质谱为3级;化合物稳定性(compound stability)为100%;离子阱驱动水平(trap drive level)为50%。流动相进入质谱检测器的量为0.25 mL·min-1。
2.3 对照品溶液的配制
分别取各对照品适量,精密称定,加甲醇制成约0.1 g·L-1的储备液。将对照品储备液用甲醇稀释10倍后进样,进样量为5 μL。
2.4 清火栀麦片及其组方药味供试品溶液的制备
取清火栀麦片,除去糖衣,研细,取2.0 g,精密称定,置50 mL的具塞锥形瓶中,精密加入70%甲醇25 mL,超声提取30 min,放冷,摇匀,滤过,水浴挥至近干后用2 mL水溶解,过固相萃取小柱(预先以2 mL甲醇和2 mL水平衡),依次用水和90%甲醇各5 mL洗脱,收集90%甲醇洗脱部分,水浴浓缩,转移至1 mL量瓶中,加甲醇稀释至刻度,即得制剂供试品溶液。按处方量分别称取单味药材,同法制成栀子、穿心莲、麦冬供试品溶液。所有供试品溶液均以0.22 μm微孔滤膜滤过,进样量为5 μL。
3 结果与分析
3.1 供试品溶液制备条件的优化
清火栀麦片处方中栀子和穿心莲(处方量一半)是原粉形式入药的,而麦冬和另一半的穿心莲药材则是以水提物制成制剂的。由于麦冬药材中含有大量的多糖,其主要的指标性成分甾体皂苷和高异黄酮都极易被掩盖而难以被检测到。为了在HPLC-ESI-TIC图中更好地体现出3味中药的配伍应用,实验采用固相萃取法除去制剂中的糖类等的干扰,从而检出麦冬中的甾体皂苷和高异黄酮类成分。
3.2 液质分析条件的优化
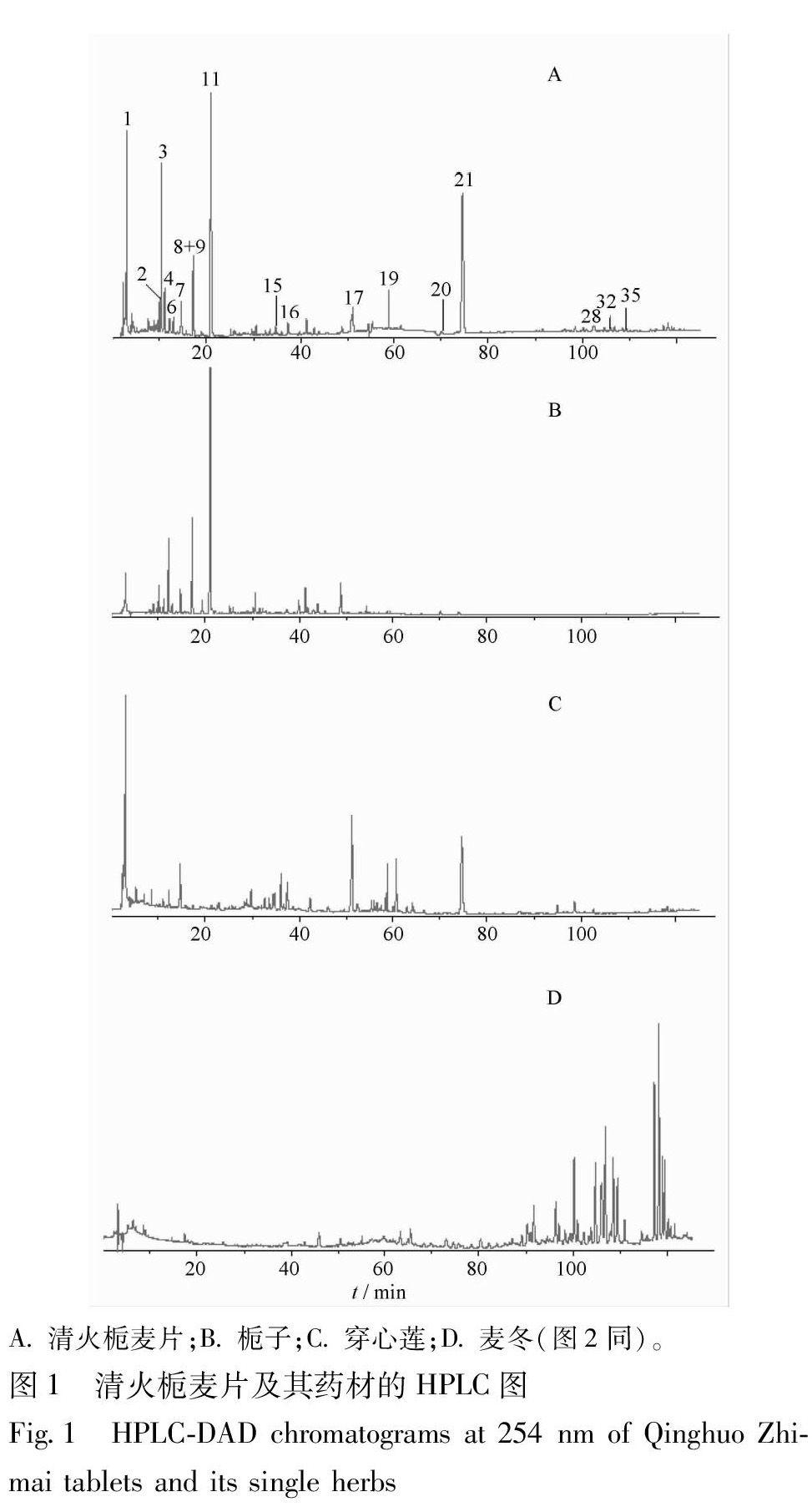
常规的反相色谱流动相多采用甲醇-水或乙腈-水系统,但实验结果表明,采用乙腈-甲醇-水三元系统时样品的色谱峰数量最多,且各色谱峰分离度好,保留时间适中,故选择乙腈-甲醇-水梯度系统为流动相。同时,为减少黄酮等酸性成分在色谱柱上的拖尾情况,并提高各类成分的质谱检测响应强度,实验采用乙酸作为改性剂。制剂中的高异黄酮、环烯醚萜以及咖啡酰奎尼酸等成分在DAD上响应较强,而甾体皂苷类成分在MS上响应较好,综合考虑以上因素,并优化了液相分析条件,选择254 nm作为检测波长,结果见图1。
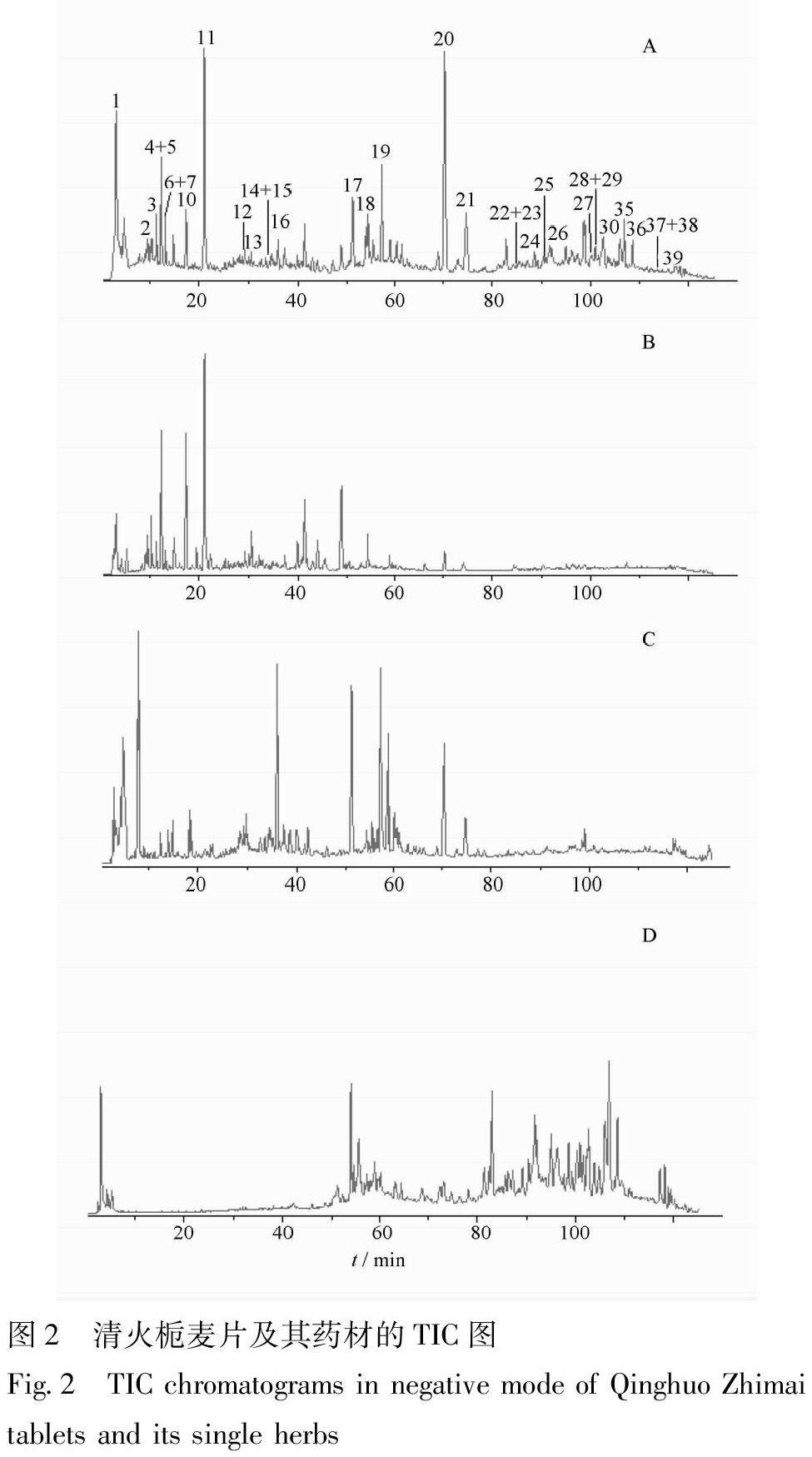
实验还对质谱的干燥气流速、雾化室压力、雾化温度以及毛细管电压等参数进行了优化,确定采用负离子模式进行检测。制剂中的各类成分均有较高的响应值,利于后续的LC-MS数据分析,见图2。
3.3 化学成分的鉴定
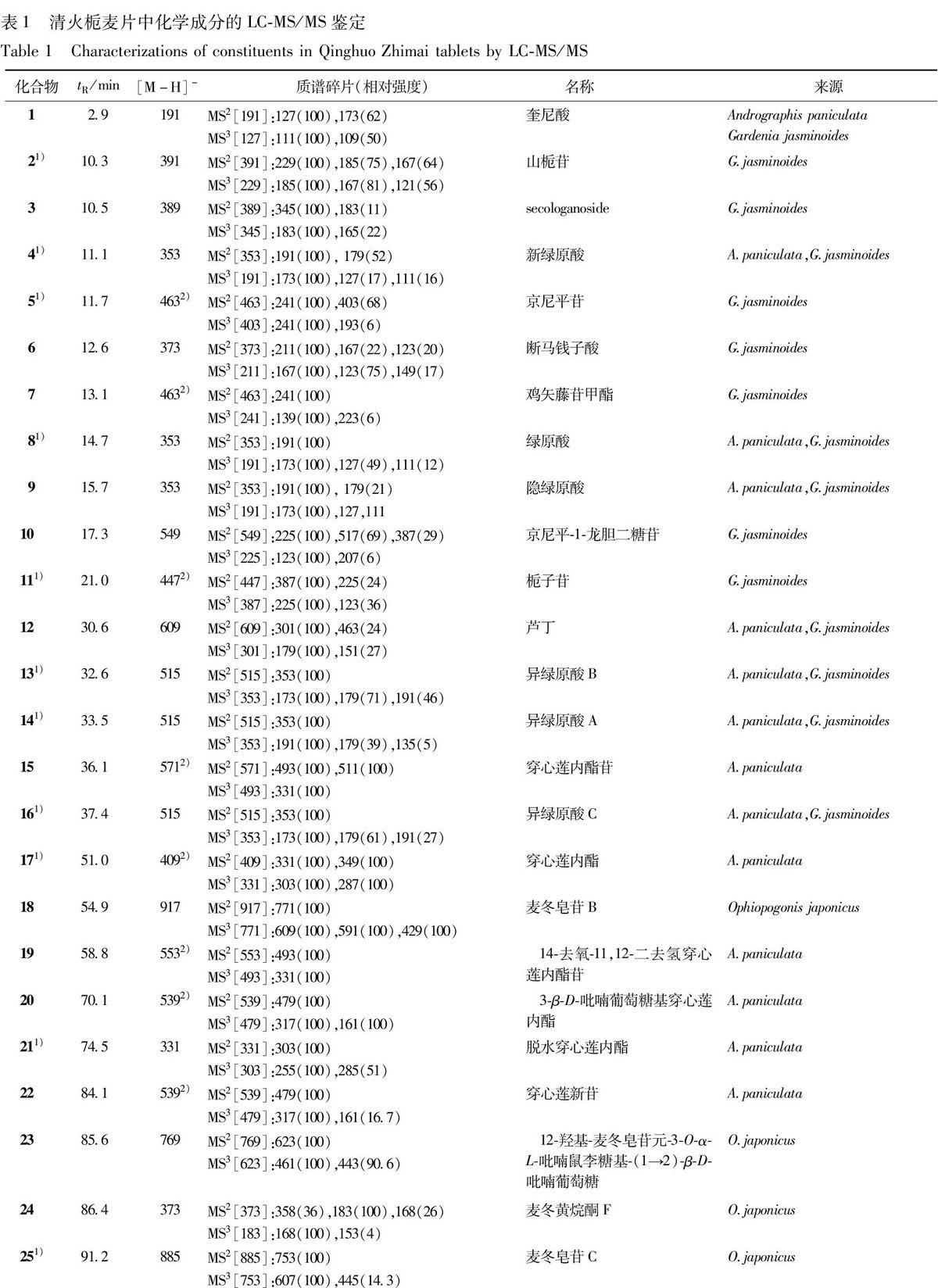
清火栀麦片是由3味中药原粉或提取物制成的,所含的化学成分类型繁多,且结构复杂。在HPLC-ESI-MSn分析过程中,通过分析ESI-MS/MS提供的化合物分子量信息、多级质谱裂解碎片的种类以及相对丰度等信息,并结合文献报道,从其中快速鉴定了39个化学成分,结果见表1。
3.3.1 咖啡奎尼酸类成分的鉴定 咖啡酰奎尼酸类(caffeoylquinic acids)化合物是一类由奎尼酸和不同数目的咖啡酸通过酯化反应缩合而成的酚酸类化合物,广泛存在于自然界植物中,具有显著的抗氧化活性[11]。从制剂和各药味的TIC色谱图对比可以看出,成方中的该类成分均来源于穿心莲和栀子药材。
化合物1的tR为2.9 min,表明其极性非常大,其[M-H]-离子在MS 2谱和MS 3谱中均可见中性丢失水分子(18 Da)的反应,说明该化合物结构中含有较多的羟基基团,因此将其鉴定为咖啡酰奎尼酸类成分生物合成的原料之一——奎尼酸。
化合物4,8,9均产生相同的[M-H]-离子m/z 353,同时在MS 2谱中还产生m/z 191 [奎尼酸-H] -离子或m/z 179 [咖啡酸-H] -等,表明它们为单咖啡酰奎尼酸类成分。一般说来,当咖啡酰基取代在3或5位时,都会产生m/z 191的基峰离子,但前者产生的m/z 179丰度较后者要高,而当咖啡酰基取代在4位时,m/z 173 [191-H2O]-是其MS 2谱的基峰离子[12]。据此推断它们分别为新绿原酸、绿原酸和隐绿原酸,这和通过与对照品比对得出的结论一致。
化合物13,14,16均产生相同的[M-H]-离子m/z 515以及m/z 353离子,据此可断定它们为二咖啡酰奎尼酸类成分。从碎片离子的种类以及数量来看,三者基本相同,但所产生的离子丰度存在较大差异。化合物14的MS 3谱中只产生了m/z 191的基峰离子,推断咖啡酰基取代位置位于3,5位,因此可以将其鉴定为异绿原酸A。而其他2个化合物,ESI-MS 3谱均产生m/z 179,173的碎片离子,可确定它们结构中的一个咖啡酰基取代位置位于4位。由于异绿原酸A在反相柱上较异绿原酸C容易被洗脱下来[13],因此推断化合物13,16分别为异绿原酸B和异绿原酸C。上述推断也与通过与对照品比对得出的结论相符。
3.3.2 环烯醚萜类成分的鉴定 环烯醚萜类(iridoids)化合物是一类具有环戊烷结构单元的单萜衍生物,是栀子的主要有效成分。在清火栀麦片的ESI-TIC谱中,化合物3和6的[M-H]-离子分别为m/z 389,373,裂解方式也存在差异:后者在MS 2谱中先中性丢失CO2,形成m/z 345,其后在MS 3谱中继续丢失1分子葡糖糖残基和1分子H2O,得到m/z 165,而前者的裂解顺序正好颠倒。在上述裂解过程中,前者中性丢失了2分子CO2,而后者只脱掉了1分子CO2,表明后者分子结构中有可能比后者少1个羧基,故将两者分别鉴定为secologanoside和 secologanic acid[14]。化合物2,5,7,10,11在负离子模式下的二级碎片多为丢失葡萄糖残基 (162 Da),生成稳定的[M-H-glu]-或[M-H-2glu]-离子,同时伴有中性丢失H2O和CO2等。根据对照品比对结果和文献报道[15],上述化合物的结构均得到了准确鉴定或推断。
3.3.3 二萜内酯类成分的鉴定 二萜内酯类(diterpenoid lactones)化合物是穿心莲主要的药理活性成分。在负离子模式下,该类化合物极易产生丰度最大的[M+CH3COO]-离子,同时通过中性丢失乙酸(60 Da)、葡萄糖残基(162 Da)或H2O(18 Da)等而产生诊断离子m/z 331(穿心莲内酯类)或m/z 317(新穿心莲内酯类)。根据ESI-MS/MS提供的分子量和离子碎片信息,结合已知化合物穿心莲内酯和脱水穿心莲内酯的ESI-MS/MS裂解特征,对制剂中的二萜内酯类化合物进行了鉴定或尝试性指认[16-18]。
3.3.4 高异黄酮类成分的鉴定 高异黄酮类(homoisoflavonoids)化合物是麦冬药材的特征性化学成分。有关高异黄酮类化合物电喷雾离子阱质谱的裂解规律已有较多的文献研究[19-21]。研究表明,其裂解途经与普通黄酮类化合物有显著的差别,二氢高异黄酮及高异黄酮有各自独特的裂解途径,见图3。结合上述裂解规律,从制剂中检测到5个高异黄酮类成分,通过与对照品对照比对准确鉴定了3个化合物的结构,并结合保留时间、质谱裂解规律对其余2个化合物的结构进行了推测。
3.3.5 甾体皂苷类成分的鉴定 甾体皂苷类(steroidal saponins)成分是麦冬药材的另一类特征性化学成分。在负离子模式下,它们的ESI-MS谱主要生成[M-H]-及[M+CH3COO]-准分子离子。不同化合物准分子离子的多级质谱裂解途径非常相似,均表现为一系列糖残基(葡萄糖、鼠李糖、木糖等)的丢失。对于糖链部分有乙酰基取代的化合物,[M-H]-离子在它们的MS/MS谱中会丢失乙烯酮基(42 Da)特征碎片,此外尚可观察到[M-H-CH2CO-H2O]-离子信号。根据上述规律,共从制剂中检测到了13个甾体皂苷类成分。通过与对照品比对保留时间以及多级质谱数据,准确鉴定了4个甾体皂苷的结构,并参考文献对其余9个化合物的结构进行了推断[22-24]。
3.3.6 其他类成分的鉴定 在制剂中,尚有其他类成分存在。如化合物12(tR=30.6 min),其ESI-MS中的准分子离子峰为m/z 609,其在进一步的裂解中通过丢失芸香糖残基而产生m/z 301,并接着发生一系列与黄酮类成分相似的ESI-MS/MS裂解反应。因此将其鉴定为芦丁(rutin)。
4 讨论
实验表明,本文应用建立的SPE-HPLC-ESI-MSn从清火栀麦片中快速鉴定了39个化合物,包括7个咖啡酰奎尼酸、7个环烯醚萜、6个二萜内酯、5个高异黄酮、13个甾体皂苷以及1个黄酮类成分。在这些化合物中,来源于穿心莲药材的有14个,来源于栀子药材的有15个,来源于麦冬药材的有18个,其中有8个化合物来源于穿心莲和栀子2味药材。
同时,由于紫外检测器的局限和对照品的缺乏,采用传统的HPLC根本无法阐明该中药制剂的物质基础。而本研究所建立的SPE-HPLC-ESI-MSn不仅将固相萃取法应用于样品前处理过程中,而且将灵敏度高、检测范围广的ESI-MS/MS技术应用于成分的快速识别和鉴定中,通过质谱检测器提供的分子离子峰以及离子碎片获得化合物的结构信息,结合文献报道的化学成分以及质谱裂解数据,对清火栀麦片中的化学成分进行了深入研究,为阐明清火栀麦片的物质基础提供了一种简便、快速的方法。
[参考文献]
[1] 张朝凤, 陈录新, 张勉, 等.千里光药材的HPLC指纹图谱及ESI-MS分析[J].中国中药杂志, 2008, 33(18):2093.
[2] Zhang J Y, Li N, Che Y Y, et al.Characterization of seventy polymethoxylated flavonoids (PMFs) in the leaves of Murraya paniculata by on-line high-performance liquid chromatography coupled to photodiode array detection and electrospray tandem mass spectrometry[J].J Pharm Biomed Anal, 2011, 56: 950.
[3] Xiao W L, Motley T J, Unachukwu U J, et al.Chemical and genetic assessment of variability in commercial Radix Astragali (Astragalus spp.) by ion trap LC-MS and nuclear ribosomal DNA barcoding sequence analyses[J].J Agric Food Chem, 2011, 59: 1548.
[4] 魏元锋, 林晓, 张宇, 等.大川芎方效应组分血中移行成分的UPLC-MS分析[J].中国中药杂志, 2011, 36(9):1245.
[5] Yang J, Li D, Hu L L, et al.Rapid characterization of caged xanthones in the resin of Garcinia hanburyi using multiple mass spectrometric scanning modes: the importance of biosynthetic knowledge based prediction[J].J Pharm Biomed Anal, 2012, 60: 71.
[6] 郭戎, 束艳, 张丽.四逆散化学成分的UPLC-ESI/MS分析[J].中国中药杂志, 2011, 36(22):3114.
[7] 沈建芳, 汪红, 王强, 等.丹参中丹参酮成分的HPLC-MS(n)研究[J].中国现代应用药学, 2010, 27(10):94.
[8] 中国药典.一部[S].2010:1113.
[9] 陈海滨, 刘洪旭, 吴春敏.RP-HPLC法测定清火栀麦胶囊中穿心莲内酯和脱水穿心莲内酯的含量[J].药物分析杂志, 2007, 27(3):434.
[10] 郭敏, 钟保恒, 李可林.HPLC法同时测定清火栀麦胶囊中脱水穿心莲内酯和栀子苷的含量[J].药物分析杂志, 2008, 28(11):1921.
[11] Iwai K, Kishimoto N, Kakino Y, et al.In vitro antioxidative effects and tyrosinase inhibitory activities of seven hydroxycinnamoyl derivatives in green coffee beans[J].J Agric Food Chem, 2004, 52: 4893.
[12] Ye M, Yan Y N, Guo D A, et al.Characterization of phenolic compounds in the Chinese herbal drug Tu-Si-Zi by liquid chromatography coupled to electrospray ionization mass spectrometry[J]. Rapid Commun Mass Spectrom, 2005, 19: 1469.
[13] Loffler C, Sahm A, Wray V, et al.Soluble phenolic constituents from Cuscuta reflexa and Cuscuta platyloba[J].Syst Ecol, 1995, 23: 121.
[14] 毕跃峰, 田野, 裴珊珊, 等.金银花中裂环环烯醚萜苷类化学成分研究[J].中草药, 2008, 39(1):18.
[15] Zhang H Y, Hu P, Guo D A, et al.Screening and identification of multi-component in Qingkailing injection using combination of liquid chromatography/time-of-flight mass spectrometry and liquid chromatography/ion trap mass spectrometry[J].Anal Chim Acta, 2006, 577: 190.
[16] 蒋珍藕.穿心莲属植物化学成分研究进展[J].中成药,2011, 33(8): 1382.
[17] 陈丽霞, 曲戈霞, 邱峰.穿心莲二萜类化学成分的研究[J].中国中药杂志, 2006, 31(19):1594.
[18] 王国才, 胡永美, 张晓琦, 等.穿心莲的化学成分[J].中国药科大学学报, 2005, 36(5):405.
[19] Ye M, Guo D A.Analysis of homoisoflavonoids in Ophiopogon japonicus by HPLC-DAD-ESI-MSn[J].J Am Soc Mass Spectrom, 2005, 16: 234.
[20] Q J, Xu D R, Zhou Y F, et al.New features on the fragmentation patterns of homoisoflavonoids in Ophiopogon japonicus by high-performance liquid chromatography/diode-array detection/electrospray ionization with multi-stage tandem mass spectrometry[J]. Rapid Commun Mass Spectrom, 2010, 24: 2193.
[21] Lin Y N, Zhu D N, Qi J, et al.Characterization of homoisoflavonoids in different cultivation regions of Ophiopogon japonicus and related antioxidant activity[J].J Pharm Biomed Anal, 2010, 52: 757.
[22] Wang Y Y, Xu J Z, Qu H B, et al.Structure characterization and identification steroidal saponins from Ophiopogon japonicus Ker-Gawler (Liliaceae) by high-performance liquid chromatography with ion trap mass spectrometry[J].Phytochem Anal, 2011, 22: 166.
[23] Fang S P, Hao C Y, Sun W X, et al.Rapid analysis of steroidal saponin mixture using electrospray ionization mass spectrometry combined with sequential tandem mass spectrometry[J].Rapid Commun Mass Spectrom, 1998, 12: 589.
[24] Zhu J B, Guo X J, Fu S P, et al.Characterization of steroidal saponins in crude extracts from Dioscorea zingiberensis C.H.Wright by ultra-performance liquid chromatography/electrospray ionization quadrupole time-of-flight tandem mass spectrometry[J]. J Pharm Biomed Anal, 2010, 53: 462.
Rapid recognition and identification of chemical constituents in
Qinghuo Zhimai tablets by SPE-HPLC-ESI-MSn
ZHANG Jia-yu1,2, QIAO Yan-jiang1*, GAO Xiao-yan2, ZHANG Qian1, MA Qun1, LU Jian-qiu2*
(1.School of Chinese Pharmacy, Beijing University of Chinese Medicine, Beijing 100102, China;
2.Center of Scientific Experiment, Beijing University of Chinese Medicine, Beijing 100029, China)
[Abstract] Objective: To establish a method for analyzing solid phase extraction-high performance liquid chromatography-electrospray ionization tandem mass spectrometry (SPE-HPLC-ESI-MSn), in order to recognize and identify the main chemical constituents in Qinghuo Zhimai tablets.Method: The possible structures of the compounds were determined according to the structure information of compounds observed from molecular ion peaks and fragment ions in HPLC-ESI-MSn negative ion mode and by comparing with literature data or control samples.Result: Through the comparative analysis on Qinghuo Zhimai Tablets and components of its formula, 39 chemical constituents were identified, including 7 caffeoylquinic acids, 7 iridoids, 6 diterpenoid lactones, 5 homoisoflavonoids, 13 steroidal saponins and 1 flavone glycoside.Conclusion: This study provides a simple and rapid method for identifying chemical components in Qinghuo Zhimai tablets.
[Key words] HPLC-ESI-MSn; SPE; Qinghuo Zhimai tablets; identification of chemical constituents
doi:10.4268/cjcmm20130209
[责任编辑 曹阳阳]

