苏木对红花中羟基红花黄色素A的药代动力学影响
夏丽,陈向梅,彭莉蓉,王世祥,王晓雯,左燕,张鹏,刘勤社,郑晓晖


[摘要] 目的:研究苏木对红花中羟基红花黄色素A(HSYA)的药代动力学的影响。方法:RP-HPLC测定红花单煎液和红花-苏木配伍液灌胃后正常大鼠血浆中HSYA的血药浓度,DAS 2.0药动学软件计算药动学参数。结果:红花单独给药、红花-苏木配伍给药,HSYA在体内代谢动力学模型均为二室开放模型;配伍后,HSYA的分布半衰期t1/2α、吸收半衰期t1/2Ka 、表观分布容积VL/F显著减小,达峰时间tmax有所提前。结论:苏木可加快HSYA在体内的吸收和分布,加快HSYA在体内的代谢过程,减少HSYA在体内的蓄积。
[关键词] 红花;苏木;羟基红花黄色素A;药代动力学
红花、苏木为活血化瘀之品,功用类同,二药合用,相须配对,见诸多方剂,如《宁坤秘籍》之破灵丹,《证治宝鉴》之红花苏木汤,《何氏济生论》之红花活血汤等,多用治血滞不行,内有瘀血等。红花为菊科植物红花Carthamus tinctorius L. 的干燥花,具有活血通经,散瘀止痛之功。羟基红花黄色素A(HSYA)是其主要成分,药理研究表明其有抗凝血、缓解心肌缺血等作用,临床常用于防治脑缺血、心肌缺血、冠心病、脑血栓等疾病。苏木为豆科植物苏木Caesalpinia sappan L. 的干燥心材,具有活血祛瘀,消肿止痛之功。
红花中HSYA成分检测及药动学研究已有报道,但苏木对红花药动学的影响未见研究报道。本文以红花中HSYA为指标,研究两者配伍后苏木对红花药动学的影响,为其临床合理应用提供实验依据。
1 材料
1.1 仪器与设备 1100系列高效液相色谱仪(Agilent公司,美国):G1312A二元泵,G1316A柱温箱,G1315B二极管阵列检测器;VER-TEX26型快速混匀器(海门市其林贝尔仪器制造有限公司,中国);TGL-16G高速离心机(上海安亭科学仪器公司);Maxima超纯水机(美国基因公司);BP221S电子天平(Sartorius公司,德国)。
1.2 药品与试剂 HSYA对照品(中国食品药品检定研究院,批号111637-200905);红花、苏木药材(购于陕西省药材公司,由西北大学生命科学学院房敏峰副教授鉴定);肝素钠注射液(河北常山生化药业有限公司,批号100109);色谱纯甲醇(Fisher公司,美国);实验用水为超纯水;其他试剂均为分析纯。
1.3 动物 SPF级SD健康大鼠,购自西安交通大学实验动物中心,合格证号陕医动证字2006105,雌雄兼用,体重200~230 g。
2 方法
2.1 色谱条件 色谱柱Agilent TC-C 18(4.6 mm×250 mm,5 μm);柱温25 ℃;进样量20 μL;流动相0.3%甲酸溶液(A)-甲醇(B);梯度洗脱0~25 min,5%~35% B;25~30 min,35%~40% B;30~40 min,40%~60% B;检测波长0~30 min,280 nm;30~40 min, 403 nm。
2.2 药材提取 红花-苏木合煎液:分别称取红花、苏木粉碎药材各150.0 g,混匀,加10倍量水浸泡0.5 h后,加热回流提取2次,每次2 h,趁热用布氏漏斗过滤,合并提取液,低压浓缩至75 mL(生药量以红花计2.0 g·mL-1),4 ℃冷藏备用。
红花单煎液:称取红花粉碎药材150.0 g,处理方法同上。
2.3 对照品溶液的制备 精密称取HSYA 5.0 mg,溶解于5 mL棕色量瓶中,加甲醇至刻度,制得1.00 g·L-1的对照品溶液,4 ℃冷藏,备用。
2.4 血浆样品的制备 大鼠随机分成2组,即正常红花组、正常红花-苏木组,每组6只,禁食,自由饮水,12 h后分别灌胃红花水提液、红花-苏木水提液。每组均以20.0 g·kg-1红花生药量灌胃,于给药后0,5,10,20,30,45,60,90,150,210,270 min眼底静脉丛取血0.3 mL,置于肝素化离心管中,在8 000 r·min-1条件下离心10 min,取上层血浆置于离心管中,-20 ℃冷藏备用。前5个取血点尾静脉注射0.3 mL生理盐水,后边各取血点腹腔注射0.3 mL生理盐水以补充血容量。
2.5 血浆样品的处理 取2.4项下血浆0.2 mL,加入20%三氯乙酸水溶液20 μL沉淀蛋白,涡旋2 min,在12 000 r·min-1条件下离心10 min,取上清液,0.45 μm水系微孔滤膜过滤,进样分析。
3 结果
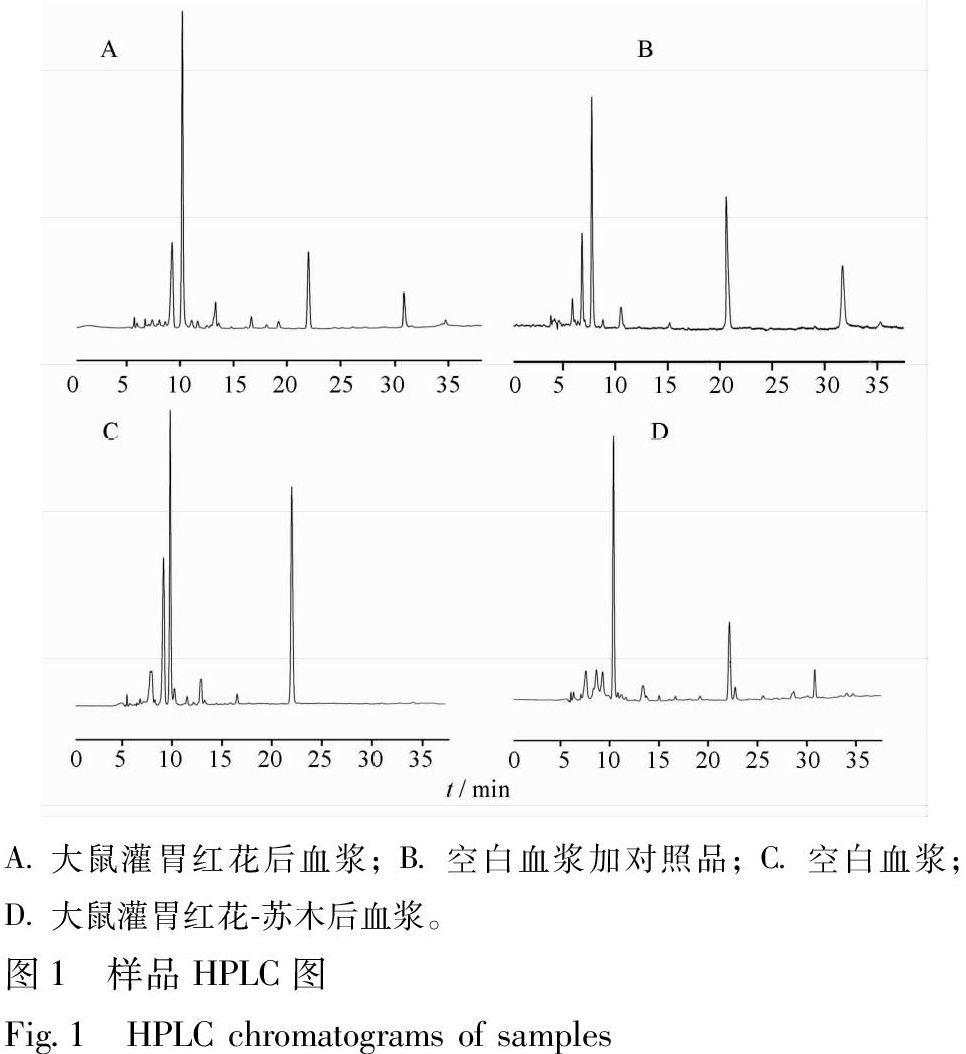
3.1 分析方法的专属性及检测限 分别取空白血浆供试品溶液和空白加标血浆供试品溶液及含药血浆供试品溶液各20.0 μL,在拟定条件下进样分析,色谱图见图1。结果显示空白血浆中内源性物质不干扰HSYA的检测,基线噪音小,说明该液相条件具有良好的方法专属性。HSYA检出限为0.1 mg·L-1(S/N=3),定量限为0.2 mg·L-1(S/N=10)。
3.2 线性关系 在200 μL空白血浆中加入以甲醇稀释的系列浓度的HSYA对照品溶液各20 μL,配制成HSYA质量浓度分别0.20,0.40,0.78,1.56,3.13,6.25 mg·L-1的系列空白血浆加标品供试品溶液,按2.5项下方法处理,在拟定液相条件下进样分析,分别以质量浓度(X,mg·L-1)为横坐标,以峰面积(Y)为纵坐标,进行回归分析,线性方程为Y=70.96X+0.69(r=0.999 8),HSYA在0.20~6.25 mg·L-1线性关系良好。
3.3 精密度和回收率 取空白血浆,分别加入适量的HSYA对照品溶液,得到低、中、高3个浓度空白血浆加对照品溶液,每个浓度6份;同时配制相同浓度的以水为基质的对照品溶液,按照2.5项下方法处理后进样测定,在拟定液相条件下进样20 μL
分析,同一样品在1 d内重复进样6次,6日内连续测定6次,求得日内精密度、日间精密度,以血浆中HSYA与水溶液中HSYA的含量之比计算提取回收率,测定结果见表1。
3.4 稳定性试验 冻融稳定性试验:取空白血浆,分别加入适量的HSYA对照品溶液,得到低、中、高3个浓度空白血浆加对照品溶液;置于-20 ℃冷冻,24 h后于室温下解冻,按照2.5项下样品制备方法处理。在拟定液相条件下,进样量为20 μL,测定峰面积,计算HSYA的浓度变化。并将剩余样品重新冷冻24 h。按上述步骤重复6次,记录实验结果,考察冻融周期对样品稳定性的影响。结果表明HSYA3个浓度的RSD分别为3.71%,1.86%,0.75%。
短期稳定性试验:取空白血浆,分别加入适量的HSYA对照品溶液,得到低、中、高3个浓度空白血浆加对照品溶液;室温下放置2.0,4.0,8.0,10.0,12.0,24.0 h,按2.5项下样品制备方法对血样进行处理。在拟定分析条件下,进样20 μL,测定峰面积,计算HSYA的浓度变化。记录实验结果,考察温度对样品稳定性的影响。结果表明HSYA 3个浓度的RSD分别为4.48%,1.86%,1.09%。
长期稳定性:以空白血浆配制HSYA高、中、低3个浓度的对照品血浆,置于-20 ℃冷冻,分别贮存1,2,4,6周后在室温条件下解冻,按2.5项下方法处理,进样测定峰面积,测得HSYA 3个浓度的RSD分别为5.9%,6.7%,5.0%,稳定性良好。
3.5 药代动力学研究 取2.4项下血浆样品在拟定的样品处理和色谱分析条件下,进样20 μL,记录峰面积,计算其中HSYA的含量。用DAS 2.0药代动力学软件分析,药-时曲线见图2;HSYA的药动学参数见表2。表2结果表明,红花配伍前后,HSYA的药动学过程均为二室开放模型。配伍苏木后,HSYA的吸收半衰期t1/2Ka 、分布半衰期t1/2α显著减小;达峰时间Tmax有所提前;消除半衰期t1/2β、清除率CL/F变化不显著,而表观分布容积VL/F显著减小。
4 讨论
4.1 液相色谱条件的选择 本研究对HSYA的色谱条件进行了优化。考察了等度和梯度洗脱这2种洗脱方式,同时考察了不同配比甲醇-0.3%甲酸溶液的流动相体系,最终确定甲醇-0.3%甲酸溶液为流动相,梯度洗脱。此条件下,药材中的HSYA以及血浆中的内源性物质和代谢产物实现良好的分离,基线平稳,目标色谱峰对称性良好,保留时间适宜。
选择HSYA的最大吸收波长 403 nm为检测波长,响应值同等最高,保证了HYSA的检测灵敏度。
4.2 血浆制备方法的选择 本研究对血浆样品的处理方法进行考察,比较了不同种类蛋白沉淀剂20%三氯乙酸水溶液、乙腈、甲醇、10%高氯酸溶液及沉淀剂用量对提取回收率的影响,结果表明乙腈、甲醇沉淀蛋白,HSYA受内源性物质的干扰较大,基线噪音大;10%高氯酸溶液沉淀蛋白,HSYA的回收率较低,不满足生物样品检测要求;而0.1倍量20%三氯乙酸溶液沉淀蛋白,内源性物质无干扰,基线平稳,HSYA的提取回收率均在85%以上。
4.3 药动学研究 配伍苏木后,HSYA的药动学过程均为二室开放模型;HSYA的吸收半衰期t1/2Ka 显著减小,达峰时间tmax有所提前,说明苏木可促进HSYA在大鼠体内的吸收;分布半衰期t1/2α显著缩短,提示配伍后HSYA在大鼠体内的分布加快;消除半衰期t1/2β 、清除率CL/F变化不显著,而表观分布容积VL/F显著减小,提示苏木可加快HSYA在大鼠体内的消除。以上结果表明苏木可加快HSYA在体内发挥作用,加快HSYA的体内代谢过程,减少HSYA在体内的蓄积。本研究为苏木-红花的临床合理应用提供了一定的实验依据。
[参考文献]
[1] 中国药典. 一部[S]. 2010: 141.
[2] 臧宝霞, 金鸣, 李金荣. 羟基红花黄色素A 抗凝作用的研究[J]. 中草药, 2007, 38(5): 741.
[3] 郑为超, 陈铎葆, 李兵, 等. 红花黄素对大鼠心肌缺血-再灌注模型的作用及机制研究[J]. 中国药理学通报, 2003, 19(9): 1032.
[4] 陈铎葆, 郑为超, 赵辉, 等. 红花总黄素对心肌缺血-再灌注损伤大鼠心功能的影响[J]. 中国中医药科技, 2003, 10(5): 290.
[5] 臧宝霞, 金鸣, 司南, 等. 羟基红花黄色素A 对血小板活化因子的拮抗作用[J ] . 药学学报, 2002, 37(9): 696 .
[6] Zhu H, Wang Z, Ma C, et al. Neuroprotective effects of hydroxysafflor yellow A: in vivo and in vitro studies[J]. Planta Med, 2003, 69(5): 429.
[7] 中国药典. 一部[S]. 2010: 153.
[8] Li F, Pu R, Zhao H Y, et al. Stability and degradation of hydroxysafflor yellow A and anhydrosafflor yellow B in the safflower injection studied by HPLC-DAD-ESI-MSn[J]. J Chin Pharm Sci, 2011, 20: 47.
[9] Tian Y, Yang Z F, Li Y, et al. Pharmacokinetic comparisons of hydroxysafflower yellow A in normal and blood stasis syndrome rats[J]. J Ethnopharmacol, 2010, 129(1): 1.
[10] 张海防, 郭健新, 黄罗生, 等. 羟基红花黄色素A 在大鼠体内的药代动力学[J]. 中国药科大学学报, 2006, 37(5): 456.
Pharmacokinetic effect of Sappan Lignum on hydroxysafflor
yellow A in Carthami Flos
XIA Li1, CHEN Xiang-mei1, PENG Li-rong2, WANG Shi-xiang1, WANG Xiao-wen3,
ZUO Yan3, ZHANG Peng3, LIU Qin-she1, 3, ZHENG Xiao-hui1, 4*
(1. College of Life Sciences, Northwest University, Xi′an 710069, China;
2. The Central Hospital of Xi′an, Xi′an 710086, China;
3. The People′s Hospital of Shanxi Province, Xi′an 710068, China;
4. Research Institute of Tsinghua University in Shenzhen, Shenzhen 518057, China)
[Abstract] Objective: To investigate the pharmacokinetic effect of Sappan Lignum on hydroxysafflor yellow A (HSYA) in Carthami Flos. Method: Concentration of HSYA in rat plasma was detected by RP-HPLC after rats were orally administered with extracts of Carthami Flos or Carthami Flos combined with Sappan Lignum. Pharmacokinetic parameters were calculated by DAS 2.0 pharmacokinetic software. Result: In vivo pharmacokinetic models of HSYA were two-compartment open models in both of the Carthami Flos group and the Carthami Flos combined with Sappan Lignum group. After compatibility, HSYA showed a significant lower in apparent volumes of distribution of t1/2Ka , t1/2αand V1/F, with slight advance in Tmax. Conclusion: Sappan Lignum can accelerate absorption, distribution and metabolic process of HSYA in vivo and reduce its accumulation in vivo.
[Key words] Carthami Flos; Sappan Lignum; HSYA; pharmacokinetics
doi:10.4268/cjcmm20130224
[责任编辑 陈玲]

