福尔马林致痛后小鼠不同脑区内FOS蛋白的表达
尹俊滨, 张 婷, 周科成, 王莉颖, 夏 亮, 胡 伟, 王 文*
福尔马林致痛后小鼠不同脑区内FOS蛋白的表达
尹俊滨1, 张 婷1, 周科成2, 王莉颖1, 夏 亮3, 胡 伟1, 王 文1*
(第四军医大学:1人体解剖与组织胚胎学教研室, 梁銶琚脑研究中心;3航空航天医学系心理学教研室, 西安 710032;2中国药科大学中药复方研究室, 南京 211198)
探讨小鼠足底注射福尔马林致痛后不同脑区内FOS蛋白的表达情况。将5%福尔马林溶液注射到小鼠后肢足底皮下,观察注射后60min内小鼠的自发痛反应;用免疫组织化学染色技术观察注射后2h同侧脊髓背角及不同脑区内FOS蛋白阳性神经元的分布情况和数量。行为学结果显示:注射福尔马林60min后小鼠的舔/咬足时间及缩足次数呈现典型的双相变化。免疫组织化学检测结果显示:注射福尔马林2h后同侧脊髓背角、下丘脑室旁核、丘脑中间背侧核、前扣带回皮质、岛叶皮质及杏仁核内FOS阳性神经元的数量明显增加,同时海马齿状回区FOS蛋白的表达也有一定程度的增加。在受到伤害性疼痛刺激时除了脊髓背角,感受疼痛、应激及做出防御反应的相应脑区也会被活化,表达FOS蛋白。
c-fos; FOS蛋白; 福尔马林痛; 免疫组织化学染色; 脑内核团
C-fos是细胞基因组的一种原癌基因,在神经元兴奋后可以迅速并且短暂地表达FOS蛋白,因此也被称为即刻早期基因(immediate early genes,IEGs)[1,2]。FOS蛋白被认作是细胞信号传导途径中的第三信使,可以促进许多与疼痛及镇痛相关基因的表达[3]。FOS蛋白在神经元受到多种刺激(尤其是伤害性刺激)后会迅速地表达,因此,被广泛地认为是一种神经元功能活化的标志[4]。
福尔马林致痛模型是将5%福尔马林注射到动物足底皮下,观察注射后1h内的自发痛反应,是一种常用的炎性痛模型。既往已有大量的文献报道,传递伤害性疼痛刺激的初级中枢脊髓背角在足底注射福尔马林2h后会有大量的FOS蛋白表达[5-7]。同时,大脑作为高级中枢,在未成年大鼠足底注射福尔马林以及成年大鼠在给予足底电刺激后,其脑内与感受疼痛刺激直接相关的核团也会有大量FOS蛋白的表达[8,9]。但疼痛所带来的不仅是一种伤害性的刺激,还会伴随着机体的应激和发生情绪的改变(如恐惧),同时机体也会对刺激做出相应的防御性反应等[8,10]。在疼痛刺激后脑内与这些应激、情绪、学习、记忆及产生防御反应的核团是否也会活化,并表达FOS蛋白呢?足底注射福尔马林后成年小鼠脑内核团的活化情况是怎样的?这些都需要去验证和筛查。
老年人由于器官的退行性改变、损伤及肿瘤等原因而常常伴随着疼痛的发生。因老年人的耐受性较强,往往能够忍受疼痛而忽视治疗,长时间的疼痛会使人产生情绪及性格的改变,如出现睡眠紊乱、食欲缺乏,导致焦虑、抑郁、精神崩溃,甚至人格扭曲等,严重影响患者的心理、社会功能,致使不少患者因无法长期忍受而选择自杀。故通过本研究希望发现疼痛导致这些严重后果的解剖基础,为今后临床探寻更好的治疗方法提供参考。
1 材料与方法
1.1 实验动物
雄性C57BL/6小鼠(购自第四军医大学实验动物中心),8~10周龄,体质量18~22g,饲养室温度恒定22℃±2℃并保证12h的光照,自由摄取食物和水。所有实验在第四军医大学动物伦理委员会批准下进行。
1.2 福尔马林痛模型
用微量注射器(Hamilton. NV,USA)30G的针头,在小鼠右侧后足趾侧注射生理盐水(生理盐水组)或5%福尔马林溶液(溶于生理盐水)25µl(5%福尔马林组)。注射后立即将小鼠置于透明的玻璃罩(25cm×25cm×40cm)中,通过视频捕捉系统记录注射福尔马林溶液后60min内小鼠的自发痛行为。经过培训的实验者通过计数表和秒表分别统计小鼠回缩注射足的次数和舔/跤注射足的时间,用来评价小鼠疼痛的程度。
1.3 取材
福尔马林溶液注射2h后,腹腔注射过量的戊巴比妥钠(3%,0.1ml)将小鼠深麻醉后迅速开胸,先用50ml 0.9%的生理盐水冲去体内残血,然后以含4%多聚甲醛的0.1mol/L PB(pH=7.3)100ml灌注固定约1h。将脊髓腰5节段及大脑取出放于相同的固定液中后固定3h,随后将组织置于30%的蔗糖溶液中4℃脱水。待组织沉底后取出,用恒冷箱切片机(Kryostat 1720;Leitz,Mannheim,Germany)将脊髓和大脑横切,切片厚度为25µm,分别连续切片收集于3个孔中,每个孔中包含一套完整的切片。
1.4 免疫组织化学染色
每只小鼠取一套片子采用ABC法进行FOS染色,具体步骤:(1)用0.01mol/L PBS溶液漂洗3遍,每遍10min;(2)用含2%山羊血清和0.3%Triton X-100的0.01mol/L PBS溶液在常温下封闭1h;(3)一抗Mouse-A-FOS(1∶500;Abcam,UK)加入含5%驴血清、0.3%TritonX-100、0.05%叠氮钠和0.25%角叉菜胶的0.01mol/L PBS溶液,4℃孵育过夜;(4)二抗Bio-Goat-A-Mouse IgG (1∶200;Vector,Burlingame,CA,USA)加入含5%驴血清、0.3%TritonX-100、0.05%叠氮钠和0.25%角叉菜胶的0.01mol/LPBS溶液,常温下孵育4h;(5)Avidin-Biotin-peroxidase complex(ABC)Elite Kit (1∶100;Vector)加入0.01mol/L PBS溶液中,常温下孵育1h;(6)最后将切片放入含0.04%二氨基联苯胺(DAB)和0.003%双氧水的0.05mol/L Tris-HCL中反应至FOS显色。上述的每一步间都需用0.01mol/L PBS溶液漂洗3遍,每遍10min。
阴性对照:从足底注射福尔马林后的小鼠切片中取一套片子,按照上述步骤分别漂洗、封闭和加入抗体,但不加入一抗,最后采用ABC法进行显色,观察。
1.5 FOS蛋白表达阳性的神经元计数
在Olympus光学显微镜下观察小鼠脊髓背角及脑内核团FOS蛋白的表达,并拍摄。由另外一名实验人员计数各组小鼠脊髓背角和各个核团内FOS蛋白阳性神经元的数量,选取有能代表该核团的切片进行计数,每只小鼠至少计数5张切片,然后取平均值作为此只小鼠FOS蛋白阳性神经元的平均数量。
1.6 统计学处理
2 结 果
2.1 福尔马林痛小鼠的自发痛行为及脊髓背角内FOS蛋白的表达
C57BL/6小鼠右侧后足足底皮下注射5%福尔马林溶液后可以产生双相自发痛反应,包括自发的舔/咬注射足底和回缩注射足。无论是每5min内舔/咬足时间还是缩足次数在前5min都达到高峰,后5min减弱,这就是第一个短暂的时相,持续10min;紧接着第二个时相从注射后10min开始,持续到约60min(图1)。而足底注射生理盐水的小鼠除注射引起的短暂疼痛外,无自发性痛行为的表现。
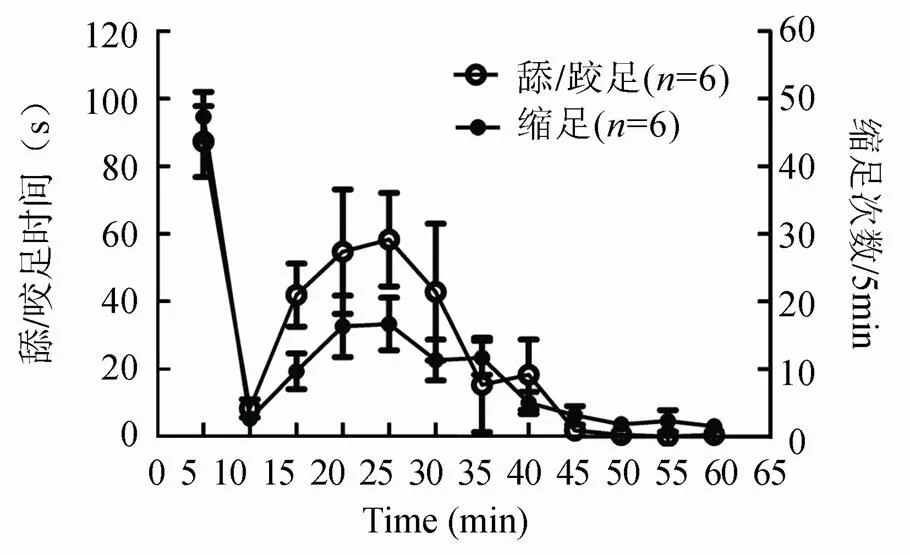
图1 足底注射福尔马林后1h内的自发痛行为
Figure 1 Spontaneous pain behavior within 1 hour of formalin injection
C57BL/6小鼠足底注射福尔马林2h后脊髓背角内有大量FOS蛋白的表达。伤害性疼痛刺激的初级传入中枢是脊髓的背角,足底注射福尔马林后可以活化脊髓背角(spinal dorsal horn,SDH)内的疼痛感受性神经元,激活其基因组内的c-fos基因表达FOS蛋白。FOS蛋白经DAB显色后为棕黄色的亮点,主要表达于细胞核内。FOS蛋白阳性的神经元不仅分布于脊髓背角的浅层,同时也存在于深层。而足底注射生理盐水组小鼠脊髓背角内表达FOS蛋白阳性的神经元的数量相对较少(<0.01;图2)
2.2 足底注射福尔马林2h后脑内核团FOS蛋白的分布
高倍镜下FOS蛋白阳性的神经元中,棕黄色着色即为神经元细胞核,胞质未见着色。足底注射福尔马林后在脑内许多核团可以看到明显增多的FOS阳性神经元。在丘脑中间背侧核(medial dorsal thalamic nucleus,MDTN)、下丘脑的室旁核(paraventricular nucleus,PVN)和背侧区、岛叶(insular cortex,IC)、前扣带回皮质(anterior cingulate cortex,ACC)及杏仁核(amygdala)海马的CA1区和齿状回(dentate gyrus,DG)都可见到FOS蛋白的表达增多(表1)。
足底注射生理盐水后在MDTN及下丘脑的PVN处可见到少量的FOS阳性神经元,胞核为棕黄色,胞质阴性,染色浅,散在分布。注射福尔马林溶液2h后FOS蛋白表达明显增多(<0.01),FOS阳性神经元密集分布于整个核团(图3)。
足底注射生理盐水后在ACC、IC和杏仁核处均可见到少量的FOS阳性神经元散在分布,注射福尔马林溶液2h后FOS蛋白表达明显增多(<0.01),ACC和杏仁核中FOS阳性神经元密集分布于整个核团,IC内FOS阳性神经元分布密度也较高(图4)。
足底注射生理盐水在海马内CA1区和DG区偶见FOS阳性神经元散在分布,染色较浅,注射福尔马林溶液2h后CA1区内FOS阳性神经元仍散在分布,与生理盐水组差异无统计学意义(>0.05),而DG区内的FOS阳性神经元有一定程度的增加(<0.05),仍是散在分布(图5)。
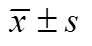
表1 脊髓背角及各脑区内FOS阳性神经元的数量
SDH: 脊髓背角; PVN: 下丘脑的室旁核; MDTN: 丘脑中间背侧核; ACC: 前扣带回皮质; Amygdala: 杏仁核; IC: 岛叶; DG: 齿状回。与生理盐水组比较,P<0.05,P<0.01
3 讨 论
本研究通过免疫组织化学的方法探讨了在C57BL/6小鼠足底注射5%福尔马林溶液后,神经元活化的标志物FOS蛋白在SDH及大脑核团内的表达情况。结果显示,足底注射福尔马林后可以引起明显的双相自发痛行为,在注射2h后SDH内FOS阳性神经元明显增加,在丘脑、下丘脑、杏仁核、ACC及IC都有大量FOS蛋白的表达,而海马CA1区和DG区的FOS阳性神经元增加不明显。
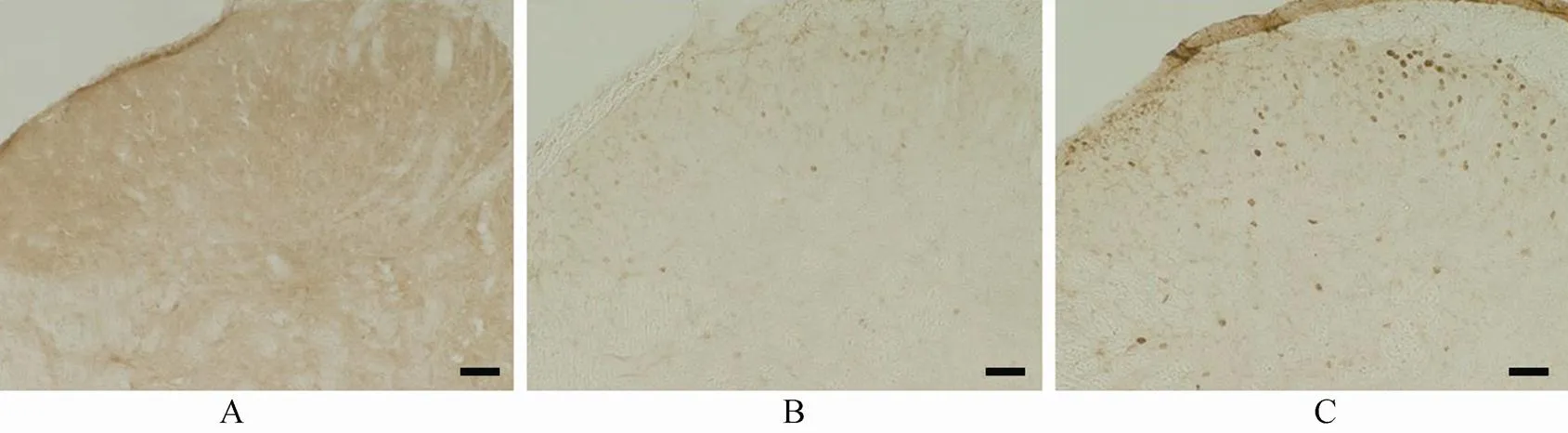
图2 足底注射福尔马林2h后同侧脊髓背角内FOS蛋白的表达
Figure 2 Expression of FOS protein in ipsilateral SDH after 2 hours of formalin injection (scale bar=50μm)
A: 阴性对照组; B: 生理盐水组; C: 5%福尔马林组
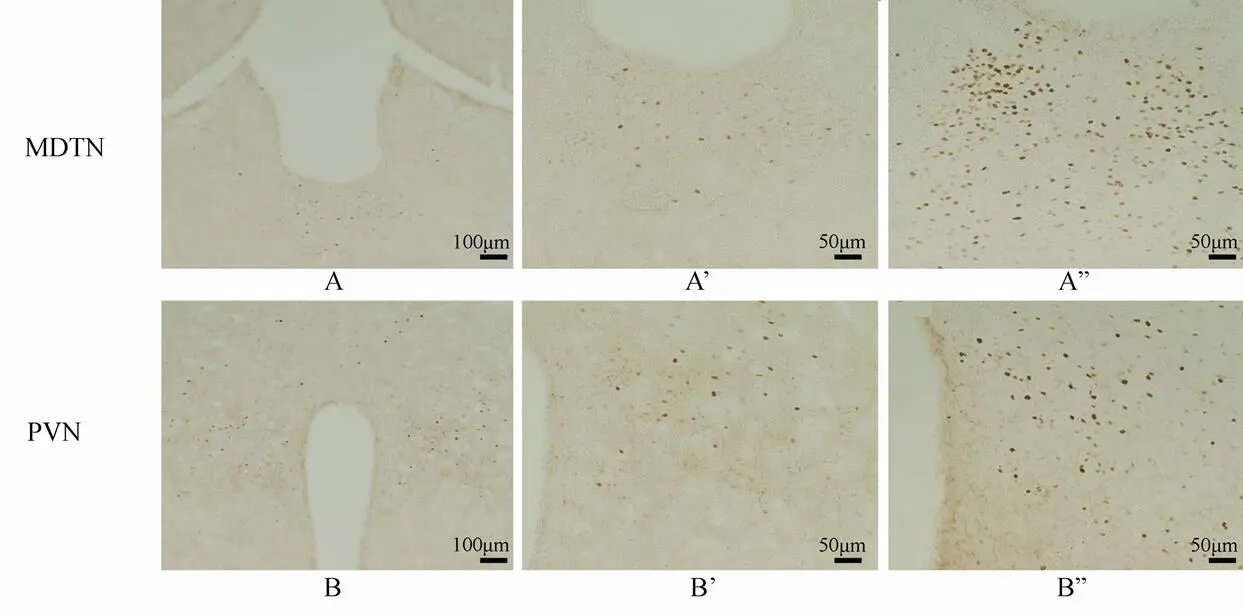
图3 足底注射福尔马林2h后丘脑和下丘脑核团内FOS蛋白的表达
Figure 3 Expression of FOS protein in nucleus of thalamus and hypothalamus after 2 hours of formalin injection
A, B, A', B': 生理盐水组; A'', B'': 5%福尔马林组。MDTN: 丘脑中间背侧核, PVN: 下丘脑室旁核
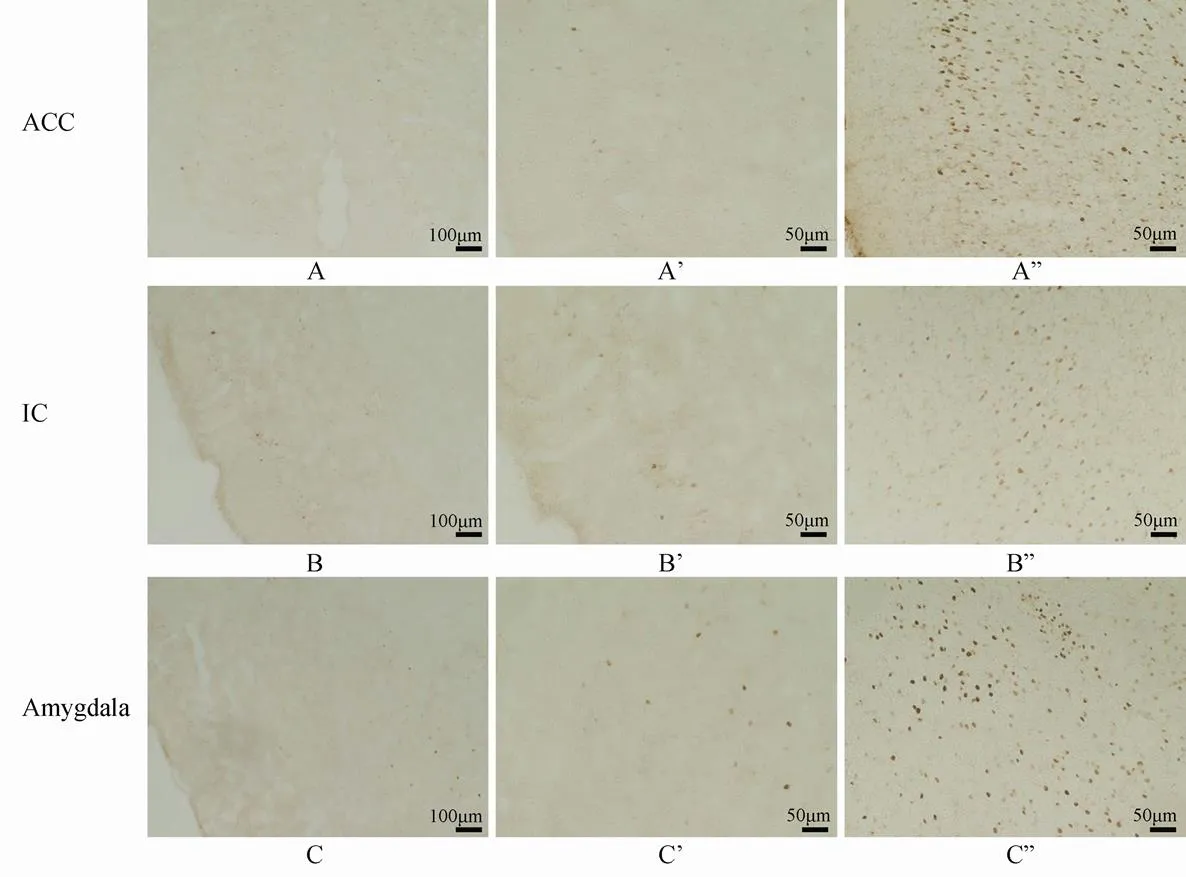
图4 足底注射福尔马林2h后前扣带回和岛叶皮质及杏仁核内FOS蛋白的表达
Figure 4 Expression of FOS protein in ACC and Amygdala after 2 hours of formalin injection
A, B, C, A’, B’, C’; 生理盐水组; A”, B”, C”: 5%福尔马林组。ACC: 前扣带回皮质; IC: 岛叶皮质; Amygdala: 杏仁核
福尔马林痛模型是常用的急性炎性痛模型。足底注射福尔马林引起的双相自发痛行为中,第一相被认为是由直接的机械性组织损伤引起的急性痛行为,而第二相则是由注射入的福尔马林引起的炎症反应所导致的持续性痛行为。而第二相的行为表现与炎性疼痛刺激的强度呈正相关。
机体细胞在受到多种伤害性因素(如物理刺激、化学刺激等)的刺激后可诱导胞核内原癌基因c-fos表达FOS蛋白。在正常情况下,细胞内c-fos很少表达,疼痛刺激可以激活SDH内与感受痛觉相关的神经元的c-fos并表达FOS蛋白。当细胞受到刺激后,细胞核内基因组转录的c-fos mRNA转移到胞质,由核糖体翻译为FOS蛋白,FOS蛋白与Jun蛋白合成二聚体,在AP-1的介导下易位到细胞核内调控靶基因的转录。在一定程度上,FOS阳性神经元的数量与所受的刺激强度成正比。c-fos基因是一种“即刻表达基因”,FOS蛋白在受到刺激1h后就可有明显的反应。已有文献报道,小鼠足底皮下注射福尔马林后2h同侧SDH FOS蛋白表达达到最高峰[11]。因此,笔者选择在足底注射福尔马林2h后来观察SDH及大脑各区域内FOS蛋白表达的数量。Roussy等[12]报道足底注射福尔马林后在SDH的浅层和深层都有FOS蛋白的表达,包括Ⅰ~Ⅵ层的神经元和Ⅹ层的神经元。但主要还是集中在SDH的Ⅰ层和Ⅱ层的外侧。

图5 足底注射福尔马林2h后海马内FOS蛋白的表达
Figure 5 Expression of FOS protein in hippocamus after 2 hours of formalin injection
A, B, A’, B’: 生理盐水组; A”, B”: 5%福尔马林组
受到伤害性刺激后,脊髓上位中枢特别是脑内神经核团的活化也有许多的研究。在大鼠内脏痛模型中,无论是因弥漫性腹膜炎,亦或是较局限的膀胱炎症所引发的内脏痛,在其延髓腹外侧区、臂旁核、中缝背核、中脑导水管周围灰质、杏仁核、皮层、丘脑和下丘脑的许多核团都可以发现FOS阳性的神经元[13]。内脏痛与躯体痛在脊髓中的初级中枢虽然不同,但是在脑内应该有许多相同的高位中枢可以对疼痛刺激做出反应。
PVN和MDTN核被认为与面对危险或刺激时自主反应的形成相关[8]。足底注射福尔马林后,活化的不仅是与感受疼痛相关的大脑区域。小鼠在受到应激后也会做出相应的本能反应,因此与这种防御反应相关的PVN和MDTN中也有大量的FOS蛋白表达。
大量的研究证明ACC与疼痛、记忆及情绪有密切的关系[14]。PET检查显示,伤害性刺激和与疼痛相关的不愉快的事件都可引起大脑内ACC、杏仁核及IC的活化[15,16]。临床上,手术损毁ACC及其附近的皮层可以显著地降低患者因疼痛引起的烦躁不安[17]。同时,大量的神经影像学方法研究了在抑郁和疼痛时不同脑区的活化和改变,发现疼痛时IC和ACC都有明显的活化,IC、ACC、感觉皮质和前额叶皮质被称为“the pain matrix”[18,19]。一项荟萃分析显示IC参与了抑郁症时对情绪刺激的反应[20]。也有实验证明杏仁核参与条件性恐惧及疼痛的过程[21,22]。因此在足底注射福尔马林后,产生的疼痛刺激以及恐惧情绪等都可活化ACC、IC、杏仁核内的神经元使其表达FOS蛋白。
海马的功能主要与学习记忆的形成及情绪的形成相关。足底注射福尔马林作为一种急性的疼痛刺激,引起的海马神经元活化相对于其他核团较少。Ceccarelli等[23]曾经比较了大鼠足底注射福尔马林2h后CA1区和DG区在雌性和雄性间的区别。注射福尔马林2h后,在CA1区雌性大鼠的FOS阳性神经元的数量少于对照组而雄性与对照组比较差异无统计学意义;同样,在DG区雌性大鼠与对照组比较,FOS阳性神经元的数量无明显差异,而雄性大鼠FOS蛋白的表达要多于对照组,与本实验中所观察到的基本相符。但是持续的慢性疼痛刺激是否会大量地活化海马内神经元,还有待后续的慢性疼痛实验来确认。
疼痛刺激不仅活化了脊髓和脑内与感受痛觉相关的核团,而且也活化了与应激、情绪、学习、记忆及产生防御反应相关的PVN、MDTN、ACC、IC、杏仁核和海马的DG区。本研究为疼痛引起情绪、性格改变,影响学习记忆的机制研究提供了形态学的证据。为今后在临床工作中对老年人特别是有多器官疾病耐受疼痛的老年人及时治疗疼痛,解除疼痛提供了强有力的理论依据。
[1] Dragunow M, Faull R. The use of c-fos as a metabolic marker in neuronal pathway tracing[J]. J Neurosci Methods, 1989, 29(3): 261-265.
[2] Sagar SM, Sharp FR, Curran T. Expression of c-fos protein in brain: metabolic mapping at the cellular level[J]. Science, 1988, 240(4857): 1328-1331.
[3] Coggeshall RE. Fos, nociception and the dorsal horn[J]. Prog Neurobiol, 2005, 77(5): 299-352.
[4] Hunt SP, Pini A, Evan G. Induction of c-fos-like protein in spinal cord neurons following sensory stimulation[J]. Nature, 1987, 328(6131): 632-634.
[5] Zhao H, Sugawara T, Miura S,. Intrathecal landiolol inhibits nociception and spinal c-Fos expression in the mouse formalin test[J]. Can J Anaesth, 2007, 54(3): 201-207.
[6] Liu CR, Duan QZ, Wang W,. Effects of intrathecal isoflurane administration on nociception and Fos expression in the rat spinal cord[J]. Eur J Anaesthesiol, 2011, 28(2): 112-119.
[7] Bai L, Wang W, Dong YL,. Attenuation of mouse somatic and emotional inflammatory pain by hydralazine through scavenging acrolein and inhibiting neuronal activation[J]. Pain Physician, 2012, 15(4): 311-326.
[8] Barr GA. Formalin-induced c-fos expression in the brain of infant rats[J]. J Pain, 2011, 12(2): 263-271.
[9] Lehner M, Taracha E, Skorzewska A,. Sensitivity to pain and c-Fos expression in brain structures in rats[J]. Neurosci Lett, 2004, 370(1): 74-79.
[10] Twillman RK. Mental disorders in chronic pain patients[J]. J Pain Palliat Care Pharmacother, 2007, 21(4): 13-19.
[11] Sun X, Yokoyama M, Mizobuchi S,. The effects of pretreatment with lidocaine or bupivacaine on the spatial and temporal expression of c-Fos protein in the spinal cord caused by plantar incision in the rat[J]. Anesth Analg, 2004, 98(4): 1093-1098.
[12] Roussy G, Dansereau MA, Dore-Savard L,. Spinal NTS1 receptors regulate nociceptive signaling in a rat formalin tonic pain model[J]. J Neurochem, 2008, 105(4): 1100-1114.
[13] Rodella L, Rezzani R, Gioia M,. Expression of Fos immunoreactivity in the rat supraspinal regions following noxious visceral stimulation[J]. Brain Res Bull, 1998, 47(4): 357-366.
[14] Gao YJ, Ren WH, Zhang YQ,. Contributions of the anterior cingulate cortex and amygdala to pain-and fear-conditioned place avoidance in rats[J]. Pain, 2004, 110(1-2): 343-353.
[15] Bornhovd K, Quante M, Glauche V,. Painful stimuli evoke different stimulus-response functions in the amygdala, prefrontal, insula and somatosensory cortex: a single-trial fMRI study[J]. Brain, 2002, 125(Pt 6): 1326-1336.
[16] Tolle TR, Kaufmann T, Siessmeier T,. Region-specific encoding of sensory and affective components of pain in the human brain: a positron emission tomography correlation analysis[J]. Ann Neurol, 1999, 45(1): 40-47.
[17] Foltz EL, White LE Jr. Pain “relief” by frontal cingulumotomy[J]. J Neurosurg, 1962, 19(1): 89-100.
[18] Mutschler I, Ball T, Wankerl J,. Pain and emotion in the insular cortex: evidence for functional reorganization in major depression[J]. Neurosci Lett, 2012, 520(2): 204-209.
[19] Tracey I. Nociceptive processing in the human brain[J]. Curr Opin Neurobiol, 2005, 15(4): 478-487.
[20] Delaveau P, Jabourian M, Lemogne C,. Brain effects of antidepressants in major depression: a meta-analysis of emotional processing studies[J]. J Affect Disord, 2011, 130(1-2): 66-74.
[21] Maren S, Fanselow MS. The amygdala and fear conditioning: has the nut been cracked[J]. Neuron, 1996, 16(2): 237-240.
[22] Buritova J, Besson JM, Bernard JF. Involvement of the spinoparabrachial pathway in inflammatory nociceptive processes: a c-Fos protein study in the awake rat[J]. J Comp Neurol, 1998, 397(1): 10-28.
[23] Ceccarelli I, Scaramuzzino A, Aloisi AM. Effects of formalin pain on hippocampal c-Fos expression in male and female rats[J]. Pharmacol Biochem Behav, 1999, 64(4): 797-802.
(编辑: 王雪萍)
FOS expression in supraspinal regions after formalin-induced pain in mice
YIN Jun-Bin1, ZHANG Ting1, ZHOU Ke-Cheng2, WANG Li-Ying1, XIA Liang3, Hu Wei1, WANG Wen1*
(1Department of Human Anatomy, Histology and Embryology, K.K. Leung Brain Research Centre, Fourth Military Medical University, Xi’an 710032, China;2Department of Complex Prescription of TCM, China Pharmaceutical University, Nanjing 211198, China;3Department of Psychology, Institute of Aerospace Medicine, Fourth Military Medical University, Xi’an 710032, China)
To investigate the expression profiles of FOS protein in the mice brain subregions induced by subcutaneous formalin injection to one hindpaw.After adult mice received an injection of 5% formalin in the hindpaw, their spontaneous pain behaviors were recorded within 60min. The expression, distribution and number of FOS-positive neurons in the ipsilateral dorsal horn and supraspinal regions were detected by immunohistochemical assay at two hours after formalin injection.These mice showed their biting/licking time and flinches in a typical two-phase manner within 60min. The immunohistochemical staining results showed that FOS-positive neurons were significantly increased in the ipsilateral spinal cord, paraventricular nucleus, medial dorsal thalamic nucleus, anterior cingulate cortex, insular cortex and amygdala. Meanwhile, the expression of FOS protein in the dentate gyrus of hippocampus was also slightly increased.Not only spinal dorsal horn but also subregions sensitive to pain and stress, will be activated functionally to mediate defensive response when mice are exposed to nociceptive stimuli.
c-fos; FOS protein; formalin-induced pain; immunohistochemical staining; nucleus of brain.
(31070976).
R741.02
A
10.3724/SP.J.1264.2013.00112
2012-12-19;
2013-03-20
国家自然科学基金(31070976)
张婷, 为共同第一作者
王 文, Tel: 029-84774504, E-mail: wangwen@fmmu.edu.cn

