大孔吸附树脂对金银花叶茎藤总黄酮的吸附性能
陈莉华,肖 斌,贺诚志,朱 健
吉首大学化学化工学院,吉首416000
金银花为忍冬科多年生半常绿缠绕植物,又名忍冬花、银花、双花等[1],在医院临床和中成药生产中应用广泛。研究表明,金银花叶茎藤和金银花在临床上均有清热解毒之功效,尤其是叶的有效成分和药理作用不亚于花[2-4],但药源远比金银花丰富,且采集容易,价格便宜。金银花叶茎藤中除含有绿原酸外,还含有黄酮类化合物[3-6],研究金银花叶茎藤中的黄酮的提取及纯化工艺,可为金银花药材资源的充分利用提供一定的参考和依据。
大孔树脂吸附分离技术可显著提高有效成分的相对含量,具有价廉、吸附容量大,周期短、可重复使用等优点,在天然产物有效成分的精制纯化中已被广泛应用[2,3,5-7]。本文采用超声波法从金银花叶茎藤中提取黄酮类化合物,用最常见的D101大孔吸附树脂纯化提取物,以黄酮的单位吸附量、吸附率和解吸附率为评价指标,对金银花叶茎藤总黄酮在树脂上的动态吸附和解吸工艺条件进行了优化,并深入探讨了吸附机理,为深入利用金银花资源提供实验依据。
1 实验部分
1.1 仪器和材料
UV-2450紫外可见分光光度计(日本岛津);KQ-250E超声波发生器(昆山市超声仪器有限公司);R-201B-II旋转蒸发仪(郑州长城科工贸有限公司);pHS-25酸度计(上海日岛科学仪器有限公司);DZF-6020真空干燥箱(上海精宏实验设备有限公司);HH-S恒温水浴锅(郑州长城科工贸有限公司);层析柱(直径∶长度1∶8);粉粹机。芦丁标准品(比利时进口,北京化学试剂有限公司);无水乙醇、石油醚、D-101 大孔树脂、NaNO2、Al(NO3)3、NaOH、HCl(以上试剂均为分析纯)。
1.2 实验方法
1.2.1 D-101大孔吸附树脂的预处理
称取80 g D-101大孔吸附树脂加入3 BV无水乙醇充分浸泡24 h,蒸馏水洗至无醇味;然后加入2 BV 5%稀盐酸浸泡12 h,蒸馏水冲洗树脂至流出液pH值为中性;最后加入2 BV 5%氢氧化钠溶液浸泡12 h,蒸馏水冲洗树脂至流出液pH值为中性。
1.2.2 金银花叶茎藤总黄酮的提取
称取一定量的金银花叶茎藤碎屑,加入60%的乙醇,置于超声波发生器中,在温度50℃下超声30 min,重复2次,合并提取液,减压旋蒸回收乙醇,浓缩液用3∶1的石油醚脱色至石油醚层基本无色,将下层浓缩液用1∶3(浓缩液体积∶乙醇体积)80%的乙醇浸泡并静置16 h,最后将上层清液减压回收乙醇后得到黄酮提取液。
1.2.3 样品中黄酮含量的测定
以芦丁为黄酮对照品按NaNO2-Al(NO3)3-NaOH法绘制标准曲线并用于测定粗提液和纯化液中黄酮含量。用紫外可见分光光度计测波长在510 nm处的吸光值A,以浓度(c)对吸光值A进行线性回归,得回归方程为:c=0.0939A(R2=0.9998)。浓度在0~0.05 mg/mL之间具有良好的线性关系。取黄酮样品溶液(粗提液或纯化液)1.0 mL,置于25 mL容量瓶中,按照绘制芦丁标准曲线的方法测定吸光值,计算黄酮提取率及黄酮纯度。
1.2.4 各种试验条件对吸附效果的影响
精确称取经预处理好的D-101大孔吸附树脂2.0 g,装入具塞锥形瓶中,依次改变实验条件,考察样品液浓度、料液比、样品液pH值、不同静置时间等因素对吸附效果的影响。
1.2.5 D-101大孔树脂静态吸附动力学实验
称取预处理好的D-101大孔吸附树脂2.0 g,加入50 mL黄酮浓度为0.538 mg/mL的样品溶液,常温振荡吸附24 h,前120 min每隔15 min取样,120 min后,每隔60 min取样测一次吸光度。计算吸附平衡后溶液中总黄酮的浓度[8]。
1.2.6 吸附等温线及吸附热力学
分别在温度 30、40、50、60、70 ℃ 下用 D-101 大孔树脂吸附至饱和,测定吸附平衡时黄酮的浓度,计算其单位吸附量及平衡浓度,得到不同温度下的吸附等温线[6,9]。
1.2.7 不同体积分数的乙醇洗脱液对大孔树脂解吸率的影响
精密称取预处理好的D-101大孔树脂2.0 g,湿法装柱,加入一定量的样品溶液,吸附完全后,分别加入35、45、55、75、85 和 95% 乙醇溶液 30 mL 进行洗脱,控制流速为2 mL/min,收集洗脱液并测定洗脱液中黄酮的含量,计算解吸率,考察乙醇洗脱液对大孔树脂解吸附率的影响。
1.2.8 动态洗脱曲线
在动态吸附实验确定的工艺条件下,使金银花黄酮水溶液通过D-101大孔树脂柱,直至吸附饱和,然后用75%的乙醇溶液以2 mL/min的流速进行动态洗脱,洗脱液分段收集,每5 mL收集1份,并测定每份溶液中总黄酮的浓度,绘制洗脱曲线。
2 结果与讨论
2.1 影响吸附效果的各种因素
2.2.1 样品液浓度对吸附效果的影响
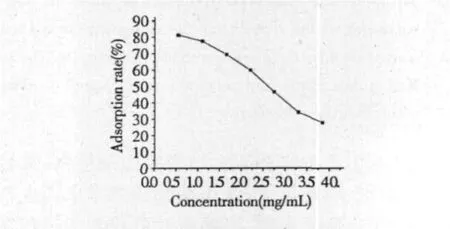
图1 样品液浓度对树脂吸附率的影响Fig.1 Effect of sample solution concentration on adsorption rate
由图1可知样品液浓度是大孔树脂吸附过程中的一个重要影响因素。在实验浓度范围内树脂对黄酮的吸附率随着样品液浓度的增加而减小,D-101大孔树脂对金银花叶茎藤黄酮吸附的最佳浓度为0.5380 mg/mL,引起此现象可能原因为:随着样品液浓度的提高,总黄酮分子在树脂内部扩散能力可能降低,并且浓度增加后,与总黄酮竞争大孔树脂吸附位点的杂质量也会增加,因而树脂的目标吸附率反而会下降。
2.1.2 料液比对吸附效果的影响
用料液比代表所用大孔树脂质量(g)吸附总黄酮溶液体积(mL),实验结果表明,当料液比为1∶5时大孔树脂吸附率为79.06%,当料液比为1∶2时,吸附率维持不变,但浪费树脂;当树脂用量不变而增大黄酮溶液体积时,吸附率几乎成线性下降,表明树脂用量太少,吸附无法达到饱和。所以1∶5的料液比为最佳选择。
2.1.3 样品液pH值对吸附效果的影响
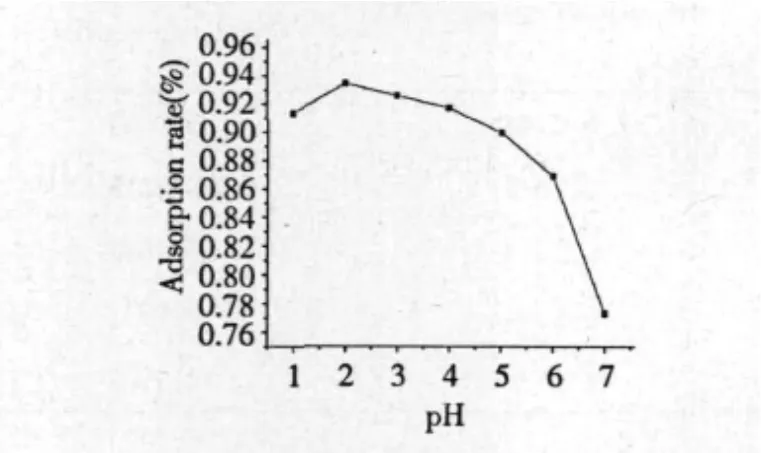
图2 pH对吸附效果的影响Fig.2 Effect of pH on adsorption rate
从图2可以看出,pH值较小时,大孔树脂对黄酮的吸附率较低,当pH为2时,树脂的吸附率达到最大值,随着pH值的升高,大孔树脂对黄酮的吸附率逐渐降低,选择最佳pH值为2。
2.1.4 静置时间对吸附率的影响
实验结果表明随着静置时间的增大样品吸附率升高,静置时间到80 min时的吸附率达到最大,为97.4%,静置时间继续增加,吸附率反而减小。
2.2 吸附动力学
2.2.1D-101大孔树脂的静态吸附动力学特性
吸附过程的动力学主要研究吸附过程的速率,吸附速率控制固-液界面上吸附质的滞留时间。按照实验方法得到吸附量随时间变化的动力学曲线,结果见图3。

图3 树脂静态吸附动力学曲线Fig.3 Static adsorption curve
如图3可知,D-101大孔树脂对金银花叶茎藤中总黄酮的吸附为快速平衡型,开始单位吸附量变化较大,100 min以后单位吸附量随时间增大缓慢,210min以后吸附量基本不再变化,表明在实验条件下吸附达到了平衡。平衡时吸附量为8.06 mg/g。
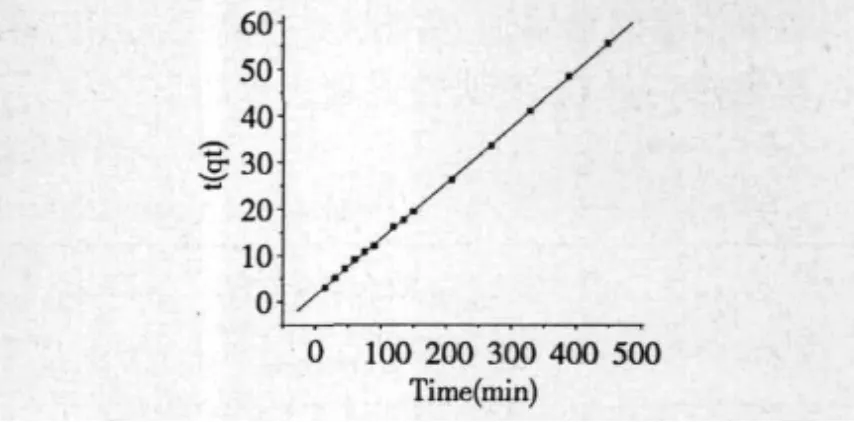
图4 准二级吸附动力曲线Fig.4 Pseudo-second adsorption kinetic curve
2.2.2 吸附速率常数
将图4中实验数据用Pseudo-second-order模型进行处理[11],其线性方程表示如下:式中:K为表观吸附速率常数,q和q分别为反te应时间t和平衡时树脂的吸附量,以对t做图得图3,求得直线方程及对应的相关系数为为:y=0.1198x+1.4926,r=0.9999,结果表明 D-101 大孔树脂对金银花叶茎藤浸出液中黄酮的吸附动力学可用Pseudo-second-order模型描述,由拟合线性方程式可得表观吸附速率常数K25℃=1.034×10-2g/mg·min。
2.3 吸附热力学
2.3.1 吸附等温线
为了研究吸附剂与被吸附物质之间的相互作用以及各类参数对吸附状态的影响,本文采用最常见的 Langmuir 等温吸附方程[9,10]对吸附等温线数据进行拟合,以描述其吸附机制。配制系列不同浓度的金银花叶茎藤浸出液,不同温度下用D-101大孔树脂吸附至饱和,测定吸附平衡时黄酮的浓度,计算其单位吸附量及平衡浓度,得到不同温度下的吸附等温线,结果见图5。
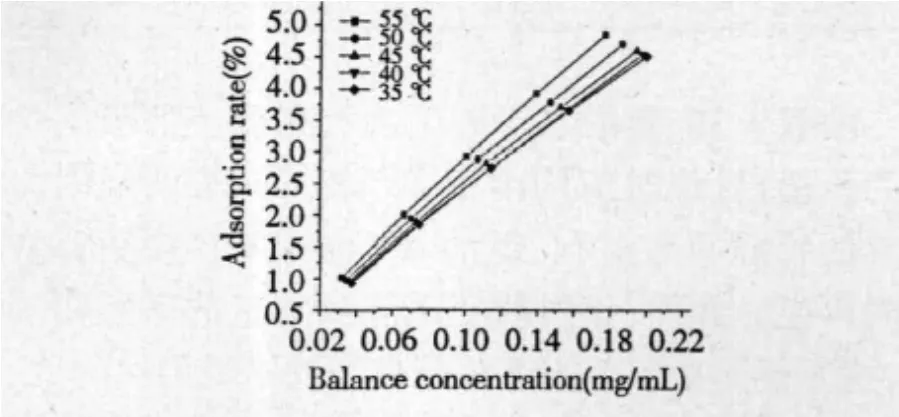
图5 不同温度下的吸附等温线Fig.5 Adsorption isotherms at different temperature
图5表明随着溶液中黄酮浓度的升高,D-101树脂的单位吸附量增加,将图5中实验数据用Langmuir模型进行处理,其线性方程表示如下:
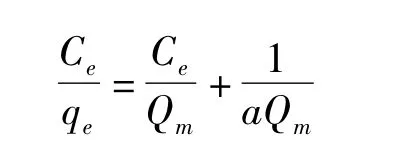
式中:Ce(mg/L)为溶液平衡浓度;qe(mg/g)为单位吸附量;Qm(mg/g)为饱和单位吸附量;a为Langmuir方程常数。以Ce/qe为纵坐标,Ce为横坐标,绘制不同温度下线性拟合等温吸附曲线,其参数见表1。
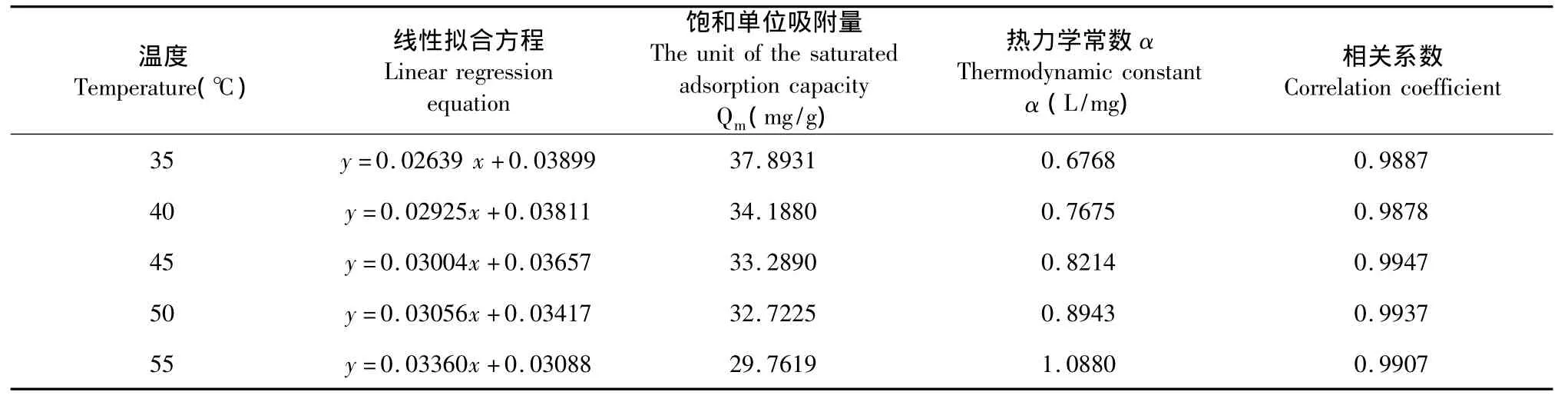
表1 朗格缪尔等温线常数和相关系数Table 1 Langmuir isotherm constants and correlation coefficients
由相关系数可知,用D-101树脂对金银花叶茎藤中的黄酮进行吸附时,其吸附模型可用Langmuir模型描述。从表中还可以看出,对于一定量的树脂,本实验采用35℃进行吸附效果最好,随着温度的升高,饱和单位吸附量下降,原因可能是树脂吸附金银花叶茎藤中的黄酮的过程是自发放热的过程,温度较高时,黄酮的溶解性增加,不利于黄酮分子与树脂表面活性位点的结合,从而导致树脂对其的吸附力降低。
2.3.2 D-101大孔树脂吸附黄酮的焓变ΔH
D-101大孔树脂吸附黄酮的焓变在吸附量一定时,吸附焓 ΔH可由 Vant Hoff方程[11]计算,Vant Hoff方程经整理得下式:lg(1/Ce)=lgK+(-ΔH/RT);式中 R 为气体常数(8.314 J/mol·K),Ce为黄酮的吸附平衡浓度,K为常数。以lg(1/Ce)对1/T作图,由直线的斜率计算ΔH,计算结果见表2。
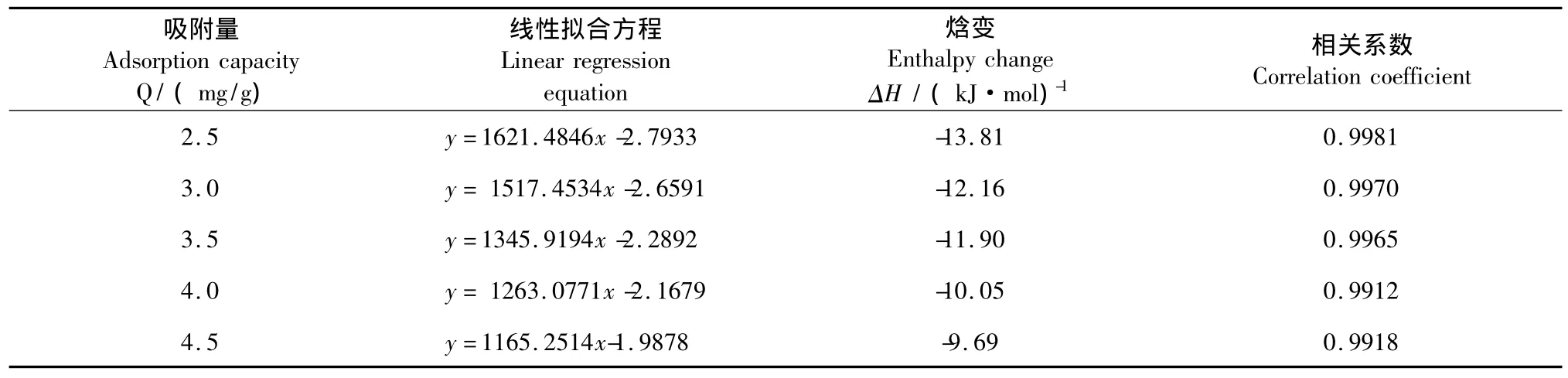
表2 焓变ΔH随吸附量的变化Table 2 The change ofΔH with adsorption capacity
由表2知,黄酮在D-101大孔树脂上的吸附焓变为负值,且绝对值均小于20 kJ/mol,表明吸附为放热的物理吸附过程,低的ΔH值说明该树脂容易脱附再生。此外,吸附焓变随着吸附量的增大而减小,这主要是由于D-101树脂表面的不均匀性所致:在吸附开始时,吸附质会被吸附在树脂表面上吸附中心最活泼的地方,此时吸附活化能最小,放出的吸附热最大,随着吸附量的增加,树脂内部最活泼的活性中心逐步被占据,吸附质只能吸附在那些较不活泼的吸附中心上,此时吸附活化能增加,使得吸附热有所减小。
2.4 不同体积分数的乙醇洗脱液对大孔树脂解吸率的影响
实验结果表明,随乙醇体积分数的增大,总黄酮解吸率逐渐增加,至乙醇体积分数为75%时,总黄酮解吸率达到最大,为94.5%;乙醇体积分数继续增大洗脱率反而减小。可见乙醇体积分数过低或过高都不利于样品解吸。
2.5 动态解吸曲线
从图6可以看出,采用75%的乙醇溶液以2 mL/min的流速进行动态洗脱,洗脱峰集中,没有明显的拖尾现象。用60 mL的75%乙醇就可以将提取物黄酮基本洗脱下来,此时黄酮收率达94.5%。纯化后黄酮纯度为84.5%,是粗提液黄酮含量(16.8%)的5倍,说明D-101大孔吸附树脂能有效地富集纯化金银花叶茎藤浸出液中的总黄酮。
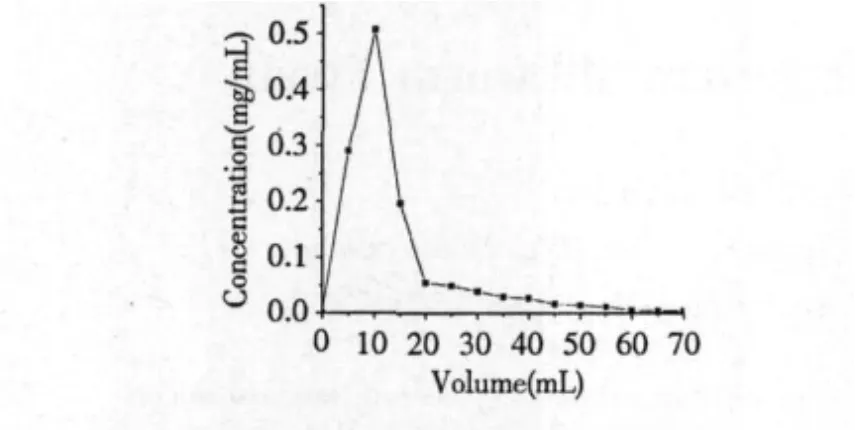
图6 D-101树脂解吸曲线Fig.6 Desorption curve
3 结论
用D-101大孔吸附树脂可有效分离纯化金银花叶茎藤总黄酮,温度30℃最佳吸附工艺参数为:黄酮样液浓度0.538 mg/mL、静置吸附时间80 min、料液比5∶1、pH 2。最佳解吸附工艺参数为:流速为2 mL/min下用60 mL 75%的乙醇溶液洗脱黄酮回收率高达94.5%。金银花叶茎藤粗提液总黄酮得率为1.1%,在最佳吸附及解吸工艺条件下,黄酮纯度由纯化前的16.8%提高至84.5%,纯度提高5倍。
D-101大孔树脂对金银花叶茎藤总黄酮的吸附方式是单分子层吸附,很好地符合Langmuir吸附等温方程式,是自发性放热过程。
D-101树脂吸附金银花叶茎藤中黄酮的吸附动力学可用Pseudo-second-order模型较好地拟合,其表观吸附速率常数为K30℃=1.034×10-2g/mg·min。药典).Beijing:Chemical Industry Press,2005.152-153.
2 Yang JX(杨军宣),Yin RL(尹蓉丽),Chen JY(陈金玉),et al.Study on purification of chlorogenic acid from Lonicera Japonica leaves with macroporous resin.Chin J Exp Tradit Med Form(中国实验方剂学杂志),2010,16(15):20-23.
3 Luo Y(罗悠),Chen LH(陈莉华),Liang X(梁玄),et al.Simultaneous extraction and isolation of chlorogenic acid and flavonoids from leaves and rattan of Lonicera Japonica.J Jishou Univ,Nat Sci(吉首大学学报,自科版),2011,32(5):91-94.
4 Li JY(李锦宇),Chen LH(陈莉华),Luo Y(罗悠).The extractingmethod of effective component from leaves and rattan ofLonicera japonicab(一种从金银花叶茎藤中提取有效成分的方法):China(中国),201110291030.9:2012-1-25.
5 Wang LT(王丽婷),Wang LJ(王丽娟).The separation and purification procedures of total flavonoids in Honeysuckle Leaves.West China J Pharm Sci(华西药学杂志),2010,25:575-576.
6 Hu ZJ(胡志军),Shen LL(沈玲玲),Wan NX(王南溪),et al.Study of separation and purification flavonoids from Lonicera Japonica Thund by macroporous adsorption resin.Ion Exch Adsorp(离子交换与吸附),2011,27:229-237.
7 You H(游辉),Sun AD(孙爱东),Tang L(唐玲),et al.Macroporous resin adsorption for purification of crude flavonoids from bamboo leaves.Food Sci(食品科学),2010,31(8):24-27.
8 Mo XY(莫晓燕),Xu J(徐静),ShaoWX(邵卫祥).Purification of flavonoids from mesosperms of Ginkgo biloba with macro porous adsorbing resins.Nat Prod Res Dev(天然产物研究与开发),2008,20:157-160.
9 Sun L(孙磊),Wang YR(王玉蓉),LiWF(李维峰).Adsorptive thermodynamics and dynamics ofmacroporous resin for total saponin in Radix Polygalae.JBeijing Univ of Tradit Chin Med(北京中医药大学学报),2006,29:772-775.
10 Chen HQ(陈寒青),Jin ZY(金征宇).Study on separation of Trifolium pratense isoflavones by macroporous resins.Nat Prod Res Dev(天然产物研究与开发),2006,18:187-192.
11 Wua FC,Tseng RL,Huang HC,etal.Characteristics of pseudo-second-order kinetic model for liquid-phaseadsorption:A mini-review.Chem Eng J,2009,151(1-3):1-9.

