内生短短芽胞杆菌011菌发酵滤液抑菌活性研究
王宇婷, 易有金,2,3*, 夏 菠, 杨建奎, 曾 静
(1.湖南农业大学食品科学技术学院,长沙 410128;2.湖南省食品科学与生物技术重点实验室,长沙 410128;3.湖南省发酵工程技术中心,长沙 410128;4.湖南农业大学理学院,长沙 410128;
5.湖南农业大学园艺园林学院,长沙 410128)
植物内生菌是一类寄生于健康植物组织内的微生物类群,至今被研究过的不到15%[1]。近几年的研究表明,植物内生菌代谢产物中许多具有抗菌活性。Arunachalam等[2]从穿心莲健康叶中分离出20株内生细菌,8株具有抗菌活性;Gayathri等[3]从5种红树属植物叶中分离到的104株内生细菌中36株具有生物活性,而其中28株具有抗菌活性。80%的内生真菌具有抗真菌、抗杂草或抗藻类活性,而来自土壤中的真菌大约只有43%具有抗菌活性[4]。许多内生菌抗菌活性物质是未开发的新物质[4],据统计,植物内生真菌中发现新化合物的比例为51%,而土壤微生物仅有38%[5]。随着病原菌耐药性的出现,人们渴望开发出新的抗菌药物。对内生菌这一抗菌活性物质来源新领域的研究将具有十分重大的意义。
从烟草植物组织中分离得到一株内生拮抗细菌011,经鉴定其为短短芽胞杆菌[Brevibacillus brevis(Migula)Shida et al.],GenBank登录号为DQ444285[6]。前期研究结果表明,011菌对烟草青枯病具有良好的防治效果,室内和田间防治效果分别达到87.25%和82.23%[6]。为进一步明确该菌产生的抗菌活性物质,并扩大其在生物防治上的应用,本研究对011菌发酵滤液抑菌谱进行测定,并显微观察其对番茄早疫病菌菌丝及孢子抑制作用。011菌发酵滤液对番茄早疫病菌最低抑菌浓度、有效中浓度及其抗菌活性稳定性的测定,为开发新型生物防治剂提供依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株
内生短短芽胞杆菌011菌株由湖南省食品科学与生物技术重点实验室分离、鉴定与保存。番茄早疫病菌[Alternaria solani (Ellis et Martin)Sorauer]、白菜黑斑病菌[A.brassicae (Berk.)Sacc.]、油菜菌核病菌(Sclerotinia sclerotiorumLib.)、黄瓜炭疽病菌[Colletotrichum lagenarium (Pass.)Ell.and Halst.]、辣椒疫病菌(Phytophthora capsici Leonlan)、辣椒炭疽病菌[Colletotrichum capsici (Syd.)Butl.et Bisby]、柑 橘 炭 疽 病 菌 [Colletotrichum gloeosporioides (Penz.)Sacc.]、黄 瓜 枯 萎 病 菌(Fusarium oxysporumSchl.),供试病原菌株均由湖南农业大学植物病理实验室提供。
1.1.2 培养基
BPY液体培养基、PDA固体培养基[7]。
1.2 方法
1.2.1 内生短短芽胞杆菌011菌发酵滤液制备
种子液制备:将斜面保存的011菌株接入BPY培养液中,装液量100mL/250mL、初始pH7.0、30℃、180r/min振荡培养24h。
发酵培养:以1%接种量将种子液接种到BPY发酵培养基中,装液量100mL/250mL、初始pH7.0、30℃、180r/min振荡培养48h。
发酵液处理:011菌液体培养物于10000r/min离心10min,上清液经孔径为0.22μm的微孔滤膜过滤,得到含有抑菌活性物质的发酵滤液。
1.2.2 平皿打孔法检测抗菌活性
将病原真菌接种于PDA固体培养基中央,28℃下培养24h后在新长成的菌丝周围打孔(d=6mm),将待测活性物质注入孔内,每孔100μL,用未接菌的BPY液体培养基作空白对照,28℃培养48h,观察抑菌状况及抑菌带宽度[8]。
1.2.3 抗菌谱测定
采用平皿打孔法测定011菌发酵滤液对8种植物病原真菌的抑菌作用,以未接菌的BPY液体培养基作对照,每处理3次重复。
1.2.4 011菌发酵滤液对番茄早疫病菌菌丝的影响
挑取平皿打孔法抗菌活性测定中抑菌带边缘的番茄早疫病菌菌丝,镜检观察菌丝形态[9],每处理3次重复。
1.2.5 011菌发酵滤液对番茄早疫病菌孢子萌发的影响
将番茄早疫病菌于PDA上培养一定时间后使其产孢,用少量无菌水将病菌孢子洗下来,加无菌水稀释到40倍物镜下每视野中40个孢子。取上述配制的孢子悬浮液加入等体积011菌发酵滤液混均,以加无菌水为对照,取10μL滴加于凹玻片上。28℃保湿培养24h,显微镜下取中间及四周5个视野观察孢子形态,并记录每个视野中孢子总数及萌发数。孢子芽管长度大于孢子直径视为萌发。

1.2.6 MIC及EC50测定
取不同浓度011菌发酵滤液100%、90%、80%、70%、60%、50%、40%、30%、20%、10%,加入等体积番茄早疫病菌孢子悬浮液,使011菌发酵滤液终浓度为50%、45%、40%、35%、30%、25%、20%、15%、10%、5%,按1.2.5观察孢子萌发情况,每处理3次重复。计算孢子萌发抑制率,求出最低抑菌浓度MIC。在MIC之下,将抑菌的百分率转换成几率值,浓度转换成对数,通过回归分析求得抑制萌发的有效中浓度(EC50)。
1.2.7 011菌发酵滤液抗菌活性稳定性测定
热稳定性:将011菌发酵滤液分别于60、70、80、90、100℃水浴中保温1h,以未经处理的发酵滤液为对照。酸碱稳定性:用0.1mol/L的 HCl及0.1mol/L的NaOH溶液将011菌发酵滤液分别调pH 至2.0、4.0、6.0、7.0、8.0、10.0,室温放置12h,将pH调回7.0定容至相同体积。紫外光稳定性:将发酵滤液于20W紫外灯下分别照射(照射距离30cm)30、60、90、120min,以未经紫外光照射的发酵滤液作对照,每处理3次重复。以番茄早疫病菌为指示菌,按1.2.2方法检测抗菌活性。
1.2.8 数据分析
采用SAS软件对数据进行差异显著性分析(Duncan多重比较分析差异性显著性法P=0.05)。回归分析由Microsoft Excel完成。
2 结果与分析
2.1 抗菌谱
011菌发酵滤液抗菌谱显示,该菌株发酵滤液对多种植物病原真菌具有抑制作用,抑菌带宽度见表1,011菌株发酵滤液对番茄早疫病菌抑菌带宽度最大(图1),为5.5mm,拮抗能力最强;对柑橘炭疽病菌抑菌带宽度最小(图2),为2.1mm,拮抗能力最弱。
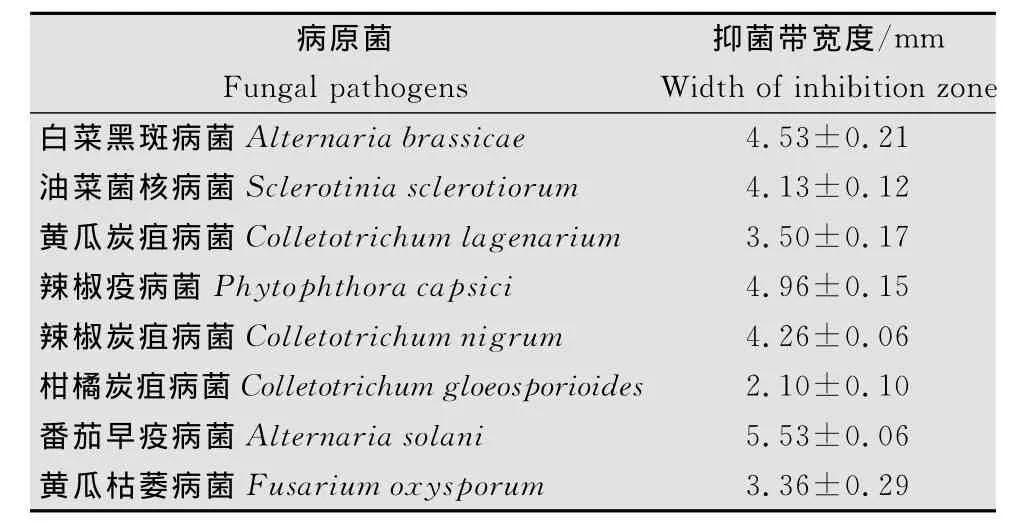
表1 011菌株发酵液对植物病原真菌的拮抗作用Table 1 Antibiotic effects of the ferments of the strain 011 on plant fungal pathogens

图1 011菌株对番茄早疫病菌的抑制作用Fig.1 The inhibition zone of the strain 011against A.solani

图2 011菌株对柑橘炭疽病菌的抑制作用Fig.2 The inhibition zone of the strain 011 against Colletotrichum gloeosporioides
2.2 对番茄早疫病菌菌丝形态的影响
011菌发酵滤液对番茄早疫病菌菌丝生长及菌丝形态有明显影响,在发酵滤液边缘处,病原菌菌丝不能向外生长,形成一条抑菌条带(图1)。挑取抑菌带边缘的番茄早疫病菌菌丝镜检发现,番茄早疫病菌菌丝生长异常,菌丝细胞畸形,菌丝节间变短变粗,粗细不均匀,细胞原生质收缩,出现空泡(如图3a)。正常菌丝光滑,透明,粗细均匀,原生质分布均匀(如图3b)。

图3 011菌株发酵液对番茄早疫病菌菌丝的作用(40×)Fig.3 Antagonism of the strain 011against the mycelia of A.solani
2.3 对番茄早疫病菌孢子萌发影响
采用孢子萌发法,将番茄早疫病菌孢子悬浮液培养24h后,40×显微镜下观察,对照组孢子形成细长、光滑、均匀的芽管(图4c)。高浓度011菌发酵滤液使孢子发芽点处出现囊泡(图4a),从而完全抑制孢子萌发。低浓度011菌发酵滤液使芽管畸形,中间或顶端膨大,或成串珠状(图4b),而且受抑制的孢子芽管长度明显也小于对照组。

图4 011菌株发酵液对番茄早疫病菌孢子萌发影响(40×)Fig.4 Effects of the ferment of the strain 011on spore germination of A.solani(40×)
2.4 MIC及EC50
由表1可知,经不同浓度011菌发酵滤液处理后,番茄早疫病菌孢子萌发均受到不同程度抑制。当浓度大于30%时,孢子萌发完全被抑制,即011菌发酵滤液对番茄早疫病菌孢子萌发MIC为30%。当发酵滤液浓度小于30%时,不同处理间的孢子萌发抑制率表现出显著差异(表2),通过回归分析所得毒力方程:Y=3.4263 X+8.4459,相关系数R=0.9992;经计算知其抑制番茄早疫病菌孢子萌发有效中浓度EC50为9.87%。
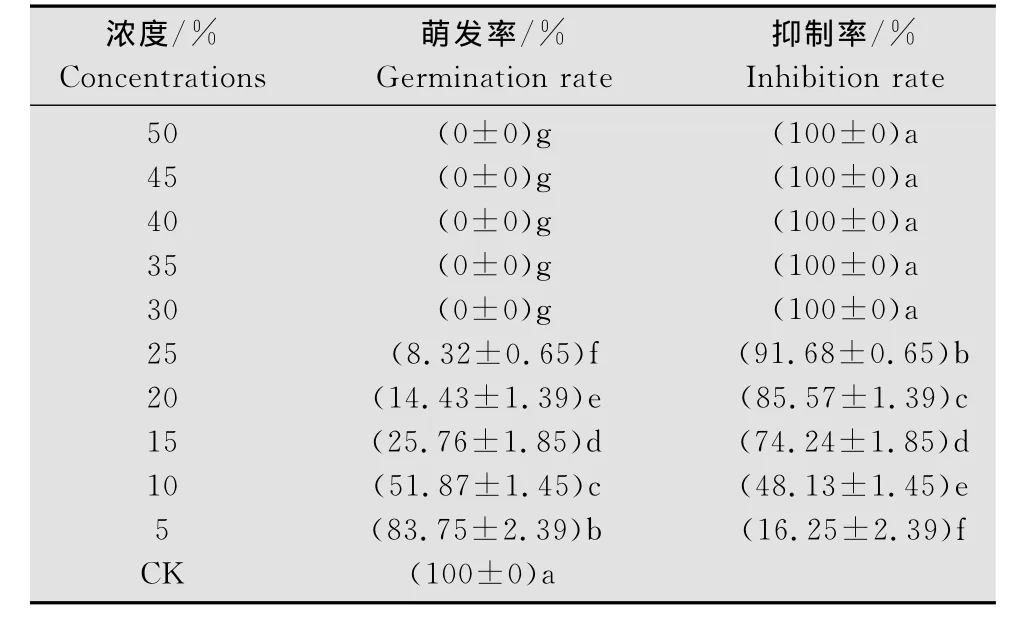
表2 011菌株发酵液对番茄早疫病菌孢子萌发抑制作用Table 2 Inhibition of A.solani spore germination by the ferment of the strain 011
2.5 011菌发酵滤液活性稳定性
由图5可知,温度对发酵滤液抑菌活性影响不大。100℃处理1h抑菌带宽度为5.28mm,为对照(未处理的发酵滤液)抑菌带宽度5.53mm的95.48%,表明发酵滤液中抗菌活性物质对高温具有较好的耐受性。
由图6可知,发酵滤液在酸性条件下有较好的稳定性,pH2.0抑菌带宽度与pH7.0没有明显差异,说明酸性条件对抗菌物质稳定性没有影响。但发酵滤液对碱不稳定,pH7.0抑菌带宽度5.30mm,随着pH的升高抗菌活性显著降低,pH8.0抑菌带宽度为4.61mm,pH10.0抑菌带宽度降为2.71mm。
经紫外光照射不同时间后,结果见图7,其抑菌带宽度与对照(未处理发酵滤液)相比无明显变化,说明该发酵滤液对紫外光不敏感。


图7 不同紫外光照射时间对发酵滤液活性的影响Fig.7 Effects of different UV exposure times on the activity of the culture filtrates of the strain 011
3 讨论
植物内生菌因其在植物体内占据有利生态位点而定殖、诱导植物产生抗性、与植物形成协同关系、产生抗菌活性物质[10],是一种较为理想的生防微生物,内生菌用于田间防治及果蔬保鲜已有报道[11-14]。本试验研究了植物内生菌011菌发酵滤液的抑菌活性,表明011菌株产生抗菌活性物质抑制植物病原菌生长是其作为生防菌的一重要作用机理。抑菌谱测试其对白菜黑斑病菌、油菜菌核病菌、黄瓜炭疽病菌、辣椒疫病菌、辣椒炭疽病菌、柑橘炭疽病菌、黄瓜枯萎病菌、番茄早疫病菌多种植物病原菌均有抑制效果,011菌发酵滤液有望开发成生物农药来防治农作物病原真菌。但本试验还没解决是什么物质起抗菌作用,因此对该菌株发酵滤液的成分还有待深入探索。到目前为止,已有大量研究报道内生菌产生种类繁多的抗菌活性物质,如生物碱、抗菌肽、酚类、萜类、醌类、几丁质酶及挥发性物质等[15]。
显微观察011菌发酵滤液对番茄早疫病菌的抑制作用,发现其使番茄早疫病菌菌丝节间变短变粗,扭曲变形,细胞原生质收缩,出现空泡,使菌丝不能正常生长。这可能是由于活性物质作用于病原菌的细胞膜,造成细胞膜破裂而引起的,有此类现象的抗生素很多,研究清楚的为多烯类抗生素。多烯类抗生素通过与质膜中含有的麦角醇作用损伤细胞质膜造成细胞内物质泄漏[16]。高浓度发酵滤液使番茄早疫病菌孢子出芽点处产生囊泡,而完全抑制芽管生长,低浓度发酵滤液使芽管膨大,而不能正常生长,这与王艳红等[17]报道温郁金内生真菌L18对玉米弯孢叶斑病菌孢子萌发的作用一致。微生物通过分泌一种或多种抗菌物质,作用于病原菌的细胞壁、细胞膜、蛋白质合成系统、能量代谢系统、细胞分裂等,可直接抑制或杀死病原菌[18]。有报道杀稻瘟菌素-S通过抑制孢子和菌丝的呼吸作用而强烈抑制孢子萌发和菌丝生长[19]。但011菌发酵滤液的作用位点还有待进一步研究。
拮抗菌制剂的效果与拮抗菌制剂的发酵工艺、制备方法等有着密切的关系[20]。测定011菌发酵滤液对番茄早疫病菌孢子萌发最低抑菌浓度MIC为30%、有效中浓度EC50为9.87%;稳定性测定表明011菌株产生的具有抗菌活性次生代谢产物,其结构在高温及酸性环境下稳定,在碱性环境中不稳定,且其结构对紫外线不敏感,这为拮抗菌制剂开发及制备提供依据。
[1] 江军山,张鑫.产抗菌活性物质植物内生菌的研究进展[J].安徽农业科学,2010,38(22):11704-11705.
[2] Arunachalam C,Gayathri P.Studies on bioprospecting of endophytic bacteria from the medicinal plant of Andrographis paniculatafor their antimicrobial activity and antibiotic susceptibility pattern[J].International Journal of Current Pharmaceutical Research,2010,2(4):63-68.
[3] Gayathri S,Saravanan D,Radhakrishnan M,et al.Bioprospecting potential of fast growing endophytic bacteria from leaves of mangrove and salt-marsh plant species[J].Indian Journal of Biotechnology,2010,9:397-402.
[4] Schulz B,Boyle C,Draeger S.Endophytic fungi:a source of novel biologically active secondary metabolites[J].Mycological Research,2002,106(9):996-1004.
[5] 吴芳婷,陈代杰,钱秀萍.植物内生菌生物活性物质研究新进展[J].中国抗生素杂志,2004,29(3):184-192.
[6] 易有金,尹华群,罗宽,等.烟草内生短短芽孢杆菌的分离鉴定及对烟草青枯病的防效[J].植物病理学报,2007,37(3):301-306.
[7] 方中达.植病研究方法[M].第3版.北京:中国农业出版社,1998.
[8] 易有金,刘如石,尹华群,等.烟草青枯病拮抗内生细菌的分离、鉴定及其田间防效[J].应用生态学报,2007,18(3):554-558.
[9] 王美琴,贺运春,刘慧平,等.内生环状芽孢杆菌Jcxy8对番茄灰霉病的防病机制研究[J].中国生态农业学报,2010,18(1):98-101.
[10]贾栗,陈疏影,翟永功,等.近年国内外植物内生菌产生物活性物质的研究进展[J].中草药,2007,38(11):1750-1754.
[11]郭小英,刘慧平,韩巨才.植物内生细菌LP5对黄瓜白粉病的田间防治效果[J].湖北农业科学,2011,5(16):3286-3287.
[12]林玲,金中时,马长文,等.棉花黄萎病生防内生细菌Jaas cd的鉴定及田间防效[J].江苏农业学报,2010,26(1):65-69.
[13]吴士云,力军,周声,等.植物内生多粘类芽孢菌对油桃采后青霉病 抑 制 效 果 的 研 究 [J].食 品 科 学,2007,28(11):579-583.
[14]王兰英,廖凤仙,骆焱平.九里香内生细菌HBS-1的鉴定及其对芒果采后病害的防效[J].江苏农业学报,2012,28(1):41-45.
[15]Yu Hongsheng,Zhang Lei,Li Lin,et al.Recent developments and future prospects of antimicrobial metabolites produced by endophytes[J].Microbiological Research,2010,165:437-449.
[16]蒋细良,谢德龄.农用抗生素的作用机理[J].生物防治通报,1994,10(2):76-81.
[17]王艳红,吴晓民,朱艳萍,等.温郁金内生真菌Chaetomium globosumL18对植物病原菌的抑菌谱及拮抗机理[J].生态学报,2012,32(7):2040-2046.
[18]江军山,张鑫.产抗菌活性物质植物内生菌的研究进展[J].安徽农业科学,2010,38(22):11704-11705,11761.
[19]蒋细良,谢德龄,倪楚芳,等.中生菌素对真菌作用机理的研究[J].中国生物防治,1997,13(2):69-71.
[20]裘纪莹,王未名,陈建爱,等.拮抗菌在果蔬保鲜中的应用研究进展[J].食品工业科技,2009,30(5):334-336.

