异土木香内酯及土木香内酯的结构修饰研究
杜会静,史海明,王梦月,彭崇胜,李晓波
上海交通大学药学院,上海 200240
土木香(Inula helenium L.)系菊科旋覆花属多年生草本植物,主产于我国河北,浙江、山西、陕西、甘肃、河南、四川及新疆等地亦产[1],目前也有人工栽培;土木香根(Radix Inulae L.)供药用,具有健脾和胃,行气止痛之功效,用于治疗胸肋及脘腹胀痛、呕吐泻痢、胸肋挫伤、岔气作痛、胎动不安等症[2]。
从20世纪60年代开始,国内外学者对土木香进行的化学成分研究结果表明,其主要含倍半萜类成分;现代药理学研究发现其提取物以及部分化合物具有治疗心血管、糖尿病以及抗过敏和抗真菌等多种活性[3]。Konishi等人在对从土木香中分离得到的7个倍半萜类化合物进行体外抑制细胞增殖实验发现,这些化合物可以显著抑制MK-1、HeLa和B16F10细胞株的增殖,并推测11,13-去氢内酯基团与其抗肿瘤活性有关系[4]。Spiridonov等人在研究俄罗斯民族药用植物和植物提取物时发现,土木香根的乙醇提取物及土木香内酯和异土木香内酯对淋巴瘤细胞Raji增殖有显著的抑制作用[5]。于峰、李勇等人在研究土木香中不同结构的倍半萜类化合物抑制肿瘤细胞增殖活性发现,异土木香内酯对U251SP细胞、HLE细胞和MM1-CB等肿瘤细胞增殖显示较强的抑制活性[6,7]。
基于此,本文以从土木香根中分离得到的异土木香内酯和土木香内酯为原料进行结构修饰,采用体外抑制人肝癌细胞(HepG2细胞)增殖实验对得到的结构修饰产物进行活性研究,初步探讨这些衍生物结构与活性之间的关系,为进一步研究开发土木香提供理论指导。
1 化学实验部分
1.1 仪器和试剂
Waters Q-TOF MS Premier型质谱仪;Bruker AM-400型核磁共振仪测定,TMS为内标;XT显微熔点仪测定,温度未经校正。
青岛海洋化工公司GF254薄层色谱硅胶;所用试剂及溶剂均为分析纯或化学纯。
1.2 原料的制备
在实验室前期研究基础上[8,9]得到土木香内酯和异土木香内酯的混合物粗品60 g,经10%硝酸银硅胶柱层析,石油醚:丙酮 (100∶3~100∶10)溶剂系统梯度洗脱,得化合物1(白色固体,35 g)和化合物2(白色固体,20 g)。
化合物 1:1H NMR(CDCl3)δ:6.13(1H,d,J=2.0 Hz,H-13),5.58(1H,d,J=2.0 Hz,H-13),4.76(1H,d,J=1.6 Hz,H-15),4.49(1H,m,H-8),4.44(1H,d,J=1.6 Hz,H-15),2.97(1H,m,H-7),2.34(1H,m,H-5),2.20(1H,m,H-9),2.00(1H,m,H-6),1.48 ~1.62(6H,m,H-1,H-2,H-3),1.39(1H,m,H-9),1.25(1H,m,H-6),0.83(3H,s,14-CH3),以上数据与文献[10]一致,故化合物 1 鉴定为异土木香内酯。
化合物 2:1H NMR(CDCl3)δ:6.20(d,1H,J=2.0 Hz,H-13),5.61(d,1H,J=2.0 Hz,H-13),5.15(d,1H,J=4.4 Hz,H-6),4.82(m,1H,H-8),3.58(m,1H,H-7),2.45(m,1H,H-4),2.11(dd,1H,J=2.8,2.8 Hz,H-9),1.54(m,1H,H-9),1.41 ~ 1.42(m,6H,H-1,H-2,H-3),1.20(s,3H,14-CH3),1.09(d,3H,J=7.6 Hz,15-CH3),以上数据与文献[10]一致,故化合物2鉴定为土木香内酯。
1.3 结构修饰路线
以从土木香根中分离得到两个化合物异土木香内酯(1)和土木香内酯(2)作为起始化合物,分别经还原、环氧化、加成、双键转移反应,合成得到11个倍半萜内酯类衍生物。结构修饰路线见图1。
1.4 各衍生物的制备
1.4.1 11α,13-二氢异土木香内酯 (1a)和 11α,13-二氢土木香内酯(2a)的制备
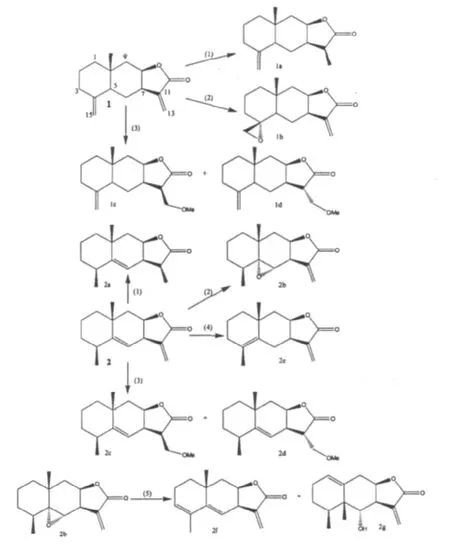
图1 结构修饰路线Fig.1 Synthetic routes of structural modification
异土木香内酯232 mg(1 mmol),NiCl2·6H2O 48 mg(0.15 mmol),NaBH475 mg(2 mmol)和无水甲醇5 mL加至10 mL两口瓶中,搅拌,室温反应。TLC跟踪反应进程。反应结束后反应液以饱和碳酸氢钠溶液调至中性,以乙酸乙酯萃取三次,合并有机相。有机相经水洗、干燥后,除去溶剂,残余物经10%AgNO3硅胶柱层析分离得到白色固体 (1a)198 mg,收率 85.3%,Rf=0.48,展开剂:石油醚-丙酮 (3∶1)。
以土木香内酯为原料,采用相同的方法合成11α,13-二氢土木香内酯 (2a)189 mg,收率 81.5%,Rf=0.48,展开剂:石油醚-丙酮 (3∶1)。
1.4.2 4,15β-环氧异土木香内酯 (1b)和5α,6α-环氧土木香内酯(2b)的制备
异土木香内酯 60 mg(0.25 mmol),m-CPBA 115 mg(0.66 mmol)和三氯甲烷5 mL至10 mL两口瓶中,搅拌,室温反应。TLC跟踪反应进程。反应结束后反应液分别以5%NaHCO3溶液、饱和氯化钠溶液各洗三次,水洗,无水硫酸钠干燥,除去溶剂,残余物经柱层析分离得到白色固体(1b)43 mg,收率71.6%,Rf=0.52,展开剂:石油醚-丙酮 (3∶1)。
以土木香内酯为原料,采用相同的方法合成5α,6α-环氧土木香内酯 (2b)169.3 mg,收率 83.2%,Rf=0.54,展开剂:石油醚-丙酮 (3∶1)。
1.4.3 13β甲氧基甲基异土木香内酯 (1c)和13α甲氧基甲基异土木香内酯(1d)的制备
异土木香内酯58 mg(0.25 mmol),NaOMe 27 mg(0.50 mmol),甲醇5 mL 至10 mL 两口瓶中,搅拌,室温反应。TLC跟踪反应进程。反应结束后减压蒸去反应液中甲醇,以乙酸乙酯萃取三次,合并有机相。有机相水洗,无水硫酸钠干燥后,除去溶剂,残余物以薄层制备板分离,得到白色固体(1c)21 mg和白色固体 (1d)18 mg,收率分别为36.2%和31.0%,Rf(1c)=0.65,Rf(1d)=0.60,展开剂:石油醚-丙酮 (3∶1)。
化合物1c和1d仅从1H NMR中难以区别11位氢的空间立体结构,本文又分别对两个化合物进行了NOE测试加以区分。通过照射13位氢信号,化合物1c中14位甲基有增益,确定其11位氢为α构型;化合物1d中14位甲基未见增益,故确定其11位氢为β构型(构型见图1)。
以土木香内酯为原料,采用相同的方法合成13β甲氧基甲基土木香内酯 (2c)19 mg和13α甲氧基基土木香内酯 (2d)9 mg,收率分别为32.8%和17.2%,Rf(2c)=0.65,Rf(2d)=0.60,展开剂:石油醚-丙酮(3∶1)。NOE测试方法确定两者立体结构,确定化合物2c的11位氢为α构型,确定化合物2d的11位氢为β构型(构型见图1)。其中化合物2d未见有文献报道。
1.4.4 Alloalantolactone(2e)的制备
土木香内酯50 mg(0.22 mmol),三氟醋酸5 mL,三氯甲烷5 mL至20 mL两口瓶中,室温搅拌反应。TLC跟踪反应进程。反应结束后向体系中加适量水,以饱和碳酸氢钠溶液中和,三氯甲烷萃取三次,合并有机相,水洗,无水硫酸钠干燥,除去溶剂,薄层制备板分离得到无色油状物(2e)15 mg,收率20%,Rf=0.65,展开剂:石油醚-丙酮 (3∶1)。
1.4.5 5,8a-dimethyl-3-methylene-3a,7,8,8a,9,9ahexahydro-3H Naphtho[2,3-b]furan-2-one(2f)和 4-Hydroxy-4a,5-dimethyl-3-methylene-3a,4,4a,5,6,7,9,9a-octahydro-3H Naphtho[2,3-b]furan-2-one(2g)的制备
5α,6α-环氧土木香内酯 (2b)45 mg,20% 草酸10 mL至于20 mL两口瓶中,回流搅拌反应。TLC跟踪反应进程。反应结束后反应液冷却至室温,以饱和碳酸氢钠溶液中和,三氯甲烷萃取三次,合并有机相,水洗,无水硫酸钠干燥,除去溶计算值剂,残余物以薄层制备板分离得到白色固体 (2f)10 mg和无色晶体 (2g)9 mg,收率分别为22.2%和20.0%,Rf(2f)=0.65,Rf(2g)=0.60,展开剂:石油醚-丙酮 (3∶1)。
1.5 理化常数及波谱数据
化合物1a mp/℃:134.0~136.5;HRESI-MS m/z[M+H]+:235.1702(理论值:235.1698);1H NMR(400 MHz,CDCl3)δ:4.78(1H,d,J=1.5 Hz,H-15a),4.48(2H,d,J=1.5 Hz,H-15b,H-8),2.79(1H,m,H-11),2.39(1H,m,H-7),2.38(1H,m,H-5),2.17(1H,dd,J=16,16 Hz,H-9),1.99(1H,m,H-6),1.44(1H,dd,J=4.5,4.5 Hz,H-9),1.09 ~1.63(6H,m,H-1,H-2,H-3),1.21(3H,d,J=7.2 Hz,13-CH3),1.13(1H,m,H-6),0.80(3H,s,14-CH3)。
化合物1b mp/℃:126.0~128.5;HRESI-MS m/z[M+H]+:249.1488(理论值:249.1491);1H NMR(400 MHz,CDCl3)δ:6.06(1H,d,J=4.6 Hz,H-13),5.52(1H,d,J=4.6 Hz,H-13),4.44(1H,m,H-8),2.87(1H,m,H-7),2.63(1H,dd,J=1.2,1.6 Hz,H-15),2.51(1H,d,J=3.6 Hz,H-5),2.16(1H,m,H-15),1.85(1H,m,H-9),1.66(1H,m,H-6),1.09 ~1.69(6H,m,H-1,H-2,H-3),1.31(1H,m,H-9),1.17(1H,m,H-6),0.87(3H,s,14-CH3)。
化合物1c mp/℃:97.0~98.0;HRESI-MS m/z[M+H]+:265.1800(理论值:265.1804);1H NMR(400 MHz,CDCl3)δ:4.76(1H,d,J=1.2 Hz,H-15),4.74(1H,m,H-8),4.45(1H,d,J=1.2 Hz,H-15),3.70(1H,m,H-13),3.62(1H,m,H-13),3.35(3H,s,13-OCH3),2.55(1H,m,H-7),2.42(1H,m,H-11),2.33(1H,m,H-5),1.99(1H,m,H-9),1.81(1H,m,H-6),1.30 ~1.61(6H,m,H-1,H-2,H-3),1.26(1H,m,H-9),1.21(1H,m,H-6),0.82(3H,s,14-CH3)。
化合物1d mp/℃:120.0~124.5;HRESI-MS m/z[M+H]+:265.1794(理论值:265.1804);1H NMR(400 MHz,CDCl3)δ:4.78(1H,d,J=1.2 Hz,H-15),4.48(2H,m,H-8,H-15),3.77(1H,m,H-13),3.60(1H,m,H-13),3.39(3H,s,13-OCH3),3.07(1H,m,H-7),2.55(1H,m,H-11),2.34(1H,m,H-5),2.17(1H,m,H-9),1.81(1H,m,H-6),1.30 ~1.61(6H,m,H-1,H-2,H-3),1.27(1H,m,H-9),1.22(1H,m,H-6),0.81(3H,s,14-CH3)。
化合物2a mp/℃:120.0~122.5;HRESI-MS m/z[M+K]+:273.1461(理论值:273.1467);1H NMR(400 MHz,CDCl3)δ:5.17(1H,d,J=3.0 Hz,H-6),4.74(1H,m,H-8),3.02(1H,m,H-7),2.87(1H,m,H-11),2.49(1H,m,H-4),2.10(1H,dd,J=3.0,3.0 Hz,H-9),1.54-1.58(4H,m,H-2,H-3),1.24(3H,s,14-CH3),1.22(3H,d,J=6.9 Hz,13-CH3),1.20-1.50(3H,m,H-1,H-9),1.13(3H,d,J=7.5 Hz,15-CH3)。
化合物2b mp/℃:150.5~154.0;HRESI-MS m/z[M+H]+:249.1493(理论值:249.1491);1H NMR(400 MHz,CDCl3)δ:6.42(1H,d,J=1.0 Hz,H-13),5.79(1H,d,J=1.0 Hz,H-13),4.69(1H,m,H-8),3.69(1H,m,H-7),2.91(1H,d,J=1.0 Hz,H-6),1.91(1H,m,H-9),1.60(1H,m,H-9),1.35 ~1.83(7H,m,H-1,H-2,H-3,H-4),1.14(3H,s,14-CH3),1.09(1H,d,J=5.0 Hz,H-15)。
化合物 2c oil;HRESI-MS m/z[M+H]+:265.1784(理论值:265.1804);1H NMR(400 MHz,CDCl3)δ:5.18(1H,d,J=3.6 Hz,H-6),4.87(1H,m,H-8),3.73(1H,m,H-13),3.64(1H,m,H-13),3.36(3H,s,13-OCH3),3.00(1H,m,H-7),2.51(1H,m,H-11),2.45(1H,m,H-4),2.06(1H,dd,J=3.2,3.2 Hz,H-9),1.41 ~ 1.87(6H,m,H-1,H-2,H-3),1.22(3H,s,14-CH3),1.12(1H,m,H-9),1.12(3H,d,J=7.6 Hz,15-CH3)。
化合物 2d oil;HRESI-MS m/z[M+H]+:265.1795(理论值:265.1804);1H NMR(400 MHz,CDCl3)δ:5.23(1H,d,J=2.4 Hz,H-6),4.76(1H,m,H-8),3.75(1H,m,H-13a),3.52(1H,m,H-13b),3.40(3H,s,13-OCH3),3.17(2H,m,H-7,H-11),2.51(1H,m,H-4),2.11(1H,dd,J=3.2,3.2 Hz,H-9),1.41 ~1.86(6H,m,H-1,H-2,H-3),1.13(1H,m,H-9),1.23(3H,s,14-CH3),1.14(3H,d,J=7.6 Hz,15-CH3)。
化合物 2e oil;HRESI-MS m/z[M+H]+:233.1536(理论值:233.1542);1H NMR(400 MHz,CDCl3)δ:6.24(1H,d,J=2.4 Hz,H-13a),5.60(1H,d,J=1.6 Hz,H-13b),4.49(1H,m,H-8),3.05(1H,m,H-7),2.80(1H,m,H-6),1.96(3H,m,H-6,H-3),1.74(2H,d,J=6.8 Hz,H-9),1.66(3H,s,15-CH3),1.61-1.66(2H,m,H-2),1.47(2H,m,H-1),1.08(3H,s,14-CH3)。
化合物2f mp/℃:108.5~110.5;HRESI-MS m/z[M+H]+:231.1377(理论值:231.1385);1H NMR(400 MHz,CDCl3)δ:6.25(1H,d,J=1.6 Hz,H-13),5.69(1H,d,J=1.6 Hz,H-13),5.64(1H,m,H-3),5.34(1H,d,J=4.8 Hz,H-6),4.88(1H,m,H-8),3.76(m,1H,H-7),2.22(1H,dd,J=1.6,2.4 Hz,H-9),2.05(1H,m,H-1),1.60(1H,m,H-9),1.52(1H,d,J=6.4 Hz,H-1),1.37(2H,m,H-2),1.26(3H,s,15-CH3),1.04(3H,s,14-CH3)。
化合物2g mp/℃:100.5~102.5;HRESI-MS m/z[M+H]+:249.1503(理论值:249.1491);1H NMR(400 MHz,CDCl3)δ:6.35(1H,d,J=3.2 Hz,H-13),5.71(1H,d,J=2.4 Hz,H-13),5.64(1H,m,H-1),4.70(1H,m,H-8),4.00(1H,d,J=6.4 Hz,H-6),3.27(1H,m,H-7),2.64(1H,dd,J=7.6,7.6 Hz,H-9),2.27(1H,m,H-9),1.95 ~2.01(3H,m,H-4,H-2),1.49(2H,m,H-3),1.02(3H,d,J=7.8 Hz,15-CH3),0.98(3H,s,14-CH3)。
2 抗增殖活性实验
以HepG2细胞(人肝癌细胞)为测试细胞株,采用MTT法[11],以异土木香内酯 (1)和土木香内酯(2)为对照组,对11个目标化合物进行抗肿瘤活性测定,结果见表1。化合物1b、2b对HepG2细胞增殖的抑制活性分别大于起始化合物异土木香内酯和土木香内酯,其余结构修饰产物抑制HepG2细胞增殖活性均小于起始化合物,抑制作用大小依次为1b>1 >1a>1c,1d;2b >2 >2f>2g>2e>2a,2c,2d。
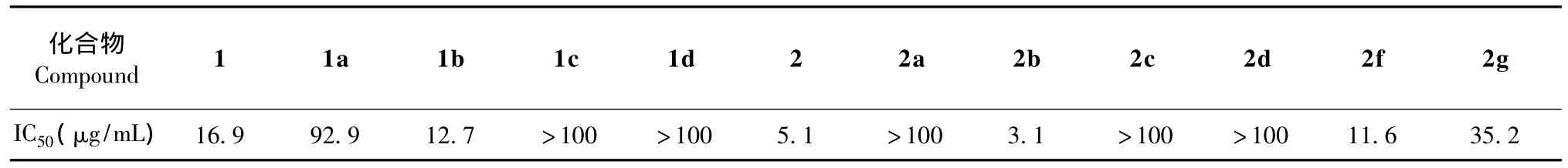
表1 结构修饰物对HepG2细胞的抑制增殖活性Table 1 Inhibitory activities of derivatives of compounds 1 and 2 against HepG2 cancer cells
3 讨论
结合活性测试结果,对异土木香内酯(1)的修饰可以得出以下结论:1)11,13-去氢五元内酯环基团是抑制肿瘤增殖活性的必需基团,还原11位双键为单键或甲氧甲基均会导致活性的大幅下降;2)4,15位的双键经结构修饰为环氧基团后抑制肿瘤增殖活性有所增加。对土木香内酯(2)的修饰可以得出以下结论:1)11,13-去氢五元内酯环基团是抑制肿瘤增殖活性的必需基团,任何的改动都会导致活性的大幅降低,这给我们提示此类化合物修饰的过程中五元不饱和内酯环是不可改变的;2)4,5位的双键变为环氧基团后活性有所增加,但是任何影响双键电子排布的因素都会导致活性的下降(例如在3位形成与其共轭结构),改变双键为单键或双键打开形成6位羟基也会导致活性大幅下降。
从以上分析可以看出,对于土木香内酯类化合物的结构修饰,应保留11,13-去氢内酯的结构,通过修饰3位以及5位的双键使其形成环氧键来增加其抑制肿瘤细胞增殖活性。这将对今后该类化合物的结构修饰具有一定的指导意义。
从天然产物中寻找生物活性成分并开发成新药,或以其为先导化合物经过半合成或结构修饰得到更有效的药物,是新药研发的切实可行的途径[12]。4,15β-环氧异土木香内酯 (1b)和5α,6α-环氧土木香内酯 (2b)在土木香药材中含量很低,但具有较好的抗肿瘤细胞增殖活性,通过本研究可以方便快捷的得到这两个化合物,这将为土木香药材的应用开发提供指导方向。
1 Institue of Botany,The Chinese Academy of Sciences.Flora of China(中国植物志).Beijing:Science Press,1979,75:248-254.
2 Chinese Pharmacopoeia Commission(国家药典委员会).Pharmacopoeia of the People’s Republic of China(中华人民共和国药典).Beijing:China Medical Science Press,2010,I:15.
3 Huo Y,Shi HM,Wang MY,et al.Chemical constituents and pharmacological properties of Radix Inulae.Pharmazie,2008,63:699-703.
4 Konishi T,Shimada Y,Nagao T,et al.Antiproliferative sesquiterpene lactones from the roots of Inula helenium.Biol Pharm Bull,2002,25:1370-1372.
5 Spiridonov NA,Konovalov DA,Arkhipov VV.Cytotoxicity of some Russian ethnomedicinal plants and plant compounds.Phytother Res,2005,19:428-432.
6 Yu F(于峰),Wang SM(王思明),Dong M(董玫),et al.Studies of three sesquiterpene compounds on the anti-growth activity of human tumor cell lines.Nat Prod Res Dev(天然产物研究与开发),2010,22:506-509.
7 Li Y(李勇),Li TK(李铁库),Wen SW(温士旺),et al.In vivo and in vitro anti-tumor activity studies of five sesquiterpenoids from Inula helenium.Chin Pharm Bull(中国药理学通报),2010,26:112-115.
8 Huo Y,Shi HM,Li WW,et al.HPLC determination and NMR structural elucidation of sesquiterpenelactones in Inula helenium.J Pharm Biomed,2010,51:942-946.
9 Huo Y,Shi HM,Wang MY,et al.Complete assignments of1H and13C NMR spectral data for three sesquiterpenoids from Inula helenium.Magn Reson Chem,2008,46:1208-1211.
10 Zhao YM(赵永明),Zhang ML(张嫚丽),Huo CH(霍长虹),et al.Study on the chemical components of the Inula helenium.Nat Prod Res Dev(天然产物研究与开发),2009,21:616-618.
11 Huang SF(黄淑芳),Ying HZ(应华洲),Hu YZ(胡永洲).Synthesis and antitumor activity study of nitrogen-containing curcum in derivatives.Chin J Med Chem(中国药物化学杂志),2011,21(2):88-95.
12 Fang QC(方起程).Structure modification of natural compounds-An important way of the development of new drugs.Chin J New Drug(中国新药杂志),2006,15:1321-1324.

