响应面法优化提取灰树花碱溶性多糖
柴 丽, 侯 红 漫, 张 公 亮
( 大连工业大学 食品学院, 辽宁 大连 116034 )
0 引 言
灰树花(Grifolafrondosa)是一种药食兼用的珍稀真菌,含有多种生理活性物质,但主要活性成分为灰树花多糖[1]。从灰树花中提取的多糖主要具有抗肿瘤、治疗糖尿病、抗肝炎、抗HIV病毒、抗氧化等[2-5]功效。虽然灰树花多糖研究报道很多,但多为灰树花子实体多糖,有关灰树花液体发酵菌丝体多糖的报道与香菇和金针菇多糖相比较少,即便是对于灰树花子实体或菌丝体多糖的研究也只关注于热水提取物,水提取后的剩余物一般作废弃物处理,这就造成了原料的大量浪费。实际上药用真菌含有不同类型的多糖,用一种提取方法很难将其完全抽提出来[6]。基于以上情况,本研究主要对热水提取后通常被当作废弃物丢弃的菌丝体残渣进行重新利用[7],并用响应面分析法(RSM)对灰树花菌丝体残渣提取多糖的条件进行优化,为以后灰树花的综合利用提供可供参考的理论数据。
1 材料与方法
1.1 材 料
灰树花菌种:大连春天生物技术有限公司提供。
1.2 方 法
1.2.1 灰树花碱溶性多糖的提取
菌丝体用蒸馏水反复浸提,直至苯酚-硫酸法检测为阴性。离心后菌丝体残渣用NaOH溶液作为浸提介质进行提取,工艺如下:菌丝体残渣→碱液浸提→离心→上清液加酸中和→离心去沉淀→上清液浓缩→乙醇沉淀→干燥(得碱溶性粗多糖)。
1.2.2 灰树花碱溶性多糖的测定
总糖的测定采用苯酚-硫酸法;还原糖的测定采用3,5-二硝基水杨酸法比色法。
碱溶性多糖量=总多糖量-还原糖量
多糖提取率=多糖量/菌丝体干重
1.2.3 灰树花碱溶性多糖提取条件的响应面分析
采用Box-behnken试验方案,根据单因素的试验结果,运用RSREG(response surface regression)程序对试验点的响应值进行系统分析。
2 结果与讨论
2.1 单因素试验
2.1.1 料液比对灰树花碱溶性多糖提取量的影响
分别取1 g菌丝体残渣,在温度60 ℃、碱浓度0.5 mol/L的条件下,水浴加热提取1 h,料液比分别为1∶20、1∶30、1∶40、1∶50、1∶60,每组做3个平行试验,测定碱溶性粗多糖提取率,结果如图1所示。

图1 料液比对灰树花碱溶性多糖提取量的影响
Fig.1 Impact of liquid-solid ratio onGrifolafrondosaalkaline polysaccharide extracting
由图1可知,随着料液比的不断增加,多糖提取量呈上升趋势,当料液比超过1∶50时,多糖提取量增加的趋势不明显,考虑到节约试剂的情况,故选择料液比为1∶50。
2.1.2 提取时间对灰树花碱溶性多糖提取量的影响
分别取1 g菌丝体残渣,在温度60 ℃、料液比为1∶60、碱浓度0.5 mol/L的条件下,分别提取15、30、45、60、75、90 min,每组做3个平行试验,测碱溶性粗多糖提取量,结果如图2所示。从图2可知,灰树花碱溶性多糖提取时间为30 min 时,多糖提取量达到最大,并且随着时间的继续增加,多糖提取量反而减少,可能是提取时间太长,碱溶液改变了多糖的结构,导致多糖含量降低,故选择提取时间30 min。

图2 时间对灰树花碱溶性多糖提取量的影响
Fig.2 Impact of different extraction time onGrifolafrondosaalkaline-soluble polysaccharide extracting
2.1.3 NaOH浓度对灰树花碱溶性多糖提取率的影响
分别取1 g菌丝体残渣,在温度60 ℃、料液比为1∶60的条件下,NaOH溶液的浓度分别为0.1、0.2、0.3、0.4、0.5、0.6、0.7 mol/L的条件下提取为1 h,每组做3个平行试验,测碱溶性粗多糖提取量,结果如图3所示。
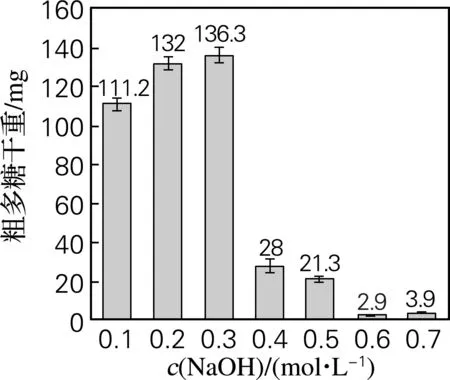
图3 NaOH浓度对灰树花碱溶性多糖提取量的影响
Fig.3 Impact of different sodium hydroxide concentration onGrifolafrondosaalkaline- soluble polysaccharide extraction
从图3可以看出,当NaOH浓度为0.3 mol/L时,粗多糖干重最大;随着NaOH浓度的不断增加,粗多糖干重反而降低。可能是NaOH溶液对多糖的立体旋光结构有一定破坏作用,当碱溶液浓度升高至一定浓度后提取量反而降低,故选择NaOH浓度为0.3 mol/L。
2.2 响应面法优化灰树花碱溶性多糖提取条件
通过单因素试验可知,以NaOH浓度X1、料液比X2和提取时间X3为变量,以灰树花菌丝体残渣所含的碱溶性多糖提取率Y为响应值,运用响应面程序对提取条件优化,以提高菌丝体残渣碱溶性多糖提取率,试验因素与水平设计见表1。
表1 响应面分析水平和因素
Tab.1 Response surface method analysis of levels and factors

因素水平-101X10.10.30.5X21∶301∶601∶90X3103050
将X1、X2、X3各个水平进行编码,试验结果见表2。在表2中,前12个点是以自变量X1、X2和X3的取值形成的三维顶点;后3个点是中心点。为了能准确地用来估计试验误差,在试验过程中,需要对中心点进行3次平行试验。继续用RSREG程序对表2中所得结果进行程序分析,结果见表3。
表2 响应面分析方案和结果
Tab.2 Response surface method experimental design and results

试验X1X2X3Y/%1-1-100.352-10-10.393-10-10.514-1100.4850-1-10.4460-110.37701-10.4580110.4691-100.311010-10.30111010.27121100.51130000.65140000.69150000.72
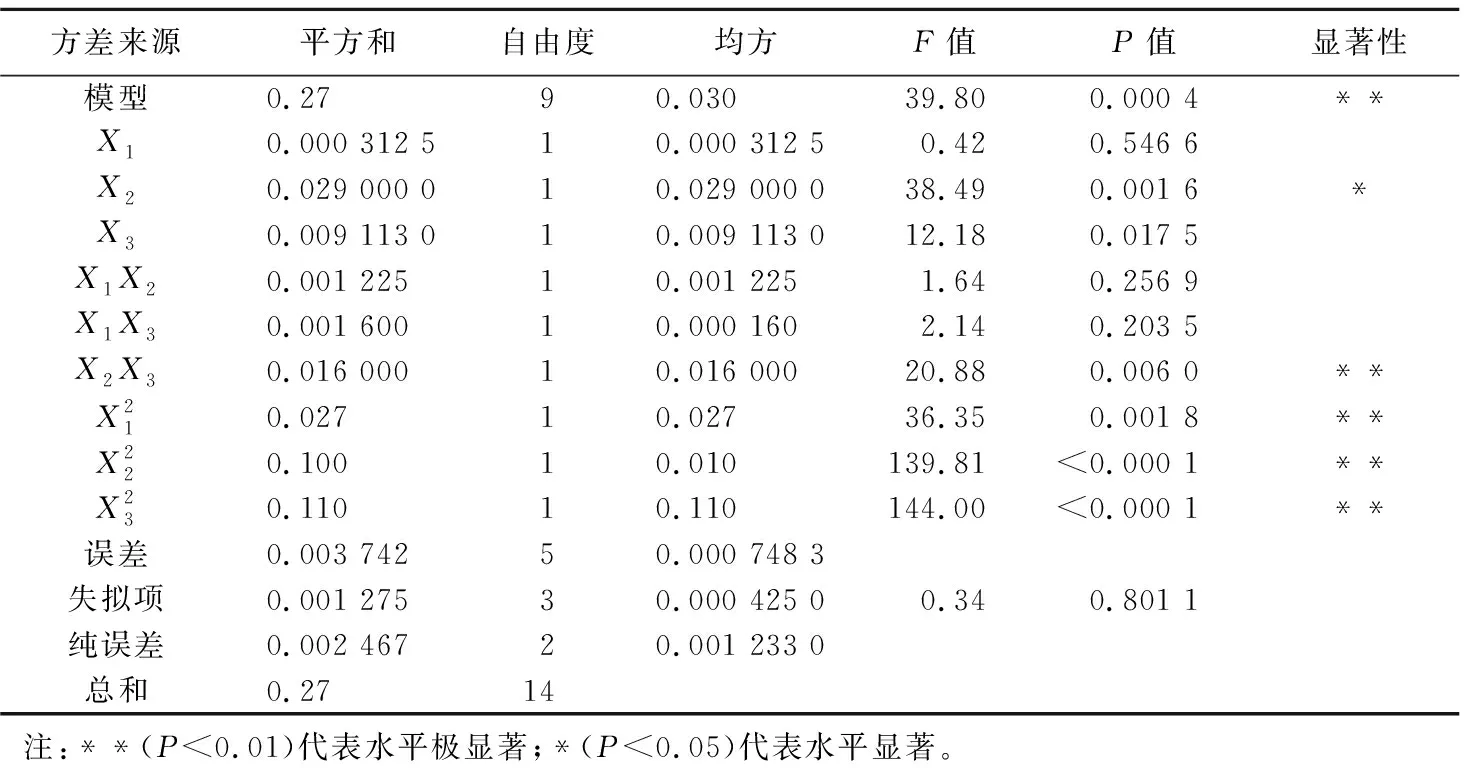
表3 回归结果与分析
由表3中数据分析可以得出灰树花菌丝体残渣碱溶性多糖的提取率Y与不同提取因素之间的拟合方程:
Y=-0.545 42+1.281 25X1+0.022 194X2+
0.019 562X3-0.002 916 67X1X2+
0.005X1X3+0.000 104 167X2X3-

通过分析结果可以作出相应的等高线图及其曲面图,以确认NaOH浓度、料液比和时间3个因素对灰树花碱溶性多糖提取率的影响,结果如图4~6所示。
由图4可以看出,当X1变化时,X2对灰树花碱溶性多糖的提取率Y的影响不明显;同时,当X2变化时,X1对灰树花碱溶性多糖的提取率Y的影响也不明显。
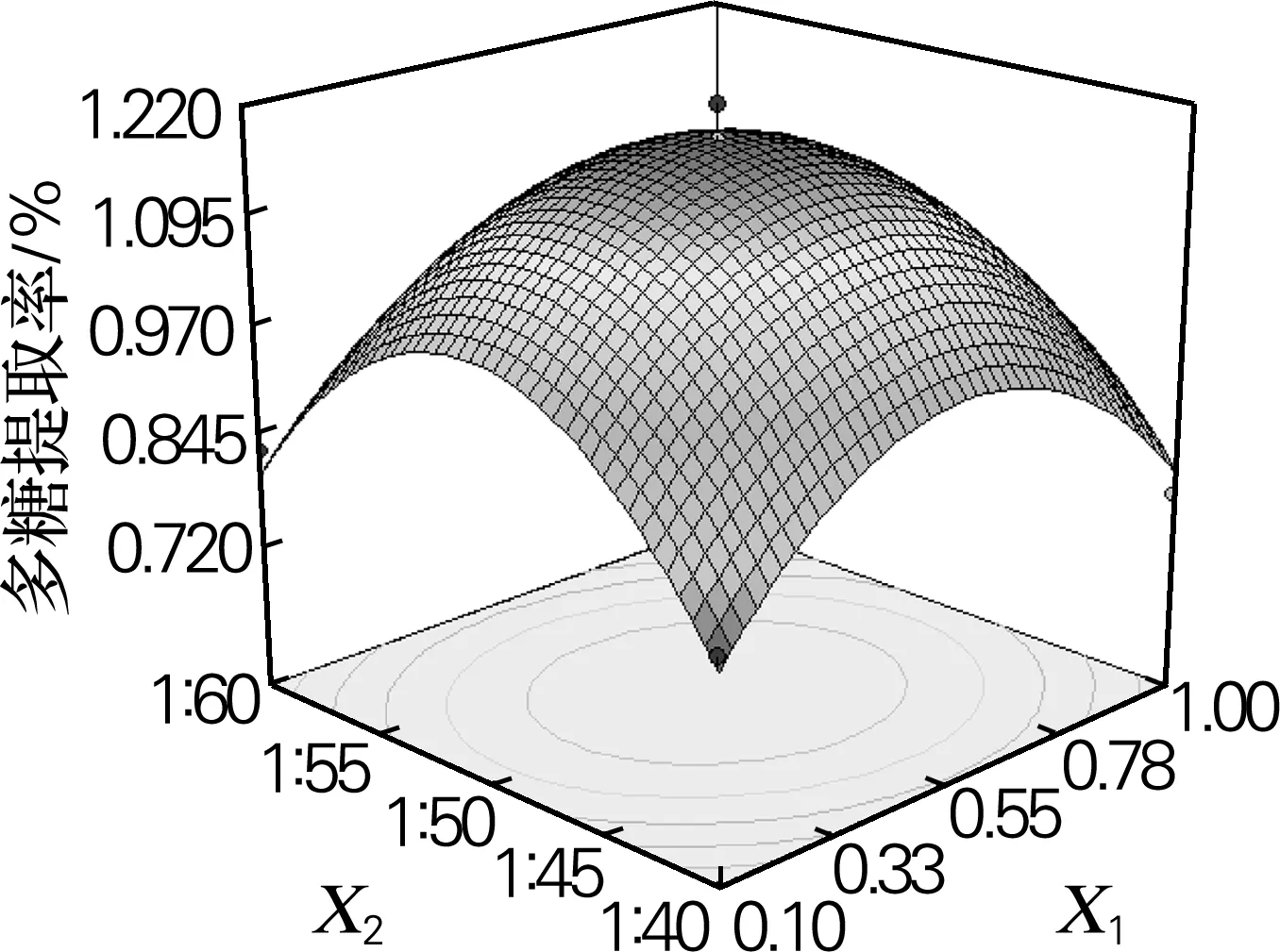
图4 Y=f(X1,X2)的响应面立体分析图
由图5可以看出,X1、X3也表现出与图4相似的规律,但从单个因素对Y的影响来看,X3对Y影响的显著性要大于X1。
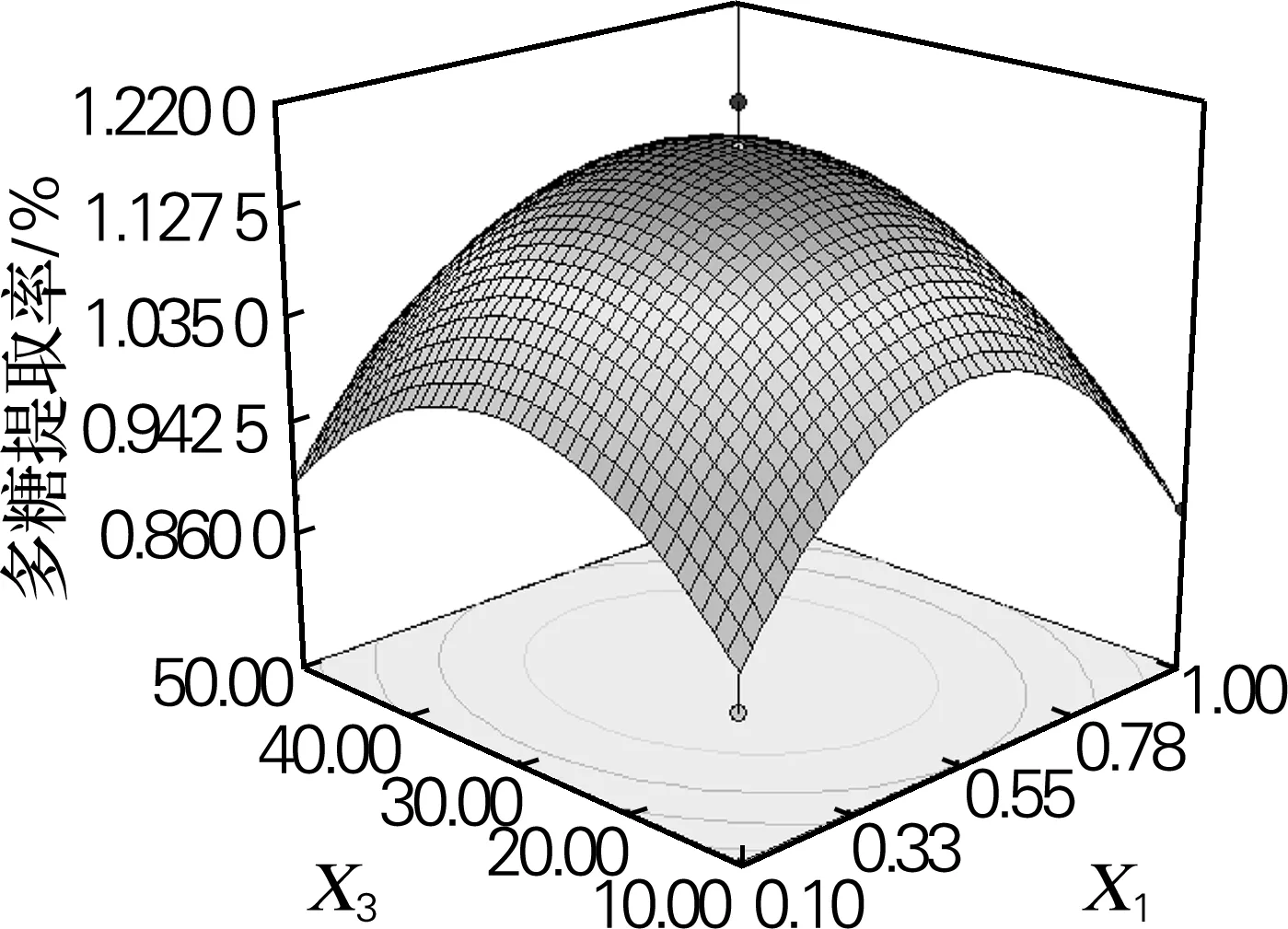
图5 Y=f(X1,X3)的响应面立体分析图
从图6可以看出,X2与X3的交互作用显著,X2取不同值时,X3对灰树花碱溶性多糖提取率Y的影响表现出不同程度的变化;同理,当X3取不同值时,X2对灰树花碱溶性多糖提取率Y的影响也表现出不同的变化。

图6 Y=f(X2,X3)的响应面立体分析图
通过软件分析计算,当灰树花碱提多糖提取率最高时,碱浓度为0.29 mol/L、料液比为1∶66、时间为33 min。按照最优提取条件对灰树花菌丝体粉末进行多次碱提,计算灰树花碱溶性多糖的提取率。多次平行试验得到的实测值为0.73%,理论值为0.70%,实测值与理论值相比相对误差在0.1%之内,预测值与理论值非常接近,偏差较小。
3 结 论
在单因素试验设计的基础上,通过三因素三水平的响应面设计对灰树花碱溶性多糖的提取条件进行了优化,从而建立了各个因素与响应值Y之间的数学模型,通过回归模型确定了灰树花碱溶性多糖的最佳工艺参数:NaOH浓度为0.29 mol/L,料液比为1∶66,提取时间为33 min。在最佳条件下,得出灰树花碱溶性多糖的提取率为0.70%。重复3次提取试验,实际测得的平均值为0.73%,与理论值相比,其相对误差在0.1%之内。因此,采用响应面分析法对灰树花碱溶性多糖提取条件进行优化,可获得最优的工艺参数。
[1] 吴智艳,闫训友. 灰树花生理活性物质的研究进展[J]. 食用菌, 2006, 9(6):174-175.
[2] KUBO K, NANBA H. Modification of cellular immune responses in experimental autoimmune hepatitis in mice by maitake(Grifolafrondosa)[J]. Mycoscience, 1998, 39(4):351-360.
[3] ADACHI Y, SUZKI Y, OHNO N, et al. Adjuvant effect of grifolan on antibody production in mice[J]. Biological and Pharmaceutical Bulletin, 1998, 21(9):974-977.
[4] 杜巍,袁静,李元瑞,等. 灰树花菌丝体多糖G.F.-2理化性质及生物活性的研究[J]. 菌物系统, 2003, 22(2):289-295.
[5] 李小定,荣建华,吴谋成. 灰树花多糖PGF-1体外对羟基自由基的抑制作用[J]. 食品科学, 2003, 24(7):128-129.
[6] 王艳萍,黄剑,刘舒翔,等. 灰树花胞内多糖和胞外多糖的组成分析[J]. 中国酿造, 2011(5):95-97.
[7] 姜福佳. 酒糟中活性成分的提取及其活性的研究[D]. 长春:吉林大学, 2009:32-37.

