氢化可的松对人NK细胞增殖及其对胰腺癌SW1990细胞杀伤效率的影响
薛成俊 周忠海 陈复兴 吕小婷 李莹 费素娟
·论著·
氢化可的松对人NK细胞增殖及其对胰腺癌SW1990细胞杀伤效率的影响
薛成俊 周忠海 陈复兴 吕小婷 李莹 费素娟
目的探讨氢化可的松对人外周血NK细胞增殖及其对胰腺癌SW1990细胞杀伤力的影响。方法分离健康人外周血单个核细胞加入到含IL-15细胞因子的NK细胞培养基中诱导培养NK细胞。当NK细胞纯度达到70%以上时,加入10-6、10-5、10-4、10-3μmol/L氢化可的松继续培养7 d。以未加氢化可的松的NK细胞作为对照组。采用锥虫蓝染色计数细胞;采用流式细胞术检测CD3-CD56+NK细胞含量及其穿孔素、颗粒酶B和IFN-γ的表达;以20∶1的效靶比将NK细胞与SW1990细胞共培养,用细胞增殖-毒性检验法(CCK-8)检测NK细胞对SW1990细胞的杀伤效应。结果用氢化可的松处理7 d后NK细胞量平均达到70.72%~76.39%,与对照组的(72.61±3.76)%差异无统计学意义;10-6、10-5、10-4、10-3μmol/L氢化可的松处理组NK细胞的增殖倍数分别为(9.13±0.94)、(9.67±1.51)、(10.33±1.07)、(8.40±1.47)倍,均显著高于对照组的(4.23±0.82)倍(P值均<0.01);NK细胞对SW1990细胞的杀伤效率分别为(58.58±4.89)%、(62.27±5.63)%、(64.02±5.79)%、(63.88±3.61)%,均较对照组的(57.46±5.11)%增强,其中10-4μmol/L组的差异具有统计学意义(P<0.05);10-4、10-3μmol/L氢化可的松处理组NK细胞穿孔素表达分别为(96.71±3.04)%、(97.56±2.18)%,显著高于对照组的(92.40±3.53)%(P<0.05或0.01);10-5μmol/L氢化可的松处理组NK细胞的颗粒酶B表达为(78.23±2.94)%,显著高于对照组(73.68±3.52)%(P<0.05);10-5、10-4、10-3μmol/L 氢化可的松处理组NK细胞IFN-γ表达分别为(96.61±2.04)%、(97.58±2.17)%、(98.00±1.77)%,均显著高于对照组的(92.44±2.74)%(P值均<0.01)。结论氢化可的松可促进IL-15活化的NK细胞增殖,适当浓度条件下增强对SW1990细胞杀伤活性,其机制可能与其穿孔素、颗粒酶B和IFN-γ表达上调有关。
氢化可的松; 杀伤细胞,天然; 胰腺肿瘤; 细胞增殖; 杀伤活性
NK细胞是机体固有免疫重要的淋巴细胞,它通过分泌IFN-γ、IL-2和TNF-α等细胞因子和趋化因子启始和调节机体的免疫反应[1],无需通过抗原预先刺激即可直接杀伤肿瘤和病毒感染的靶细胞,是肿瘤免疫治疗重要的效应细胞[1-2]。氢化可的松(hydrocortisone, HC)属糖皮质激素,不仅具有免疫抑制作用,而且对免疫系统可能有正性调节作用,这取决于免疫系统淋巴细胞的活化状态[3]。因此,本研究观察HC对NK细胞体外增殖及杀伤胰腺癌SW1990细胞效率的影响,为培养更高数量和功能活性的NK细胞用于肿瘤过继性免疫治疗提供实验依据。
材料与方法
一、外周血NK细胞培养
8例外周血标本采自健康献血员,其中男性5人,女性3人,年龄23~48岁,中位年龄35岁。经人淋巴细胞分离液梯度密度离心获得外周血单个核细胞(PBMCs),用磷酸盐缓冲液(PBS)洗涤2次,调整细胞密度为5×105/ml,加入含IL-15 (厦门特宝生物工程公司)500 U、5%自身血清的NK细胞培养基中培养10 d,收集细胞进行CD3-CD56+NK细胞表型鉴定,获取有效扩增的NK细胞。调整有效扩增的NK细胞密度为5×105/ml,分别加入10-6、10-5、10-4、10-3μmol/L的HC,置37℃、5% CO2培养箱中培养7 d。以未加HC的作为对照组。
二、NK细胞表型鉴定
收集各组细胞,用PBS洗涤2次,计数细胞,调整细胞密度为1×107/ml。取100 μl 细胞悬液,分别加入20 μl 异硫氰酸荧光素(FITC)标记的anti-CD56和藻红蛋白(PE)标记的anti-CD3室温避光孵育15 min,PBS洗涤2遍,加入400 μl PBS重悬细胞,流式细胞术检测各组NK细胞的百分含量。
三、NK细胞增殖倍数
收集各组NK细胞,用PBS洗涤后锥虫蓝染色计数细胞总数,结合流式细胞术细胞纯度检测结果,NK细胞增殖倍数=HC干预后细胞数×NK细胞含量(%)/HC干预前细胞数×NK细胞含量(%)。
四、NK细胞穿孔素、颗粒酶B和IFN-γ表达的检测
收集各组NK细胞,用PBS洗涤2次,调整细胞密度为1×107/ml。每组取3管100 μl 细胞悬液,加入20 μl FITC标记的anti-CD56和PerCP-Cy5.5标记的anti-CD3(BD公司),室温避光孵育15 min,加入100 μl破膜试剂A(Invitrogen公司)室温避光孵育15 min,PBS洗涤后再加入100 μl破膜试剂B(Invitrogen公司),同时在穿孔素测定管中加入5 μl PE标记的anti-Perforin(eBioscience公司),颗粒酶B测定管中加入20 μl PE标记的anti-Granzyme B(eBioscience公司),IFN-γ测定管中加入5 μl 别藻青蛋白(APC)标记的anti-IFN-γ(BD公司),室温避光孵育15 min,PBS洗涤,以400 μl PBS重悬细胞,上流式细胞仪检测穿孔素、颗粒酶B和IFN-γ的表达,结果以百分值表示。
五、NK细胞对SW1990细胞杀伤效率的检测
人胰腺癌SW1990细胞购自中国科学院上海生命科学研究所细胞资源中心,常规培养、传代。取对数生长期SW1990细胞作为靶细胞,以5×103/孔的密度接种于96孔板,以20∶1的效靶比分别加入不同浓度HC干预培养7 d的NK细胞,总体积为200 μl/孔,同时设各浓度组的空白对照组、效应细胞对照组和靶细胞对照组,每组设3个复孔。效应细胞与靶细胞共孵育24 h后加入CCK-8溶液(碧云天生物技术公司)20 μl/孔,继续孵育4 h后上酶联免疫分析仪测每孔450 nm处吸光度值(A450值)。杀伤活性(%)=[1-(实验组A450值-效应细胞对照组A450值)/ 靶细胞对照组A450值]×100%。
六、统计学处理
结 果
一、NK细胞培养表型鉴定
10-6、10-5、10-4、10-3μmol/L HC处理7 d后,CD3-CD56+的NK细胞量分别为(72.14±3.51)%、(71.75±2.36)%、(70.83±2.90)%、(69.88±4.14)%,与对照组的(72.61±3.76)%差异无统计学意义(t值分别为0.258,0.548,1.060,1.381,P值均>0.05,图1)。
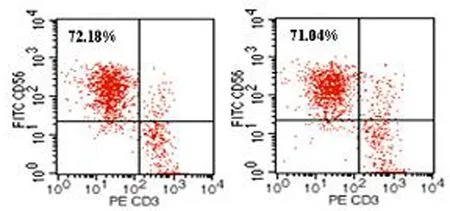
图1对照组(左)、10-5μmol/L氢化可的松处理组(右)CD3-CD56+的NK细胞量
二、NK细胞增殖力的变化
10-6、10-5、10-4、10-3μmol/L HC处理7 d后,NK细胞增殖倍数分别为(9.13±0.94)、(9.67±1.51)、(10.33±1.07)、(8.40±1.47)倍,较对照组的(4.23±0.82)倍显著增高(t值分别为11.111,8.955,12.799,7.007,P值均<0.01)。
三、NK细胞对SW1990细胞的杀伤效率
10-6、10-5、10-4、10-3μmol/L HC处理7 d后,NK细胞对SW1990细胞的杀伤效率在效靶比20∶1时分别为(58.58±4.89)%、(62.27±5.63)%、(64.02±5.79)%、(63.88±3.61)%,较对照组的(57.46±5.11)%增强,其中10-4μmol/L HC处理组的差异具有统计学意义(t值分别为0.448,1.789,2.403,2.902,P值均<0.05)。
四、NK细胞穿孔素、颗粒酶B和IFN-γ的表达
10-5μmol/L HC处理组NK细胞的颗粒酶B和IFN-γ表达显著高于对照组,10-4、10-3μmol/L HC处理组NK细胞穿孔素和IFN-γ的表达均显著高于对照组(表1、图2)。
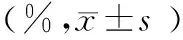

组别穿孔素颗粒酶BIFN-γ对照组92.40±3.5373.68±3.5292.44±2.7410-6μmol/LHC组90.59±5.8275.03±3.1995.03±2.5210-5μmol/LHC组92.67±3.4978.23±2.94a96.61±2.04b10-4μmol/LHC组96.71±3.04a77.75±3.8497.58±2.17b10-3μmol/LHC组97.56±2.18b74.28±4.1598.00±1.77b
注:与对照组比较,aP<0.05,bP<0.01

图2同型对照组(左)、对照组(中)、10-4μmol/L氢化可的松处理组(右)NK细胞的穿孔素(上)、颗粒酶B(中)和INF-γ(下)表达
讨 论
NK细胞是不同于T、B细胞的一类大颗粒淋巴细胞亚群,在外周血中含量相对较少,约占外周血淋巴细胞10%~15%,具有抗肿瘤、抗感染和免疫调节等功能,且不受组织相容性复合物(MHC)的限制,是机体重要的固有免疫细胞,同时还具有适应性免疫的特性[4]。动物实验和临床肿瘤过继免疫治疗研究结果表明,基于NK细胞的过继性免疫治疗是安全有效的[5-7],有望成为临床肿瘤细胞免疫治疗的重要手段。
鉴于体外扩增的NK细胞具有较高的抗肿瘤活性[8-10]和HC对免疫系统的双相调节作用,本研究先选择IL-15活化扩增NK细胞,然后用不同浓度的HC处理NK细胞7 d,结果经HC处理各组NK细胞百分含量并没有显著性的变化,但增殖倍数却显著高于未加HC处理的对照组,这表明HC促进了IL-15活化的NK细胞的体外扩增,其作用机制可能是HC增强了NK细胞表面IL-15R的表达,从而放大了IL-15及其受体介导的信号转导途径[11]。
穿孔素是NK细胞胞质中的细胞毒颗粒,可在靶细胞膜上形成管状跨膜通道,致靶细胞裂解。颗粒酶B是NK细胞颗粒中重要的丝氨酸蛋白酶,通过穿孔素在靶细胞膜上形成的通道进入靶细胞,激活凋亡相关酶系统致细胞凋亡。穿孔素/颗粒酶途径和IFN-γ等细胞因子产生和分泌是NK细胞杀伤靶细胞的重要机制[12-13]。本研究结果表明,HC与IL-15共同诱导培养后,NK细胞穿孔素、颗粒酶B及IFN-γ的表达增强,提示HC处理后的IL-15活化的NK细胞杀伤肿瘤细胞的功能没有受到负面的影响,而是不同程度地增强。
胰腺癌是消化系统常见的恶性肿瘤,发病率呈逐年上升趋势,高居恶性肿瘤死亡病因的第5位,手术切除后的生存率偏低[14],因此本研究选择胰腺癌SW1990细胞进行体外杀伤研究。结果表明不同浓度HC处理后NK细胞对SW1990细胞的杀伤能力增强,其中10-4μmol/L HC处理组与无HC处理的对照组的差异具有统计学意义,与Moustaki等[15]结果基本一致。HC处理的NK细胞保持了原有的肿瘤细胞杀伤活性并略有增加,这可能与HC和IL-15共培养后NK细胞穿孔素、颗粒酶B及IFN-γ的表达上调有关,是否影响其他与NK细胞杀伤肿瘤细胞相关的分子机制以及HC干预培养的NK细胞用于临床治疗的安全性和有效性还有待于进一步研究。
[1] Sutlu T, Alici E. Natural killer cell-based immunotherapy in cancer: current insights and future prospects. J Intern Med, 2009, 266:154-181.
[2] Lapteva N, Durett AG, Sun J, et al. Large-scale ex vivo expansion and characterization of natural killer cells for clinical applications. Cytotherapy, 2012, 14:1131-1143.
[3] Perez SA, Mahaira LG, Demirtzoglou FJ, et al. A potential role for hydrocortisone in the positive regulation of IL-15-activated NK-cell proliferation and survival. Blood, 2005, 106:158-166.
[4] Sun JC, Beilke JN, Lanier LL. Adaptive immune features of natural killer cells. Nature, 2009, 457:557-561.
[5] Ni J, Miller M, Stojanovic A, et al. Sustained effector function of IL-12/15/18-preactivated NK cells against established tumors. J Exp Med, 2012, 209:2351-2365.
[6] Geller MA,Cooley S,Judson PL,et al.A Phase Ⅱ study of allogeneic natural killer cell therapy to treat patients with recurrent ovarian and breast cancer.Cytotherapy,2011,13:98-107.
[7] Arai S, Meagher R, Swearingen M, et al. Infusion of the allogeneic cell line NK-92 in patientswith advanced renal cell cancer or melanoma: a phase I trial. Cytotherapy, 2008,10:625-632.
[8] Spanholtz J, Tordoir M, Eissens D, et al. High log-scale expansion of functional human natural killer cells from umbilical cord blood CD34-positive cells for adoptive cancer immunotherapy. PLoS One, 2010, 5:e9221.
[9] Vacca P, Martini S, Garelli V, et al. NK cells from malignant pleural effusions are not anergic but produce cytokines and display strong antitumor activity on short-term IL-2 activation. Eur J Immunol, 2013, 43:550-561.
[10] Kim EK, Ahn YO, Kim S, et al. Ex vivo activation and expansion of natural killer cells from patients with advanced cancer with feeder cells from healthy volunteers. Cytotherapy, 2013,15:231-241.
[11] Fehniger TA, Caligiuri MA. Interleukin 15: biology and relevance to human disease. Blood, 2001, 97:14-32.
[12] Aktas E, Kucuksezer UC, Bilgic S, et al. Relationship between CD107a expression and cytotoxic activity. Cell Immunol, 2009, 254:149-154.
[13] Sarhan D, D′Arcy P, Wennerberg E, et al. Activated monocytes augment TRAIL-mediated cytotoxicity by human NK cells through release INF-γ. Eur J Immunol, 2013, 43:249-257.
[14] 金钢, 邵卓, 胡先贵, 等. 胰腺癌2061例外科手术的疗效与预后分析, 中华胰腺病杂志, 2013, 13:1-4.
[15] Moustaki A, Argyropoulos KV, Baxevanis CN, et al. Effect of the simultaneous administration of glucocorticoids and IL-15 on human NK cell phenotype, proliferation and function. Cancer Immunol Immunother, 2011, 60:1683-1695.
EffectofhydrocortisoneonproliferationandkillingactivityofNKcellsagainstSW1990cells
XUECheng-jun,ZHOUZhong-hai,CHENFu-xing,LÜXiao-ting,LIYing,FEISu-juan.
DepartmentofGastroenterology,AffiliatedHospitalofXuzhouMedicalCollege,Xuzhou221002,China
Correspondingauthor:FEISu-juan,Email:feisj1031@yahoo.com.cn
ObjectiveTo investigate the effects of hydrocortisone (HC) on proliferation and killing activity of NK cells against pancreatic cancer SW1990 cells in vitro.MethodsPeripheral blood mononuclear cells of healthy people were isolated and cultured with NK cells medium containing IL-15. When the purity of NK cells reached above 70%, different concentrations of HC (10-6, 10-5, 10-4, 10-3μmol/L) were added and co-cultured with NK cells for 7 days. And NK cells without HC were used as control. CD3-CD56+NK cell numbers of each group were countered by trypan blue staining. Perforin, granzyme B and IFN-γ expression of CD3-CD56+NK cells were verified by flow cytometry. NK cells and SW1990 cells were co-cultured with a 20∶1 effector to target ratio, then the cytotoxic activity of NK cells against SW1990 cells were analyzed by CCK-8 kit.ResultsAfter treatment with different concentration of HC for 7 days, NK cells purity of each group reached 70.72%~76.39%, and it was not significantly different with that in control group [(72.61±3.76)%]. The proliferation folds of NK cells treated with 10-6, 10-5, 10-4, 10-3μmol/L HC were (9.13±0.94), (9.67±1.51), (10.33±1.07), (8.40±1.47) times, respectively, while it was (4.23±0.82) times in control group (allP<0.01). The killing effects of NK cells on SW1990 cells were (58.58±4.89)%, (62.27±5.63)%, (64.02±5.79)%, (63.88±3.61)%, which were higher than that in control group [(57.46±5.11)%], moreover, the difference between NK cells of 10-4μmol/L HC treatment group and control group was statistically significant(P<0.05). The expressions of perforins of 10-4, 10-3μmol/L HC treatment group were (96.71±3.04)%, (97.56±2.18)%, which were significantly higher than that in control group [(92.40±3.53)%,P<0.05 or 0.01]. The expression of granzyme B in 10-5μmol/L HC treatment group was (78.23±2.94)%, which were significantly higher than that in control group [(73.68±3.52)%,P<0.05]. The expressions of IFN-γ in 10-5, 10-4, 10-3μmol/L HC treatment group were (96.61±2.04)%, (97.58±2.17)%, (98.00±1.77)%, which were significantly higher than that in control group [(92.44±2.74)%,P<0.01].ConclusionsHC can promote IL-15 activated NK cells proliferation and enhance NK cells mediated killing activity against SW1990 cells with proper concentration, and up-regulation of perforin, granzyme B and IFN-γ expression may be the main mechanisms.
Hydrocortisone; Killer cell, natural; Pancreatic neoplasms; Cell proliferation; Killing activity
2013-03-20)
(本文编辑:吕芳萍)
10.3760/cma.j.issn.1674-1935.2013.03.009
221002 江苏徐州,徐州医学院附属医院消化内科(薛成俊、费素娟);南通大学附属建湖医院消化内科(薛成俊);解放军第97医院中心实验室(周忠海、陈复兴、吕小婷、李莹)
费素娟,Email: feisj1031@yahoo.com.cn

