生长相关蛋白-43在内侧颞叶癫痫小鼠模型海马中的表达
吴晓峰,沙龙泽,沙志强,沈 岩,许 琪
中国医学科学院基础医学研究所 北京协和医学院基础学院 生物化学与分子生物学系医学分子生物学国家重点实验室,北京100005
内侧颞叶癫痫(mesial temporal lobe epilepsy,MTLE)是最常见的癫痫综合征之一,约占所有癫痫患者的40%左右[1],也是最常见的成年人药物难治性癫痫[2]。海马硬化是MTLE的标志性病理改变,出现率约为70%[3],大多数该病患者仅依靠服用传统抗癫痫药物难以取得良好的抗癫痫效果,因此患者常需要通过手术切除硬化的海马组织才能够达到抑制癫痫发作的目的。典型的海马硬化包括CA1与CA3区神经元的大量丢失,齿状回区颗粒细胞散布,并伴随星形胶质细胞增生和苔藓样纤维出牙[4]。硬化的海马组织是产生异常癫痫放电的常见病灶,但关于海马硬化的具体分子机制目前尚不清楚,因此探索硬化海马中潜在致病分子的表达模式变化对于探究MTLE的机制具有提示意义。
生长相关蛋白-43(growth-associated protein 43,GAP-43)是一种神经元特异性的胞膜磷脂蛋白,在神经元中广泛表达,可促进神经元的生长、发育、神经再生及突触重建[5]。细胞内钙信号依赖的蛋白激酶C(protein kinase C,PKC)介导的GAP-43 41位丝氨酸的磷酸化修饰会影响GAP-43与钙调蛋白 (calmodulin,CaM)结合的稳定性[6-7],导致CaM的释放,而后者作为多种酶的激活剂可影响轴突生长和神经递质释放。GAP-43作为苔藓样纤维出芽的标志物之一,以往在多种癫痫动物模型的研究中被发现,伴随癫痫发作被点燃后海马苔藓纤维出芽的同时,GAP-43表达上调明显[8],提示该蛋白可能与MTLE发病相关。本研究观察了癫痫发生不同时期GAP-43及其磷酸化形式 (p-GAP-43)在海马齿状回中表达的时空分布情况,初步探讨了该蛋白与内侧颞叶癫痫可能的关系。
材料和方法
材料健康成年C57BL/6雄性小鼠30只 (北京维通利华有限公司),体重18~25 g,SPF级、24 h明暗各半条件饲养;0.5 μl微量进样器 (Micro liter syringes,上海高鸽工贸有限公司);10%水合氯醛 (北京协和医院);单臂脑力体定位仪、微型手持式颅钻(深圳瑞沃德生命科技有限公司);海人酸 (kainic acid,KA)(k0250,中国Sigma公司),工作浓度4 mg/ml,注射200 ng(溶于0.5 μl PBS);GAP-43抗体 (8934S,美国Cell signaling公司);p-GAP-43抗体 (H1111,美国Santa Cruz Biotechnology公司);兔超敏二步法检测试剂盒 (PV-9001,北京中杉金桥公司)。
动物模型的建立将成年C57BL/6雄性小鼠分为生理盐水注射组、注射KA诱导的潜伏期与慢性期MTLE组,以前卤为坐标原点,定位前囟后 (A)2.0 mm、中线旁 (L)1.8 mm、颅骨下 (V)2.3 mm进行海马右侧单侧注射 (急性期模型注射7 ng KA,慢性期模型注射200 ng KA),注射后分别以行为学观察、病理学和脑电图检测结果作为指标衡量模型建立成功与否。建模常规步骤如下:(1)麻醉:用10%水合氯醛腹腔注射C57BL/6小鼠,体重为20 g的小鼠注射100 μl,每增重5 g需额外注射20 μl。注射后约10 min小鼠失去肢体运动能力,且心率正常的可以进行下一步手术操作。(2)固定:麻醉成功后,将小鼠置于立体定位仪上,将门齿固定于前端门齿钳上,双侧耳杆插入小鼠耳朵从两侧固定小鼠,同时调整双侧耳杆水平坐标,使小鼠在左右方位上处于正中央。调整门齿沟平面,使其与耳间线处于一个平面上,保证小鼠呼吸畅通,心跳节律正常。(3)暴露头骨:用解剖剪减去小鼠头部毛发,暴露出头矢状线旁各1 cm的皮肤,用75%酒精消毒暴露的头皮。沿矢状线剪开2 cm皮肤,暴露颅骨,可见前卤点位置,用手术刀在前卤点向两侧刮开骨膜约5 mm。(4)定位:把装有50 nl(PBS中溶有7ng或200ng KA)KA的微量注射器固定于立体定位仪上,使其针尖位于前卤点后2.0 mm(anteroposterior,AP=2.0 mm),矢状线旁向右1.8 mm(mediolateral,ML=1.8 mm),用彩笔笔尖标记。 (5)注射:用手持式电动微型颅钻在标记点为开颅点钻孔,不伤害颅骨下的脑组织。将微量注射器缓慢进针,深度为2.3 mm(dorsoventral,DV=2.3 mm)。经前期注射染料验证,此深度可以将50 nl的液体注射至海马CA1区。在2 min内将50 nl的药物完全注射至海马内,注射后留针约2 min以防止注射液倒流,最后缓慢拔出注射器。(6)关颅:查无活动性出血后,涂抹青霉素软膏,缝合小鼠头部皮肤。将小鼠放置温度为37℃的热板中,使小鼠缓慢恢复。
GAP-43和p-GAP-43表达情况的检测将正常对照小鼠与不同时期模型鼠的海马组织经4%甲醛浸泡48 h,逐级进行脱水、透明、浸蜡和石蜡包埋,切片后进行免疫组织化学检测。注射KA后5d处死小鼠,取其注射侧海马提取蛋白进行Western blot检测。
免疫组织化学检测:4%多聚甲醛常规灌注固定后制作成组织蜡块,随后切片、贴片;脱蜡至水;进行Tris-柠檬酸高温高压热抗原修复3 min,立刻停止后将切片在缓冲液中逐步降至室温;加入配好的0.3%过氧化氢溶液30 min,以消除内源性过氧化物酶的影响,0.01 mol/L PBS清洗 (5 min×3次);加入配好的0.3%Triton X100室温30 min,以增加细胞的通透性,0.01 mol/L PBS(5 min×3次);加入3%BSA室温封闭1 h;加入用1%BSA稀释的一抗,4℃孵育过夜或室温孵育1 h,0.01 mol/L PBS清洗 (5 min×3次);加入用1%BSA稀释的的二抗,室温孵育1 h。0.01 mol/L PBS洗 (5 min×3次);加入显色液DAB,进行免疫组织化学显色,待细胞达到最大反应时吸去显色液,用蒸馏水迅速冲3次;梯度酒精脱水之后,封片,拍照。
SDS-PAGE电泳及Western blot分析:将蛋白质从SDS-PAGE凝胶转移至硝酸纤维素膜,常规配置转移缓冲液 (pH 8.3),冰浴下100V转膜1 h;将转膜后的硝酸纤维素膜置于TBST缓冲液中冲洗1次,将膜转入5%脱脂奶粉的封闭液中封闭硝酸纤维素膜上的免疫球蛋白结合位点,室温封闭30 min;加入用封闭液稀释至工作浓度的第一抗体溶液,室温赋予1 h或4℃过夜,之后置于TBST缓冲液中洗3次,5~10 min/次;加入用封闭液稀释的第二抗体溶液,室温孵育1 h,TBST缓冲液洗3次,5 min/次;通过ECL-X光片曝光方法显影。
统计学处理Western Blot与免疫组织化学结果采用ImageJ 1.42q软件进行灰度值分析,并采用Prism 5(5.01版本)软件进行统计分析,将对照组平均灰度值定位1,计算出实验组平均灰度值相对于对照组的变化倍数或百分比,组间差异分析采用t检验,P<0.05为差异有统计学意义。
结 果
GAP-43在癫痫发生不同时期的空间分布GAP-43在正常对照小鼠及MTLE模型鼠海马齿状回、门区和齿状回内分子层 (inner molecular layer,IML)区域均有表达,MTLE潜伏期 (5d)与慢性期 (2周)海马注射侧表达量变化的空间分布无显著差异 (图1)。
p-GAP-43在癫痫发生不同时期的表达p-GAP-43在正常海马中的空间分布与GAP-43相似,主要定位于颗粒细胞的胞质及细胞膜上。与正常对照组相比,p-GAP-43蛋白表达水平在KA注射后第5天有所下降,在注射后第14天进一步降低,且齿状回颗粒细胞散布明显 (图1)。p-GAP-43在KA注射后第5天与对照组相比下调约30%,在KA注射后第14天表达下调70%左右 (图2)。对注射侧海马内p-GAP-43表达的进一步检测结果显示,与正常小鼠相比,注射后第5天海马内p-GAP-43蛋白水平下调约50%(图3)。
KA注射后第35天,模型小鼠的颗粒细胞散布进一步扩大,癫痫发作频率也随之升高。在MTLE模型鼠慢性期第5周取海马组织进行免疫组织化学检测,结果显示p-GAP-43在正常对照小鼠海马齿状回表达较高,在注射KA对侧的海马齿状回表达则明显下调;与对照组和注射对侧DG区相比,注射KA侧p-GAP-43表达显著下降。在正常小鼠海马齿状回颗粒细胞的胞膜与胞质中,p-GAP-43均有表达,尤以胞膜中染色较强,注射后第5天时染色明显变浅,至注射后第2周时在胞膜中已几乎不见表达 (图4)。

图1 GAP-43与p-GAP-43在MTLE模型鼠5d、2周时间点海马齿状回中的表达分布Fig 1 Immunostaining of GAP-43 and p-GAP-43 in the dentate gyrus of MTLE mouse model 5 days and 2 weeks after KA injection
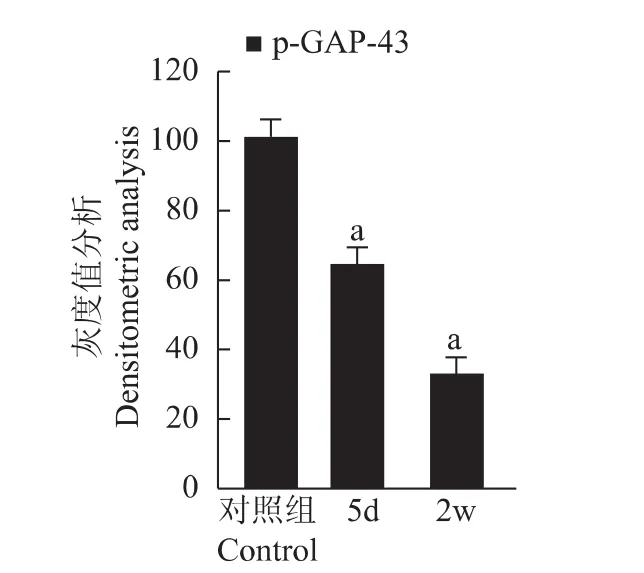
图2 p-GAP-43在MTLE模型鼠5 d与2w时间点注射侧海马齿状回中的免疫组织化学染色强度分析 (n=3)Fig 2 Immunoreactivity of p-GAP-43 in the dentate gyrus of KA injected hippocampus 5 days and 2 weeks after KA injection(n=3)

图3 KA注射5d后 (潜伏期),注射侧海马内p-GAP-43表达量下调 (n=3)Fig 3 Decreased expression levels of p-GAP-43 5 days after KA injection(n=3)
讨 论
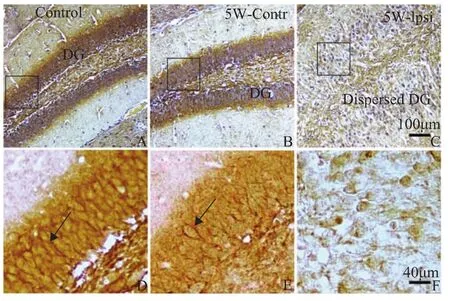
图4 p-GAP-43在MTLE模型鼠5周时间点海马齿状回中的表达变化Fig 4 Immunostaining of p-GAP-43 in the dentate gyrus of MTLE mouse model 5 weeks after KA injection
GAP-43作为神经系统发育和轴突再生的关键因子,广泛参与神经纤维的生长、分化,突触的维持,神经递质的释放和神经组织的异常芽生。GAP-43被认为在引导轴突生长和调节轴突形成新的联系上发挥关键作用,并参与轴突损伤后的再生过程[5]。该蛋白在神经轴突生长和突触形成时期十分活跃[9],不过在大多数神经元中,当生长轴突接触到合适的目标后,转运到生长锥中的GAP-43数量减少,继而生长锥会转变为突触前成分[10]。本研究结果显示,GAP-43在正常对照小鼠及MTLE模型鼠海马齿状回、门区和齿状回IML区域均有表达,p-GAP-43在此区域的染色模式与GAP-43相近不过表达量下调,而MTLE中异常神经环路的建立可能依赖于突触网络的重塑,由此推测GAP-43在齿状回区域的高表达可能通过参与突触重塑过程进而影响到MTLE异常放电环路的建立。以往研究报道,GAP-43在成年大鼠海马中的表达升高可能是由于该组织中突触结构可塑性处于高位[11]。Tolner等[12]采用电刺激和KA注射诱导大鼠的癫痫持续状态,24h后检测GAP-43在海马区的表达分布,结果发现IML区域GAP-43的表达下调可能与门区神经元的丢失相关。在癫痫动物模型中的研究发现,投射到海马IML区的门区神经细胞丢失与苔藓样纤维出芽可能存在着密切的关系[13-14]。在本研究建立的模型中亦成功验证了MTLE苔藓样纤维出芽和CA区神经元丢失这两大标志性病理改变。
本研究采用KA诱导的颞叶癫痫模型小鼠,在癫痫发生潜伏期和慢性期的代表性时间点,即KA注射后的第5天 (潜伏期)、第14天及第5周 (慢性期),检测了海马内p-GAP-43的表达水平和分布,结果显示,p-GAP-43在硬化海马中的齿状回颗粒细胞中逐步下调,推测可能与硬化海马内的神经环路重建相关。GAP-43作为PKC和Ⅱ型酪蛋白激酶(casein kinaseⅡ,CKⅡ)的磷酸化作用底物,其中CKⅡ可对GAP-43的191/192位丝氨酸位点和88/89位苏氨酸位点等多个位点进行磷酸化,而PKC则被实验证明仅磷酸化GAP-43的41位丝氨酸[15]。非磷酸化的GAP-43可通过1个“IQ”模体与钙调蛋白结合,而在其41位丝氨酸被磷酸化后与钙调蛋白的结合则被抑制。Caprini等[16]采用表达克隆的方法研究了人后根神经节胞内钙离子的浓度,结果发现GAP-43能增加胞内钙离子浓度,抑制PKC的活动能消除由GAP-43诱导的细胞内钙离子浓度的提高,而细胞内钙离子浓度升高通常被认为是癫痫鼠模型中神经细胞凋亡的启动因素,可能对诱导癫痫的发作起到促进作用。另一方面,在生长锥中磷酸化的GAP-43高表达区域有较强黏附靶标细胞的活性,而非磷酸的GAP-43 则定位于相应功能较弱区域[17]。He等[18]研究发现,此种差异可能是由GAP-43对肌动蛋白丝的调节而实现的,并且这种调节功能与其本身41位丝氨酸被磷酸化水平相关。因此,p-GAP-43在MTLE潜伏期与慢性期的齿状回颗粒细胞中的显著下调可能影响突触的形成,进而参与到硬化海马中异常神经环路的建立过程。
综上,本研究结果显示,在MTLE模型小鼠的潜伏期与慢性期,磷酸化的GAP-43随着癫痫发生时间的推移而下调可能通过影响轴突骨架的稳定和轴突的靶向生长而参与到硬化海马的突触重组过程,为癫痫发生过程中异常神经环路的建立提供有利条件。
[1]Engel J.Mesial temporal lobe epilepsy:what have we learned[J].Neuroscientist,2001,7(4):340-352.
[2]Lee YJ,Kang HC,Bae SJ,et al.Comparison of temporal lobectomies of children and adults with intractable temporal lobe epilepsy [J].Childs Nerv Syst,2010,26(2):177-183.
[3]Souza BD,Miyamoto A,Weinmaster G.The many facets of Notch ligands[J].Oncogene,2008,27(228):5148-5167.
[4]Tien AC,Rajan A,Bellen HJ.A Notch updated [J].J Cell Biol,2009,184(5):621-629.
[5]Benowitz LI,Routtenberg A.A membrance phosphoprotein associated with neural development,axonal regeneration,phospholipid metabolism,and synaptic plasticity[J].Trends Neurosci,1987,10(12):527-532.
[6]Dekker LV,Parker PJ.Regulated binding of the protein kinase C substrate GAP-43 to the V0/C2 region of protein kinase C-δ [J].J Biol Chem,1997,272(19):12747-12753.
[7]Chapman ER,Au D,Alexander KA,et al.Characterization of the calmodulin binding domain of neuromodulin functional significance of serine 41 and phenylalanine 42 [J].J Biol Chem,1991,266(1):207-213.
[8]Mosevitsky MI,Konovalova ES,Bichevava NK.Enhanced level of site specific proteolysis of gap-43 protein during early stages of brain development[J].Biochemistry,2000,65(10):1153-1156.
[9]Shibley H,Smith BN.Pilocarpine-induced status epilepticus resuhs in mossy fibersprouting and spontaneous seizures in C57BL/6 and CD-1 mice [J].Epilepsy Res,2002,49(2):109-120.
[10]Casoli T,Spagna C,Fattoretti P,et al.Neuronal plasticity in aging:a quantitative immunohistochemical study of GAP-43 distribution in discrete regions of the rat brain [J].Brain Res,1996,714(1-2):111-117.
[11]Dani JW,Armstrong DM,Benowitz LI.Mapping the development of the rat brain by GAP-43 immunocytochemistry [J].Neuroscience,1991,40(1):277-287.
[12]Tolner EA,van Vliet EA,Holtmaat AJ,et al.GAP-43 mRNA andprotein expression in the hippocampal and parahippocampal region during the course of epileptogenesis in rats[J].Eur J Neurosci,2003,17(11):2369-2380.
[13]Babb TL,Kupfer WR,Pretorius JK,et al.Synaptic reorganization by mossy fibers in human epileptic fascia dentata[J].Neuroscience,1991,42(2):351-363.
[14]Longo BM,Covolan L,Chadi G,et al.Sprouting of mossy fibers and the vacating of post-synaptic targets in the inner molecular layer of the dentate gyrus [J].Exp Neurol,2003,181(1):57-67.
[15]Dokas LA,Ting S,Edgar MA,et al.Regulation of in vitro phosphorylation of the casein kinaseⅡsites in B-50(GAP-43)[J].Brain Res,1998,781(1-2):320-328.
[16]Caprini M,Gomis A,Cabedo H,et a1.GAP-43 stimulates inositol trisphosphate mediated calcium release in response to hypotonicity [J].EMBO J,2003,22(12):3004-3014.
[17]Dent EW,Meiri KF.GAP-43 phosphorylation is dynamically reg-ulated in individual growth cones [J].J Neurobiol,1992,23(8):1037-1053.
[18]He Q,Dent EW,Meiri KF.Modulation of actin filament behavior by GAP-43(Neuromodulin)is dependent on the phosphorylation status of serine 41,the protein kinase C site[J].J Neurosci,1997,17(10):3515-3524.

