人脐静脉内皮细胞水通道蛋白9磷酸化与砷耐受性的关系
曹亦菲,谭晓华,黄仙红,何 平,连福治,邓卢翠,杨 磊
(杭州师范大学健康管理学院预防医学教研室,浙江杭州 310036)
砷是自然界中常见的毒物之一,同时砷作为药物在多种肿瘤的临床治疗上有显著疗效,研究机体的砷耐受机制对于砷中毒的预防和解决临床耐药问题均有重要意义。阻止砷进入细胞是其发挥毒性的第一个关键步骤,而在哺乳动物中砷的这种入胞机制至今没有得到完全阐明。水通道蛋白9(aquaporin9,AQP9)是膜主体内在蛋白家族中的一员,定位于细胞膜上,作为通道蛋白参与细胞内外液体的转运[1]。研究发现,AQP9在调节细胞内砷的含量中发挥重要作用[2-4],在小鼠肝细胞和人肺癌细胞中 AQP9 参与细胞砷的摄入[5-7]。Thorsen 等[8]发现,p38的酵母同源物Hog1p通过降低AQP9/AQP7/AQP3同源类似物Fps1p的磷酸化水平增加其对砷的抗性,Fps1 p的磷酸化可能是酵母中一个非常重要的砷耐受性调控机制,而且其磷酸化部分受Hog1p的调控。这些研究提示AQP9在酵母细胞砷摄入中的活性可能与其磷酸化水平有直接关系。但在哺乳动物中是否存在类似机制,即由p38等调节AQP9磷酸化还不清楚。在多发性骨髓瘤细胞中抑制p38的活性能提高As2O3的细胞毒性[9]。最近研究发现,在人和小鼠的中性粒细胞中AQP9的磷酸化能调节其膜定位,而且可能被依赖于 Rac-1的信号通路所调控[10]。AQP9磷酸化调节细胞对砷的摄入需要进一步研究。本研究以哺乳动物细胞株ECV-304及其经低浓度砷诱导的抗砷性ECV-304(AsRE)细胞株为模型,分析这两种对砷耐受性有明显差异的细胞中AQP9 mRNA、蛋白表达及其磷酸化水平的差异,并探讨p38对AQP9磷酸化的影响。
1 材料与方法
1.1 细胞株
ECV-304细胞株,本实验室冷冻保存;AsRE,由本实验室前期低浓度砷诱导获得[11]。
1.2 试剂与仪器
NaAsO2,购自美国 Sigma公司;RPM1640培养基,胎牛血清和RNA抽提液购自美国Gibco公司;CCK-8试剂盒,蛋白A/G凝胶,购自碧云天生物技术研究所,cDNA逆转录试剂盒和 SYBR Green荧光定量PCR试剂盒,购自日本TaKaRa公司;鼠抗人AQP9抗体和鼠抗人β肌动蛋白抗体,购自Santa Crluz公司,兔抗人p38抗体,鼠抗人p38磷酸化抗体和鼠抗泛磷酸化抗体购自Abcam公司;ECL化学发光试剂盒,购自Amersham Bioscience公司。酶标仪,半干转转膜仪和蛋白电泳仪,为美国Bio-Rad公司产品;7300型实时荧光定量PCR(RT-PCR)仪,为美国ABI公司产品;电感耦合等离子体质谱仪(ICP-MS,HP4500),为日本Yokogawa Analytical Systems公司产品。
1.3 细胞培养
AsRE和ECV-304细胞株培养于RPM1640培养基(含10%胎牛血清,青霉素和链霉素100 ku·L-1)中,放置于37℃,5%CO2饱和湿度培养箱中,取对数生长期细胞进行实验。
1.4 CCK8法检测细胞生存率
取ECV-304和AsRE对数生长期细胞分别用含 NaAsO22.5,5,10,20 和 40 μmol·L-1的培养基接种于96孔板内培养,另设正常对照组。实验重复5 次。每孔密度约5 ×104L-1,总体积150 μl,培养24 h后每孔加入15 μl WST-8工作液,37℃继续培养1 h后在酶标仪上采用波长450 nm比色,根据各孔吸光度值,计算 IC50值,并绘制生存率曲线。
1.5 电感耦合等离子体质谱法测定细胞内砷含量
NaAsO22.5,5,10,20 和 40 μmol·L-1处理细胞2 h后,PBS洗涤细胞,然后溶于HNO3中,采用电感耦合等离子体质谱仪(ICP-MS)法测定细胞内砷含量。
1.6 实时荧光定量PCR法检测AQP9mRNA表达
用含NaAsO22.5,5,10和20 μmol·L-1的培养基处理对数生长期的细胞,设不加药作为正常对照组,2 h后收集细胞。采用标准的Trizol-氯仿一步法抽取总RNA并测定浓度,逆转录为cDNA,在实时定量PCR中作为模板。采用SYBR GreenⅠ荧光染料嵌合法在ABI 7300定量PCR仪上进行。管家基因 β肌动蛋白引物序列为正向:5'-TGGCACCCAGCAATGAA-3', 反 向:5'-CTAAGTCATAGTCCACCTAGAAGCA-3';目的基因 AQP9的引物为正向:5'-ACTCAGTGTCATCATGTAGTGG-3', 反 向:5'-CACCTCAGGCTTACAAGAACA-3'。PCR 反应 体系 为:SYBR Premix Dimer-Eraser(2 × conc.)10 μl;0.8 μl 正 反 向 引 物100 μmol·L-1;RT 产 物 1 μl,加 ddH2O 至 20 μl。反应条件:95℃30 s 1个循环;95℃5 s,60℃31 s 40个循环;95℃ 15 s,60℃ 60 s,95℃ 15 s 1个循环。所得 Ct值通过 2-ΔΔCt法计算相对表达量[12]。
1.7 Western印迹法检测AQP9和p38蛋白表达
用 NaAsO22.5,5,10 和20 μmol·L-1的培养基处理对数生长期的细胞,同时设正常对照组,2 h后加入裂解液,超声匀浆后提取总蛋白,SDS-PAGE电泳后转移至硝酸纤维素膜,用含5%牛血清白蛋白的封闭液封闭过夜,PBST溶液(磷酸盐缓冲液+聚山梨酯-20)洗膜3次,每次10 min;加入一抗(稀释浓度1∶500)孵育2 h或4℃过夜,再洗膜3次,加入辣根过氧化物酶标记的二抗(稀释浓度1∶2000)室温下孵育1 h,洗膜3次后ECL发光显影,凝胶成像系统拍照进行条带分析。以目标蛋白积分吸光度与内参β肌动蛋白分吸光度比值,表示蛋白的相对表达量。
1.8 免疫沉淀法检测AQP9 mRNA蛋白磷酸化水平
收集相应处理后的细胞,裂解提取得到蛋白后加入充分重悬的蛋白A/G凝胶,4℃缓慢摇动1 h。离心后取上清,加入2 μg抗AQP9,4℃缓慢摇动过夜。继续加入40 μl充分重悬的蛋白A/G凝胶,4℃摇动3 h,然后离心吸除上清,PBS洗涤3次,加入适量SDS-PAGE电泳上样缓冲液重悬。后续实验同Western印迹分析,一抗为鼠抗泛磷酸化抗体。
1.9 过量表达AQP9后细胞内砷含量的测定
将AQP9全长序列克隆进入真核表达载体pcDNA3.1,得到 pcDNA3.1-AQP9 质粒,将其与pcDNA3.1空载体通过脂质体2000分别转染进入AsRE和ECV304细胞,经Western印迹法确定转染成功后,细胞用 NaASO28 μmol·L-1处理2,4,6,8,10和12 h后,采用1.5方法检测细胞内砷含量。
1.10 统计学分析
2 结果
2.1 砷在AsRE细胞和ECV-304细胞蓄积速度
图1 CCK-8结果显示,在NaAsO2各浓度下,AsRE细胞的存活率显著高于ECV-304细胞(P<0.05),其 IC50值分别是 12.59 和 4.06 μmol·L-1。说明AsRE对砷的耐受性显著高于ECV-304细胞。

Fig.1 Effect of NaAsO2on survival rate in AsRE and ECV-304 cells.Cells grown in 96-well plates were treated with NaAsO2for 24 h then assessed viability by CCK8 assay.±s,n=4.

Fig.2 Effect of NaAsO2on As accumulation in AsRE and ECV-304 cells.A.AsRE and ECV-304 cells treated with NaAsO2for 2 h.±s,n=5.*P<0.05,compared with ECV-304 cells.B.AsRE and ECV-304 cells treated with NaAsO28 μmo·lL-1.±s,n=3.*P<0.05,**P<0.01,compared with ECV-304 cells.
ICP-MS测定细胞内砷含量,结果显示AsRE和ECV-304细胞株内砷含量都随NaASO2浓度增加而增加(图2A),但相同 NaASO2浓度处理,AsRE细胞内的砷含量显著低于ECV-304细胞内的砷含量(P<0.05)。而用 NaAsO28 μmol·L-1处理ECV-304和AsRE细胞不同时间后,发现AsRE细胞内的砷蓄积与ECV-304细胞相比显著缓慢(P<0.01),而且在处理6 h后砷含量几乎不再增加,ECV-304细胞中砷的含量则随处理时间一直呈增加的趋势(图2B)。提示AsRE细胞对砷的耐受性可能与细胞内砷的蓄积量相关。
2.2 NaAsO2对AsRE细胞中AQP9 mRNA表达的影响
图3 结果显示,NaAsO22.5,5,10 和20 μmol·L-1处理ECV-304和AsRE 2 h后,两细胞中AQP9 mRNA的表达水平都随处理浓度的增加而有所下降,但AsRE细胞中AQP9 mRNA的表达水平下降更为显著(P<0.05)。提示降低AQP9 mRNA的表达水平可能与砷的摄入量降低相关,而且在砷耐受性较高的AsRE细胞中,AQP9表达在不同时间段的不同表现可能与砷摄入含量高度相关。
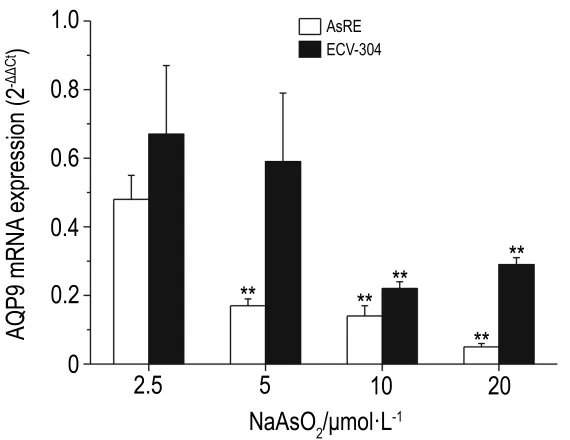
Fig.3 Effect of NaAsO2on AQP9 mRNA levels in AsRE and ECV-304 cells.AsRE and ECV-304 were treated with NaAsO2for 2 h.±s,n=4.**P<0.01,compared with the same cell line treated with NaAsO2.5 μmol·L -1 .2
2.3 NaAsO2对 ECV-304和 AsRE细胞 AQP9 和p38蛋白及其磷酸化表达水平的影响
Western免疫印迹结果显示,在NaAsO2各浓度处理中,AsRE细胞中磷酸化AQP9(p-AQP9)表达均处于较高水平,AQP9蛋白水平随NaAsO2浓度增加而下降;ECV-304细胞中AQP9蛋白水平无明显变化,p-AQP9水平随 NaAsO2浓度增加呈上升趋势,但总体水平均低于AsRE细胞(图4)。处理不同时间,两细胞中AQP9蛋白表达水平均无明显变化,其磷酸化表达水平则随时间增加而增加,AsRE细胞中增加更为显著(图5)。可见磷酸化水平的变化可能与细胞砷耐受性增加相关。AsRE细胞p-AQP9与AQP9表达比值随浓度和时间增加而增加,但p-AQP9水平并未随浓度增加而增加,因此,推测砷刺激导致AQP9磷酸化与未磷酸化水平比例发生变化,从而影响对砷的摄入。
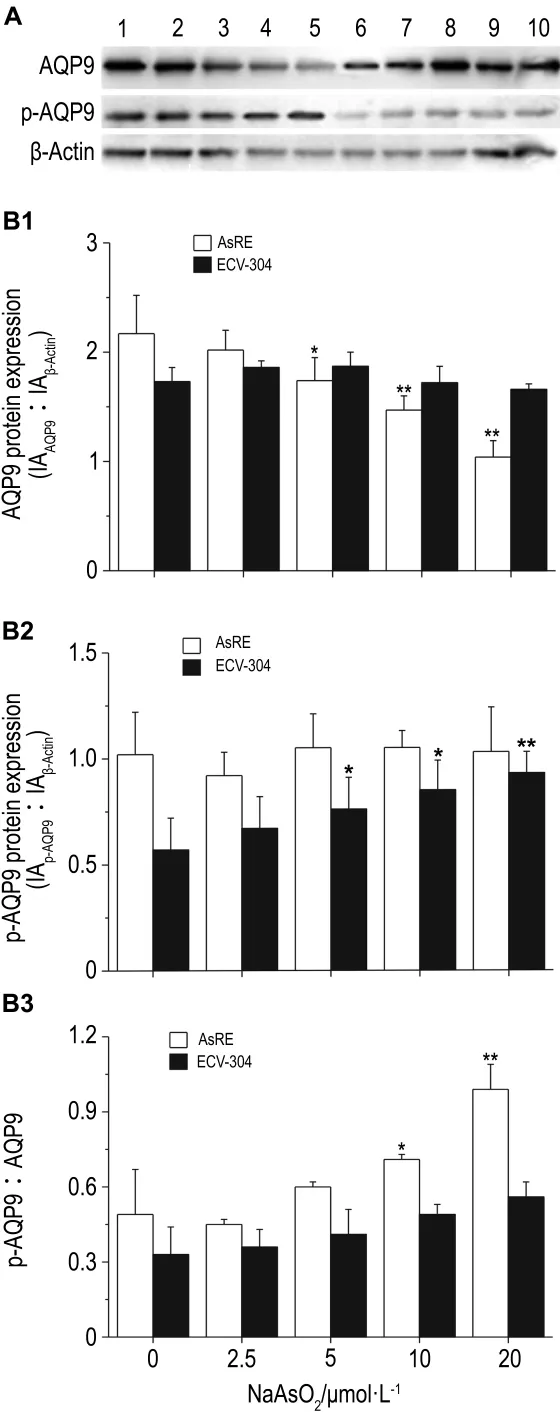
Fig.4 Effect of NaAsO2on protein and phosphorylation levels of AQP9 in AsRE and ECV304 cells by Western blotting.Cells were treated with NaAsO2for 2 h.The bar graph represents the densitometry measurement of the AQP9(B1),phosphorylated AQP9(p-AQP9,B2)to β-actin ratio and the ratio of p-AQP9 to AQP9(B3).A:Lane 1 -5,AsRE cells treated with NaAsO20,2.5,5,10 and 20 μmol·L -1;lanes 6 -10,ECV-304 cells treated with NaAsO20,2.5,5,10 and 20 μmol·L -1 .±s,n=3.*P<0.05,**P<0.01,compared with NaASO20 μmo·lL-1in the same cell line.
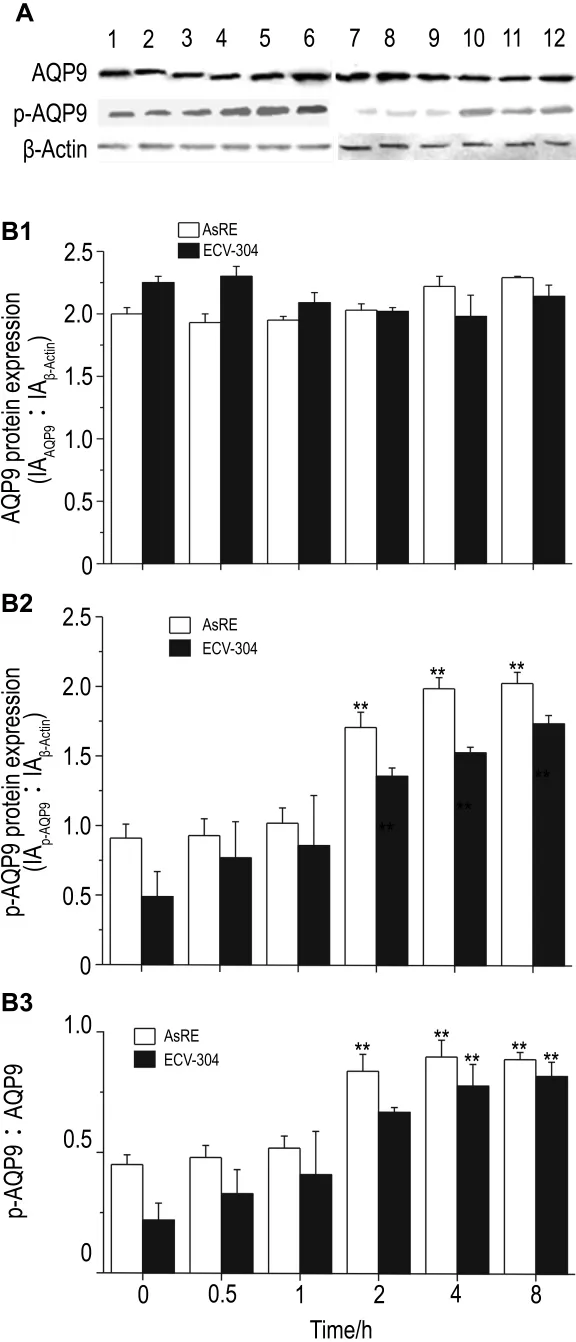
Fig.5 Effect of NaAsO28 μ mol·L -1for 0 -8 h on protein and phosphorylation level of AQP9 in AsRE and ECV-304 cells by Western blotting.The graph represents the densitometry measurement of the AQP9 to β-actin ratio(B1),p-AQP9(B2)to β-actin ratio and the p-AQP9 to AQP9 ratio(B3).A:Lanes 1-5,AsRE cells were cultured with NaAsO2 8 μmol·L -1for 0,0.5,1,2,4 and 8 h;lanes 6 -10,ECV-304 cells were cultured with NaAsO28 μmo·lL-1for 0,0.5,1,2,4 and 8 h.±s,n=3.*P<0.05,**P<0.01,compared with 0 h in the same cell line.
如图 6所示,NaAsO2处理后,AsRE和ECV-304细胞株中p38蛋白表达水平无明显变化。ECV-304细胞中随砷的浓度增加略有增加,磷酸化p38(p-p38)/p38值也同样上升(图6)。不同处理时间结果显示(图7),AsRE和ECV-304细胞中p-p38水平都显著上升,p-p38/p38比值同样显著地增加(P<0.05)。提示在哺乳动物细胞中,p38的磷酸化与AQP9的磷酸化存在一定的联系,但是否起主要作用还需要进一步实验证实。
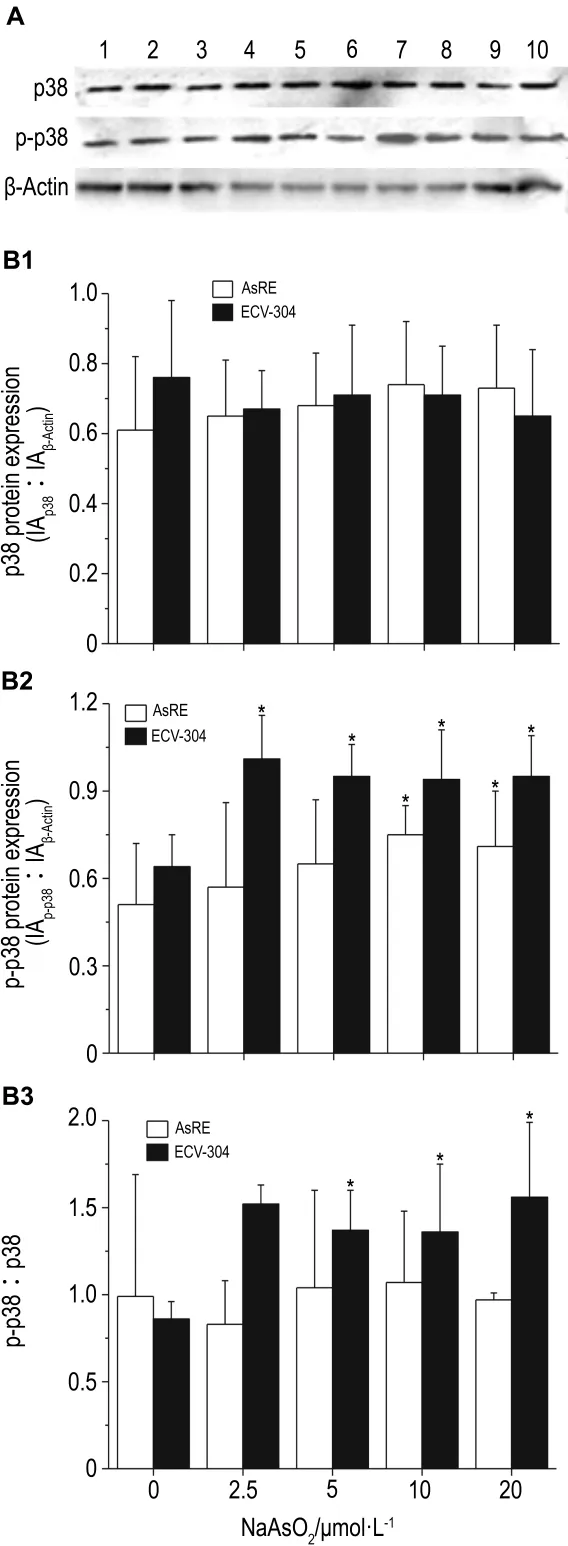
Fig.6 Effect of NaAsO2on protein and phosphorylation levels of p38 in AsRE and ECV304 cells by Western blotting.See Fig.4 for cells treatment.The bar graph represents the densitometry measurement of the p38 of β-actin ratio(B1),phospho-p38(p-p38)to β-actin ratio(B2)and the ratio of p-p38 to p38(B3).A:Lanes 1 -5,NaAsO20,2.5,5,10 and 20 μmol·L -1in AsRE cells;lanes 6 -10,NaAsO20,2.5,5,10 and 20 μmol·L -1in ECV-304 cells.±s,n=3.*P<0.05,compared with NaAsO20 μmol·L -1in same cell line.
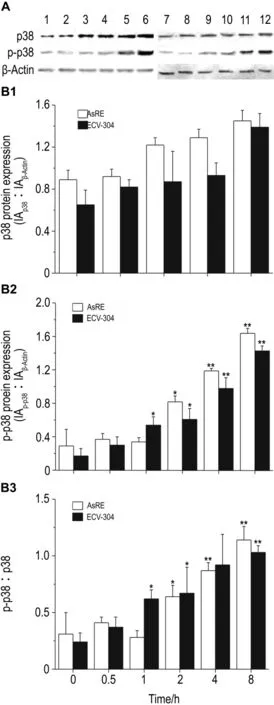
Fig.7 Effect of NaAsO28 μ mol·L -1for 0 -8 h on protein and phosphorylation level of p38 in AsRE and ECV-304 cells by Western blotting.The graph represents the densitometry measurement of the p38 to β-actin ratio(B1),p-p38 to β-actin ratio(B2)and the ratio of p-p38 to p38(B3).A:Lanes 1 -5,AsRE cells were cultured with NaAsO28 μmol·L -1for 0,0.5,1,2,4 and 8 h;lanes 6 -10,ECV-304 cells were cultured with NaAsO28 μmol·L -1for 0,0.5,1,2,4 and 8 h.±s,n=3.*P<0.05,**P<0.01,compared with 0 h in same cell line.
2.4 AQP9过量表达对细胞内砷摄入量的影响
如图8和图9所示,与转染pcDNA3.1空载体的对照相比,转染 AQP9的AsRE细胞(图8)与ECV-304细胞中(图9)砷的摄入量都明显增加,但在NaAsO2同一浓度下,ECV-304细胞中砷的含量均显著高于AsRE细胞(P<0.05)。AsRE细胞在处理后10 h内,砷摄入量与时间基本成线性关系,10~20 h内砷摄入量增加平缓(图8A),而ECV-304细胞内砷摄入量基本随时间增加而增加,没有增加量减缓的趋势(图9)。这些结果提示,AsRE细胞对砷的耐受性可能与其能减缓砷的摄入量有关。

Fig.8 Effect of AQP9 overexpression(A)on As accumulation in AsRE cells(B).A:AsRE cells were transfected with pcDNA3.1 plasmid(lane 1)and pcDNA3.1/AQP9(lane 2)and detected by Western blotting.B:AsRE cells treated with NaAsO28 μmol·L -1for 2,4,6,8,10 and 20 h.±s,n=3.*P<0.05,**P<0.01,compared with AsRE cells transfected with pcDNA3.1 at same time point.
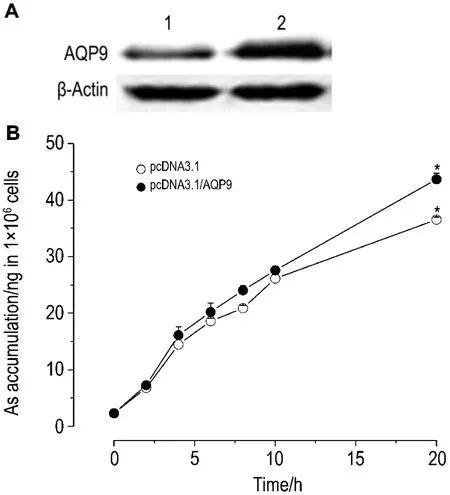
Fig.9 Effect of AQP9 overexpression(A)on As accumulation in ECV-304 cells(B).A:ECV-304 cells were transfected with pcDNA3.1 plasmid(lane 1)and pcDNA3.1/AQP9(lane 2)and detected by Western blotting.B:ECV-304 cells treated with NaAsO2 8 μmo·lL-1for 2,4,6,8,10 and 20 h.±s,n=3.*P<0.05,compared with ECV-304 cells transfected with pcDNA3.1 at the same time point.
3 讨论
进入细胞是砷毒性发挥作用的关键一步,阐明砷的进入细胞机制对于砷的防治或临床应用具有重要意义。自然界中的砷以不同价态形式存在,其中以三价的无机砷毒性最高。起初研究者发现在原核生物中砷的入胞主要依靠磷酸转运器[13-14]。后来发现在真核生物中AQPs家族成员在砷的入胞中发挥通道作用。如酵母中甘油促进蛋白的同源物Fps1p的分布与对 As(III)和 Sb(III)的抗性相关[4,15]。而在哺乳动物中,AQP9 被认为在调节砷的入胞中扮演了重要角色[3-7]。本文研究了水通道蛋白AQP9 mRNA表达水平、蛋白表达及其磷酸化水平与细胞砷抗性之间的关系,并初步探讨了调控AQP9磷酸化的分子。研究发现,AQP9蛋白的磷酸化水平与细胞砷耐受性密切相关,而p38是否调控AQP9磷酸化还需进一步实验证实。前期实验中我们通过低浓度NaAsO2诱导ECV-304细胞,得到一个具有较强砷耐受性的细胞AsRE[11]。本实验中我们首先检测了砷对这两个具有不同耐受性的细胞株的毒性作用,发现经过抗性诱导的AsRE细胞株其存活率显著高于ECV-304细胞株,而且对砷的摄入量显著低于ECV-304细胞。表明经过低浓度砷诱导的细胞确实对砷的耐受性增强。而且AsRE细胞中用砷处理4h后砷摄入量几乎不再增加。Lee等[16]报道,来源于人肺腺瘤细胞株 CL3的砷抗性细胞R15对砷的摄入量也显著低于CL3。这些研究均提示通过抑制砷进入细胞来降低细胞内砷含量是其产生耐受性的原因之一。
许多研究表明,AQP9 mRNA表达水平与细胞对砷的敏感性有关。如急性早幼粒细胞白血病细胞株NB4中AQP9的表达量最高,其对As2O3也最为敏感,而慢性粒细胞白血病细胞株K562中内源AQP9表达量低,对As2O3也最不敏感。如果在K562细胞株中过量表达AQP9,则对As2O3也表现出高度敏感性[17],而且这种敏感性与高水平的砷摄入有关[5]。最近研究发现,在与羊膜细胞相比砷敏感性更高的绒毛膜细胞中AQP9的表达水平也更高[18],说明AQP9的表达与细胞对砷的敏感性相关。本研究也发现,砷耐受性高的AsRE细胞其AQP9 mRNA表达水平随NaAsO2浓度增加明显下调,较为敏感的ECV-304细胞中mRNA表达水平也随浓度有所下降,但下调的幅度没有AsRE细胞大。结合砷的摄入实验,似乎可以看到砷耐受性更高的AsRE细胞有一个砷摄入的饱和阈值,一旦达到此阈值,细胞可能会通过下调AQP9的表达来降低砷的摄入。
有关依赖于AQP9通道蛋白的砷摄入,对于参与的信号蛋白和转录调节因子以及调控机制目前所知甚少。2003年Arima等[19]曾报道p38 MAPK信号分子能调节AQPs的表达。而发现这几者之间关联性最直接的证据是在酵母中p38 MAPK的同源物Hog1p的表达增加能提高细胞的耐受性,同时证实细胞内砷的摄入依赖于AQP9的同源物Fps1p。Hog1p通过自身的磷酸化来调节Fps1p的磷酸化,从而调节细胞对砷的敏感性[8]。本研究发现AQP9的蛋白水平在砷耐受性高的AsRE细胞中随NaAsO2浓度的增加而降低,这与其基因表达水平是一致的,而且其磷酸化表达量维持在一个较高的水平。在ECV-304细胞中,AQP9的蛋白水平随NaAsO2浓度的增加略有增加,但其磷酸化水平随浓度上升而明显上调。这些表明AQP9的磷酸化水平在对砷耐性受不同的细胞中都会有所增加,而AsRE细胞可能是由于此细胞之前就受过低浓度砷的诱导,其磷酸化水平已经达到一个较高的水平,提示在哺乳动物细胞中AQP9的磷酸化与砷的摄入之间也存在一定的关系。最近研究发现,在中性粒细胞中AQP9定位于膜上可能依赖于其磷酸化作用,且可能被依赖于Rac-1的信号通路所调控。因此AQP9的磷酸化可能导致其更多定位于细胞膜上,从而影响了砷的摄入。Rac-1信号因子处于外界刺激所诱导的信号途径的上游,其下游为MAPK激酶,包括 p38蛋白激酶。AsRE细胞中AQP9表达水平无明显变化,而其磷酸化水平增加,推测砷的刺激也导致细胞内AQP9向磷酸化方向转化,未磷酸化水平降低,甚至可能改变其在膜上的分布,因此影响其对砷的摄入,此推论将在后续工作中进行验证。而实验中也发现p38蛋白表达水平在ECV-304和AsRE细胞中表达量几乎没有显著的变化,因此推测p38可能并不是此信号传导途径上调控AQP9磷酸化的主要因子,可能还存在别的蛋白激酶能够导致AQP9的磷酸化水平上调。这与Thoren等的报道是一致的,其研究结果也表示在酵母中p38的同源物Hog1p可能不止是激活AQP9的同源物Fps1p磷酸化的唯一原因。因此寻找此途径中最为关键的调节AQP9磷酸化水平的蛋白因子,也是以后的研究方向。
[1]Verkman AS,Mitra AK.Structure and function of aquaporin water channels[J].Am J Physiol Renal Physiol,2000,278(1):F13-F28.
[2]Agre P,Kozono D.Aquaporin water channels:molecular mechanisms for human diseases[J].FEBS Lett,2003,555(1):72-78.
[3]Liu Z,Carbrey JM,Agre P,Rosen BP.Arsenic trioxide uptake by human and rat aquaglyceroporins[J].Biochem Biophys Res Commun,2004,316(4):1178-1185.
[4]Liu Z,Shen J,Carbrey JM,Mukhopadhyay R,Agre P,Rosen BP.Arsenite transport by mammalian aquaglyceroporins AQP7 and AQP9[J].Proc Natl Acad Sci USA,2002,99(9):6053-6058.
[5]Leung J,Pang A,Yuen WH,Kwong YL,Tse EW.Relationship of expression of aquaglyceroporin 9 with arsenic uptake and sensitivity in leukemia cells[J].Blood,2007,109(2):740-746.
[6]Miao ZF,Chang EE,Tsai FY,Yeh SC,Wu CF,Wu KY,et al.Increased aquaglyceroporin 9 expression disrupts arsenic resistance in human lung cancer cells[J].Toxicol In Vitro,2009,23(2):209-216.
[7]Shinkai Y,Sumi D,Toyama T,Kaji T,Kumagai Y.Role of aquaporin 9 in cellular accumulation of arsenic and its cytotoxicity in primary mouse hepatocytes[J].Toxicol Appl Pharmacol,2009,237(2):232-236.
[8]Thorsen M,Di Y,Tängemo C,Morillas M,Ahmadpour D,Van der Does C,et al.The MAPK Hog1p modulates Fps1p-dependent arsenite uptake and tolerance in yeast[J].Mol Biol Cell,2006,17(10):4400-4410.
[9]Wen J,Cheng HY,Feng Y,Rice L,Liu S,Mo A,et al.P38 MAPK inhibition enhancing ATO-induced cytotoxicity against multiple myeloma cells[J].Br J Haematol,2008,140(2):169-180.
[10]Karlsson T,Glogauer M,Ellen RP,Loitto VM,Magnusson KE,Magalhâes MA.Aquaporin 9 phosphorylation mediates membrane localization and neutrophil polarization[J].J Leukoc Biol,2011,90(5):963-973.
[11]Xian LL,Yang L,Luo X,Ying K,He L,Yu N,et al.Human cell line exhibits arsenic tolerance by long-term low level arsenic-exposure[J].Chin J Endemiol(中国地方病学杂志),2005,24(2):143-145.
[12]Pfaffl MW.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucleic Acids Res,2001,29(9):e45.
[13]Rosenberg H,Gerdes RG,Chegwidden K.Two systems for the uptake of phosphate in Escherichia coli[J].J Bacteriol,1977,131(2):505-511.
[14]Bun-ya M,Shikata K,Nakade S,Yompakdee C,Harashima S,Oshima Y.Two new genes,PHO86 and PHO87,involved in inorganic phosphate uptake in Saccharomyces cerevisiae[J].Curr Genet,1996,29(4):344-351.
[15]Wysocki R,Chéry CC,Wawrzycka D,Van Hulle M,Cornelis R,Thevelein JM,et al.The glycerol channel Fps1p mediates the uptake of arsenite and antimonite in Saccharomyces cerevisiae[J].Mol Microbiol,2001,40(6):1391-1401.
[16]Lee TC,Ho IC,Lu WJ,Huang JD.Enhanced expression of multidrug resistance-associated protein 2 and reduced expression of aquaglyceroporin 3 in an arsenic-resistant human cell line[J].J Biol Chem,2006,281(27):18401-18407.
[17]Bhattacharjee H,Carbrey J,Rosen BP,Mukhopadhyay R.Drug uptake and pharmacological modulation of drug sensitivity in leukemia by AQP9[J].Biochem Biophys Res Commun,2004,322(3):836-841.
[18]Yoshino Y, Yuan B, Kaise T, Takeichi M,Tanaka S,Hirano T,et al.Contribution of aquaporin 9 and multidrug resistance-associated protein 2 to differential sensitivity to arsenite between primary cultured chorion and amnion cells prepared from human fetal membranes[J].Toxicol Appl Pharmacol,2011,257(2):198-208.
[19]Arima H,Yamamoto N,Sobue K,Umenishi F,Tada T,Katsuya H,et al.Hyperosmolar mannitol simulates expression of aquaporins 4 and 9 through a p38 mitogen-activated protein kinase-dependent pathway in rat astrocytes[J].J Biol Chem,2003,278(45):44525-44534.

