艾洛替尼耐药的卵巢癌SKOV3细胞系的建立及其耐药特性
赵 青,任志广,贾砚寒,魏寅祥,李新颖,黎 燕,李亚里,彭 晖
(1.军事医学科学院基础医学研究所免疫学研究室,北京 100850;2.南开大学医学院,天津 300071;3.解放军总医院妇产科,北京 100853)
最新一项世界范围内肿瘤发病统计中,在女性生殖器官恶性肿瘤中,卵巢癌发病率居第三位,病死率高居第一[1]。使用一线化疗方案紫杉醇联合铂类药物(TP方案)后的绝大多数卵巢癌患者,最终肿瘤复发并导致耐药,中位生存期仅18个月[2]。随着人们对肿瘤标志物的不懈研究,靶向治疗让人们充满期待。表皮生长因子受体(epidermal growth factor receptor,EGFR)是目前肿瘤治疗中非常有潜力的靶点。研究表明,其过表达与包括卵巢癌、结肠癌、头颈癌、肺癌及胰腺癌在内的多种癌症的预后不良有关[2]。有报道称,EGFR在卵巢癌中阳性率为35%~70%[3]。
艾洛替尼(erlotinib,Erl)作为第二个被FDA批准的靶向EGFR的小分子抑制剂,已在非小细胞肺癌的治疗中取得不俗的成绩。在美国临床试验官方登记网站上显示,其在卵巢癌的最新的临床试验也处于第三期的阶段[4]。在一项Erl单药临床试验中,药物反应率达到6%,而病情稳定率为44%[5]。另外一项与紫杉醇和卡铂的联合用药的临床二期试验中,卵巢癌Ⅲ,Ⅳ期患者中术后化疗药与Erl联合使用完全有效率为29%,术前行新辅助化疗的患者使用联合方案的完全缓解率为11%[6]。Erl在卵巢癌的临床应用前景令人期待。其单药或联合其他化疗药物或靶向药物的临床研究仍在进行中,以EGFR为主的靶向治疗也成为了最有希望的卵巢癌治疗途径之一。但不得不令人们关注的另一个事实是,尽管第一代酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)吉非替尼和Erl已经成功用于临床的EGFR靶向治疗,其有效率高达70%~80%,中位生存期为20~30个月。但在治疗的1年内最终仍会出现TKI耐药导致肿瘤恶性发展[7]。Erl在卵巢癌的靶向治疗中也可能存在着类似的问题,本研究通过建立Erl诱导的卵巢癌耐药株,来探讨此类药物在未来卵巢癌靶向治疗的可行性与疗效,进而为其可能产生耐药的机制提供理论依据。
1 材料与方法
1.1 药物、试剂和仪器
Erl,购自百灵威公司,由二甲亚砜(DMSO)配置成10 mmol·L-1储备液。紫杉醇注射液、注射用硫酸长春新碱(vincristine)与甲氨蝶呤(methotrexate),购自浙江海正药业;顺铂(cisplatin)注射液,购自齐鲁制药有限公司;注射用盐酸米托蒽醌(mitoxantrone)与注射用盐酸拓扑替康(topotecan),分别购自江苏豪森药业和黄石飞云制药公司;注射用盐酸表柔比星(epirubicin),氟尿嘧啶(fluorouracil)分别购自辉瑞制药及金耀氨基酸有限公司。PE荧光标记的流式抗人CD243(ABCB1)-PE抗体,抗人 CD338(ABCG2)-PE抗体、抗人TLR4-PE抗体均购自 eBioscience;抗人 MRP1-FITC购自BD公司。HRP标记的山羊抗小鼠IgG二抗,购自北京中杉金桥公司;GAPDH鼠源单抗,购自美国 California Bioscience公司;EGFR,p-EGFR,ERK,p-ERK,ErbB2,p-ErbB2兔源多克隆抗体均购自Cell Signal Technology。ECL显色试剂盒购自Amersham LifeScience公司;BCA蛋白定量试剂盒,购自Thermo公司;胎牛血清,购自北京元亨金马公司;Hyclone DMEM(高糖)培养基,为塞默菲世尔公司产品;胰蛋白酶、磺酰罗丹明B、脂多糖,购自美国 Sigma-Aldrich公司;FACS Calibur型流式细胞仪,为美国 BD公司产品;5417R型小型台式冷冻离心机,为Eppendorf公司产品;1420 VICTOR3型荧光分光光度计,为PerkinElmer公司产品;倒置显微镜,为Olympus公司产品;Forma SeriesⅡ型细胞培养箱,为Thermo公司产品;超净工作台,为北京昌平长城空气净化设备工程公司产品;蛋白电泳仪与电转仪,为Bio-Rad公司产品。
1.2 艾洛替尼诱导的SKOV3/Erl耐药细胞系的建立
人浆液性卵巢癌细胞系SKOV3由本实验室保存培养,高糖DMEM完全培养基中含10%胎牛血清及青霉素100 kU·L-1和链霉素100 kU·L-1置于37℃恒温孵箱培养,CO2浓度保持在5% 。采用程国钧[8-9]等介绍的逐步递增联合大剂量冲击法诱导细胞。具体方法为:取对数生长期的SKOV3细胞,从 Erl 1 μmol·L-1开始处理,细胞生长状态稳定后逐步增加Erl的浓度,反复换液传代,Erl依次为2,4,8,16 和 25 μmol·L-1,最 终 维 持 浓 度 为10 μmol·L-1,前期诱导历经10个月,传代20次以上,耐药性能够稳定维持在2~3倍。
1.3 磺酰罗丹明B染色法检测SKOV3/Erl细胞的耐药倍数
取对数生长期的SKOV3和SKOV3/Erl细胞,制备单细胞悬液加入96孔板中,每孔细胞数为5000个,培养24 h后,分别加入终浓度为0,0.78,1.56,3.13,6.25,12.5,25 和 50 μmol·L-1的Erl,继续培养72 h检测药物对细胞的杀伤作用。紫杉醇、米托蒽醌、表柔比星、拓扑替康、长春新碱和甲氨蝶呤终浓度为0,0.2,0.8,3.1,12.5,50,200 和 800 nmol·L-1;顺铂、5-氟尿嘧啶终浓度为0,0.2,0.8,3.1,12.5,50,200和800 μmo·lL-1。检测时使用SRB染色法[10],步骤如下:用真空泵吸出96孔板中每孔的培养基,每孔加入质量浓度为0.4%的 SRB 染液(含 1%醋酸),体积为 70 μl,室温染色30 min后,吸出染液,每孔加入1%醋酸溶液洗 3次,晾干,每孔加入 200 μl Tris溶液10 μmmol·L-1,使结晶充分溶解并振荡后,使用酶标仪,检测波长570 nm的吸光度(absorbance,A)[11],GraphPad Prism 5.0 分析软件给出细胞的半数抑制浓度(IC50),SKOV3/Erl细胞的耐药倍数为SKOV3/Erl细胞IC50与SKOV3细胞IC50的比值。
1.4 流式细胞检测细胞周期
收集SKOV3及SKOV3/Erl细胞各2×106个,PBS洗1次后,分别用1 ml冰乙醇在-20℃固定36 h后,100×g离心5 min,去尽上清,PBS 洗1次后,加入浓度为 1 g·L-1RNase 各 100 μl,37℃消化30 min。加入100 μl碘化丙啶于室温避光染色20 min。使用流式细胞仪进行周期检测,Cell Quest软件分析细胞周期分析,重复3次独立实验。
1.5 Western印迹法检测SKOV3/Erl细胞信号通路蛋白表达
在六孔板中种植SKOV3及SKOV3/Erl细胞,每孔1×106个,37℃培养24 h后,分别加入Erl 2和10 μmol·L-1,20 min 后用真空泵抽取培养液,PBS清洗1次后,立即加入冷的细胞裂解液,每孔150 μl,冰上裂解10 min,置入低温高速离心机中离心10 min,转速为13800×g,吸取上清,按照BCA蛋白定量试剂盒对蛋白定量,电泳中每份样品上样量为30 μg。进行转膜,5%脱脂奶室温封闭1 h后,用5%BSA稀释的一抗孵育PVDF膜,保持4℃低温过夜。用TBST洗膜3次后,加入二抗室温孵育1 h,多次洗膜后,使用ECL系统在X线胶片上显影。使用Gelpro32分析软件对全部条带进行灰度扫描,以GAPDH为内参,分析不同信号蛋白的表达,除内参GAPDH以外的条带积分吸光度值分别与对应样品的内参积分吸光度值做比值进行同一化,最后统计磷酸化条带与非磷酸化条带的比值。
1.6 流式细胞术检测SKOV3及SKOV3/Erl细胞膜表面转运体的表达
收集SKOV3及SKOV3/Erl细胞,每管1×106个,每份样品加入荧光标记的抗体各10 μl,另预留一管细胞作为裸细胞对照;在室温避光孵育20 min后,使用FACS洗液清洗细胞3次,加入1%多聚甲醛对细胞进行固定,准备上机进行流式细胞测试。P糖蛋白(P-glycoprotein,Pgp)与乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)的检测使用FL-2通道,多药耐药相关蛋白1(multidrug resistance-related protein 1,MRP1)的检测使用FL-1通道,Toll样受体 4(Toll-like receptor 4,TLR-4)的检测使用 FL-2通道。分析软件为WinMDI 2.8,阳性率以软件统计分析中的Gate值(%)表示[11]。
1.7 SRB法检测脂多糖刺激下药物对SKOV3/Erl细胞生存率的影响
收集对数生长期的SKOV3及SKOV3/Erl细胞,计数,加入96孔板中,每孔5×103个,培养24 h后,刺激组加入脂多糖20 mg·L-1,无刺激组加入相同体积的培养基,再过2 h后每组加入紫杉醇浓度分别为8 nmol·L-1和1 μmol·L-1,另以无药物组作为对照。继续培养72 h,进行SRB染色法处理及吸光度检测,方法同1.3。
1.8 统计学分析
2 结果
2.1 SKOV3/Erl细胞的耐药性
图1结果表明,Erl对SKOV3的IC50为(9.54±1.04)μmol·L-1,对 SKOV3/Erl细胞的 IC50上升至(21.63±1.05)μmol·L-1,耐药倍数约为 2.26。由表1可见,SKOV3/Erl对8种化疗药都产生了一定程度的交叉耐药,其中以Pgp底物的紫杉醇的耐受性最强,IC50由对 SKOV3(2.85±1.30)nmol·L-1上升至(17.15±1.36)nmol·L-1,耐药倍数约为 6.01。长春新碱、米托蒽醌、甲氨蝶呤均为BCRP底物,耐药倍数达到3以上,甲氨蝶呤的耐药倍数更高达5.23。
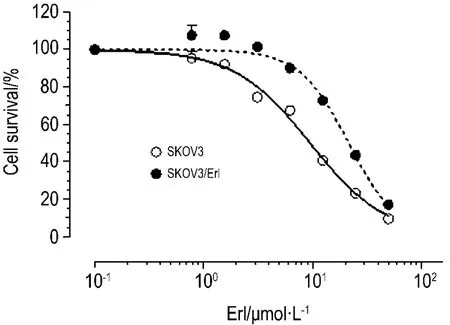
Fig.1 Effect of erlotinib(Erl)on SKOV3 and SKOV3/Erl cell survival.Cells were treated with graded concentration of Erl 0,0.78,1.56,3.13,6.25,12.5,25 and 50 μmol·L -1,and then incubated for 72 h.The IC50was determined by SRB assay.
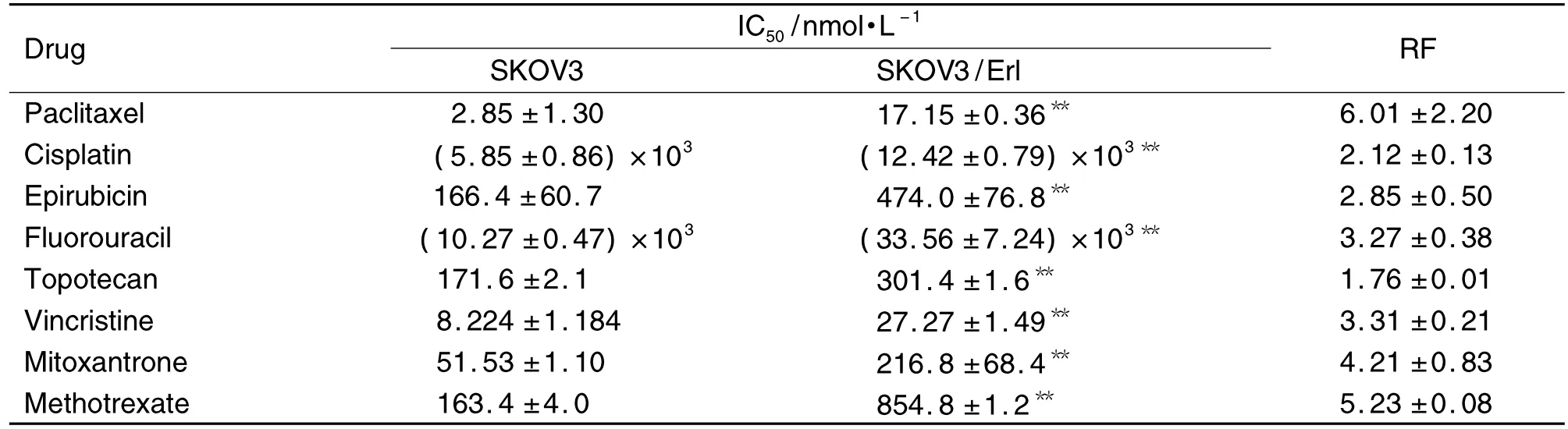
Tab.1 Resistance factor(RF)of SKOV3/Erl cells to different anticancer drugs
2.2 SKOV3/Erl细胞的细胞周期
流式细胞同期检测结果(图2)显示,SKOV3/Erl细胞的(G0+G1)期细胞比例有所上升,为(52.36±1.20)%,SKOV3 细 胞 仅 为(45.08±0.90)%;SKOV3/Erl细胞 S期比例有所下降,为(35.92±1.97)%,SKOV3 细胞为(42.32±0.69)%;而SKOV3与SKOV3/Erl细胞在G2/M期无显著差异,比例分别为(12.60±0.27)%和(11.72±0.81)%。SKOV3/Erl细胞中G0/G1期比例增加,与S期比例下降表明更多的细胞进入静止期,而DNA合成减缓,在一定程度上降低了对细胞毒类化疗药的敏感度。
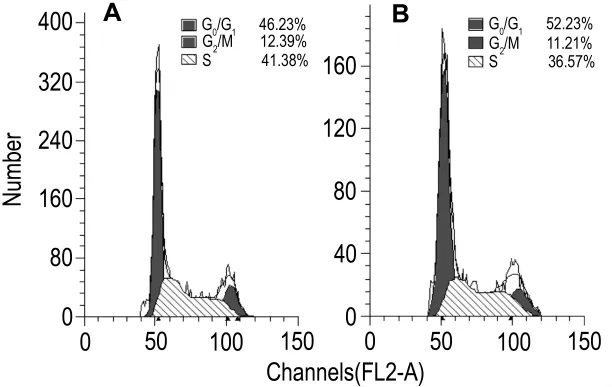
Fig.2 Representative results of cell cycle of SKOV3(A)and SKOV3/Erl(B)cells by flow cytometry.
2.3 SKOV3/Erl细胞中EGFR相关蛋白的表达
如图3所示,随Erl浓度增加,SKOV3细胞中p-HER1略有下调,SKOV3/Erl细胞p-HER1水平显著高于SKOV3(P<0.01),加入 Erl后并不下降。SKOV3/Erl细胞中活化形式的p-ERK平显著上调(P<0.01),但加入 Erl 2 μmol·L-1后,活化程度微弱下降但仍高于相应处理的SKOV3细胞,当Erl 10 μmo·lL-1时,不再高于SKOV3。AKT在SKOV3/Erl中的活化程度显著减弱(P<0.01),加入Erl后活化程度Erl增加,即随Erl浓度升高而上调,与相应处理SKOV3细胞。尽管在SKOV3/Erl中HER2的活化程度显著升高(P<0.01),但在Erl 2和10 μmo·lL-1刺激下,pHER2水平均低于相应处理组的SKOV3细胞。
2.4 SKOV3/Erl细胞膜上转运体的表达
如图4所示,Pgp在SKOV3/Erl细胞中的表达率为(3.56±0.24)%,而在 SKOV3 细胞中为(1.07±0.11)%(P<0.01);BCRP 在 SKOV3/Erl细胞中的表达率为(7.60±0.98)%,而在SKOV3细胞中为(3.97±0.54)%(P<0.01);而在 SKOV3/Erl细胞中MRP1的表达率为(2.43±0.36)%,而在SKOV3的细胞中为(1.63±0.21)%。Pgp,BCRP 和MRP1在SKOV3/Erl细胞中都有微量的上升,且均有统计学差异(P<0.05),但表达率均在10%以内。
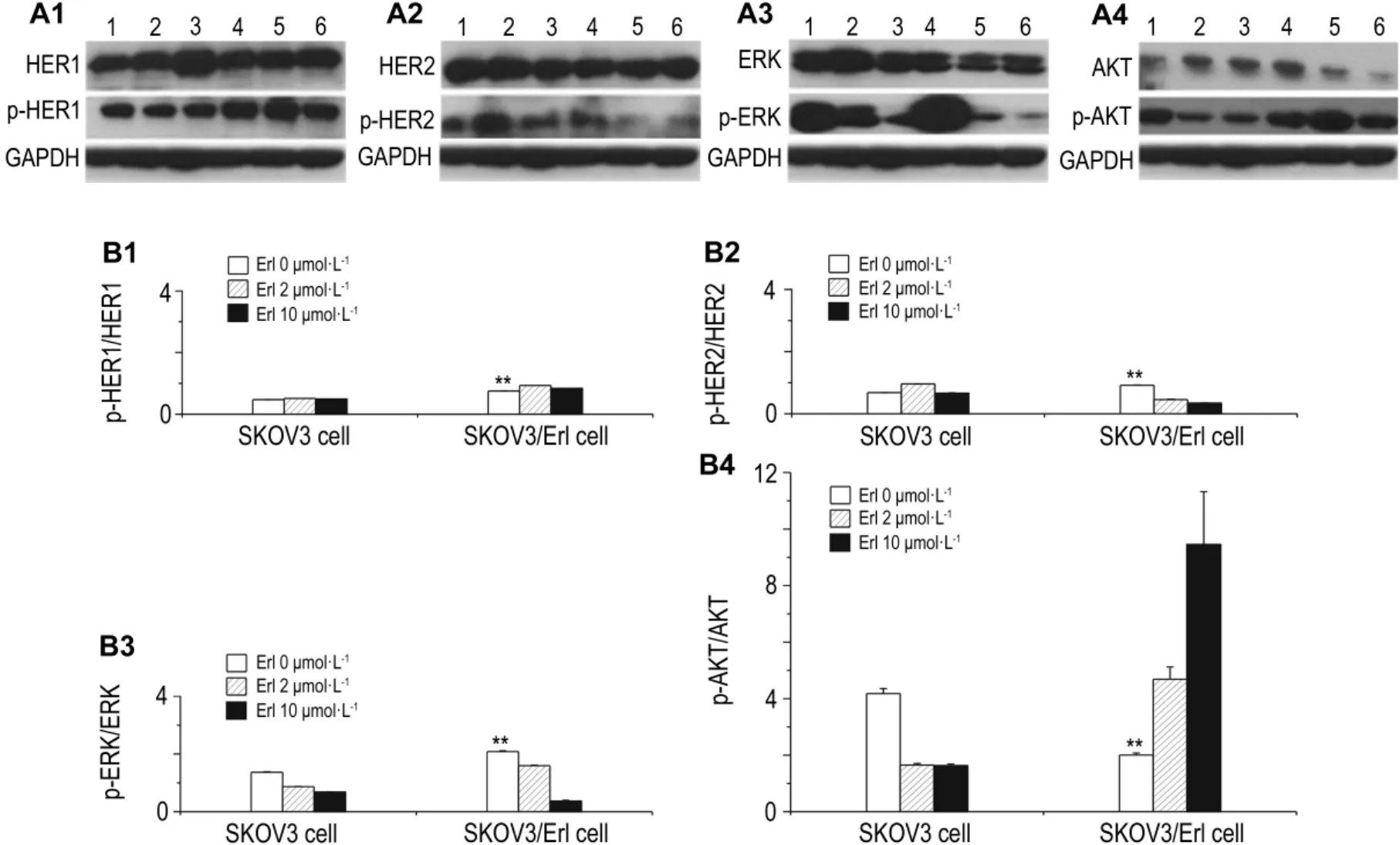
Fig.3 Protein expression in SKOV3 cell SKOV3/Erl treated with Erl by Western blotting.B was the semiquantitative result of A.The cells were treated with Erl 2 and 10 μmol·L -1for 20 min,respectively.Lanes 1,2 and 3:SKOV3 cell treated with Erl 0,2 and 10 μmo·lL-1groups,respectively;lanes 4,5 and 6:SKOV3/Erl cell treated with Erl 0,2 and 10 μmol·L-1groups,respectively.±s,n=3.**P<0.01,compared with SKOV3 group.
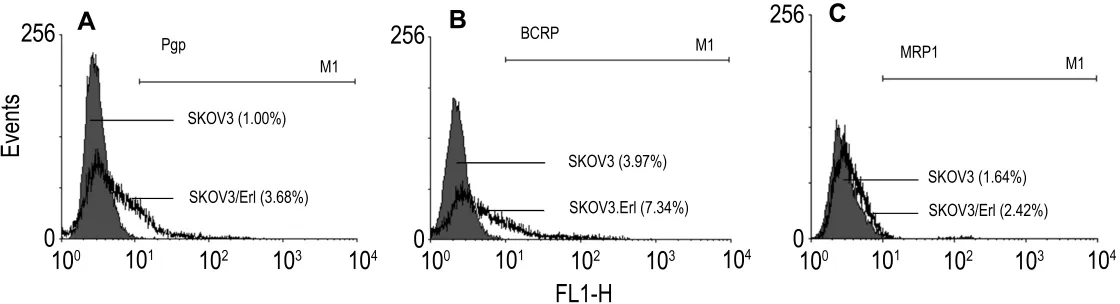
Fig.4 Representative result of protein expression level of surface P-glycoprotein(Pgp)(A),breast cancer resistance protein(BCRP)(B)and multidrug resistance-associated protein 1(MRP1)(C)in SKOV3 and SKOV3/Erl cells.
2.5 SKOV3/Erl细胞TLR4蛋白的表达
如图5所示,SKOV3/Erl细胞不但表现出一定的耐药性,还伴随着细胞表面TLR4蛋白的表达量显著上升,其表达率由在SKOV3细胞中的(18.43±5.61)%显著提高至在 SKOV3/Erl细胞中的(92.68±2.19)%(P<0.01)。
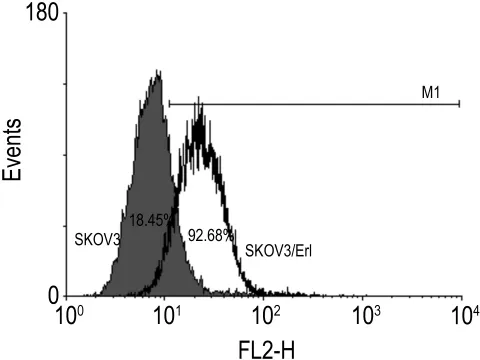
Fig.5 Toll-like receptor 4 expression level on SKOV3 and SKOV3/Erl cells determined by flow cytometry.
2.6 脂多糖刺激对SKOV3/Erl细胞存活的影响
如表2所示,脂多糖的刺激可显著提高SKOV3/Erl细胞存活数,SKOV3/Erl细胞增殖程度甚至可达到空白对照组的2倍左右,而脂多糖对SKOV3则影响微弱。紫杉醇 8 nmol·L-1组中,SKOV3/Erl细胞仍保持较高的存活率,与SKOV3细胞相比有统计学差异(P<0.05);而在脂多糖刺激下,SKOV3/Erl的存活数显著高于SKOV3细胞(P<0.01)。紫杉醇1 μmol·L-1作用下和脂多糖刺激时,SKOV3/Erl细胞存活数显著高于SKOV3细胞(P<0.01),而无脂多糖刺激时,两种细胞无显著差异。
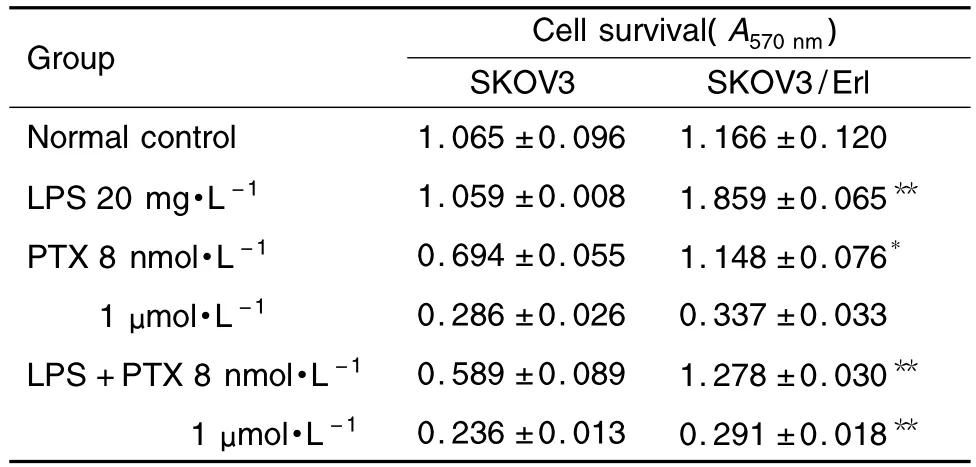
Tab.2 Effect of lipopolysaccharide(LPS)on SKOV3/Erl cell survival
3 讨论
本实验结果显示,经过持续性药物刺激诱导而成的SKOV3/Erl细胞,耐药倍数可达2.26倍,对紫杉醇和顺铂为代表的常用卵巢癌化疗药物表现出多药耐药的特点,提示未来使用Erl治疗卵巢癌的患者,如出现Erl耐药现象,使用多种抗肿瘤药物的化疗方案可能表现出疗效达不到预期的状况。在细胞周期的检测中,耐药细胞表现为G0/G1期的上升,以及S期的下降,这表明耐药细胞相对较多地进入了静止期,DNA合成有所下降,这似乎与肿瘤干细胞特征十分相似,增殖速度慢,造成化疗药物杀伤的选择性下降,致使疗效降低。Erl的长期刺激下,细胞中EGFR的磷酸化活性反而有所上升。药物干预条件下EGFR并未出现明显抑制,耐药细胞中的EGFR保持了较强的激酶活性,其下游信号中,活化的ERK维持了较高水平,而AKT信号则对ERK不敏感。由于HER1可以通过同源二聚化以及与HER2的异源二聚化两种方式传递信号,因此,HER2的磷酸化水平也值得关注的。从结果来看,SKOV3/Erl细胞HER2的磷酸化水平有上调,但对Erl的抑制作用仍然十分敏感,推测HER1/HER2的异源二聚化程度对细胞的药物耐受并无贡献。综上所述,在体外条件下,EGFR仍然是SKOV3/Erl细胞增殖和存活的重要途径。在非小细胞肺癌的研究中,有文献报道,EGFR的T790M突变是导致TKI药物治疗过程出现耐药的重要原因之一[12],而本研究中诱导的耐药细胞SKOV3/Erl并不存在激酶区的任何突变,因此,SKOV3细胞系出现的Erl耐药机制与非小细胞肺癌有很大差别。EGFR活性保持与其他受体酪氨酸激酶的关系需要进一步观察。
文献[13-15]报道,与多药耐药有关的重要的3个ABC转运蛋白会引起多种药物在细胞内的积累下降,特别是BCRP和Pgp对Erl具有外排功能,可能是导致其疗效下降的直接原因。然而实验数据提示,耐药细胞中Pgp,BCRP以及MRP1表达仅有微弱提高,总体阳性率都保持在10%以下,可认为是低水平表达,难以对药物的外排起到重要作用。
TLR4是最近几年上皮性肿瘤标志物研究中的新热点,由其在卵巢癌的增殖和耐药方面起到重要作用。最近几年的研究发现多种上皮肿瘤细胞也有TLR4高表达,并且与肿瘤的增殖能力和化疗耐药相关[16-18]。甚至有报道称TLR4信号的激活是上皮性卵巢癌干细胞的特征。在本研究中所建立的SKOV3耐药细胞模型中,TLR4的阳性率显著地上升,同时脂多糖刺激实验也证实TLR4激活大大促进耐药细胞SKOV3/Erl增殖,并在相对低浓度紫杉醇的杀伤下保持较高的存活率,而相对低表达TLR4的SKOV3细胞则对紫杉醇十分敏感。推测由于紫杉醇自身具有激活TLR4信号的功能,TLR4下游的NF-κB入核增多,PI3K/AKT路径的活化信号上调所致[18],推测Erl在一定程度上降低肿瘤对紫杉醇的敏感度。TLR4上调的原因尚未得到证实,而临床上TLR4上调对EGFR小分子抑制剂靶向治疗的指示作用,也有待于根据临床做进一步验证与探究。
总之,SKOV3/Erl表现出的耐药特点与已报道的非小细胞肺癌大不相同,初步分析TLR4的表达上调是其药物耐受能力提高的重要原因之一。此外,目前国内卵巢癌的靶向治疗研究刚刚处在起步阶段,SKOV3/Erl细胞模型的建立为卵巢癌靶向治疗的耐受研究提供了物质基础和新的思路。
[1]Siegel R,Naishadham D,Jemal A.Cancer statistics,2012[J].CA Cancer J Clin,2012,62(1):10-29.
[2]Mezzanzanica D, Bagnoli M, De Cecco L, Valeri B,Canevari S.Role of microRNAs in ovarian cancer pathogenesis and potential clinical implications[J].Int J Biochem Cell Biol,2010,42(8):1262-1272.
[3]Mendelsohn J,Baselga J.Epidermal growth factor receptor targeting in cancer[J].Semin Oncol,2006,33(4):369-385.
[4]Erlotinib or Observation in Treating Patients Who Have Undergone First-Line Chemotherapy for Ovarian Cancer,Peritoneal Cancer,or Fallopian Tube Cancer[DB/OL].(2011-04-23)[2012-09-04]http://clinicaltrials.gov/ct2/show/NCT00263822.
[5]Gordon AN,Finkler N,Edwards RP,Garcia AA,Crozier M,Irwin DH,et al.Efficacy and safety of erlotinib HCl,an epidermal growth factor receptor(HER1/EGFR)tyrosine kinase inhibitor,in patients with advanced ovarian carcinoma:results from a phaseⅡ multicenter study[J].Int J Gynecol Cancer,2005,15(5):785-792.
[6]Blank SV,Christos P,Curtin JP,Goldman N,Runowicz CD,Sparano JA,et al.Erlotinib added to carboplatin and paclitaxel as first-line treatment of ovarian cancer:a phaseⅡstudy based on surgical reassessment[J].Gynecol Oncol,2010,119(3):451-456.
[7]Murphy M,Stordal B.Erlotinib or gefitinib for the treatment of relapsed platinum pretreated non-small cell lung cancer and ovarian cancer:a systematic review[J].Drug Resist Updat,2011,14(3):177-190.
[8]Xu QY,Chen YH,Zhao LJ,Li XP,Wang JL,Wei LH.Establishmentofcisplatin-resistanthuman endometrial cancer cell line and the study of its resistant mechanisms[J].Chin J Obstet Gynecol(中华妇产科杂志),2011,46(7):533-537.
[9]Chen GJ,Li YL,Tian F,Zhu H,Sun LY,Li CH,et al.Comparison of stepwise and pulse induced cisplatin-resistant ovarian cancer cell sublines[J].Chin J Oncol(中华肿瘤杂志),2001,23(4):305-308.
[10]Peng H, Qi J, Dong Z, Zhang JT.Dynamic vs static ABCG2 inhibitors to sensitize drug resistant cancer cells[J].PLoS One,2010,5(12):e15276.
[11]Ye WL, Lin Z, Lang XL, Qiao CX,Li XY,Wang LY,et al.Effects of cetuximab against human hepatocellular carcinoma cells HepG2 in vitro[J].Mil Med Sci(军事医学),2011,35(3):202-206.
[12]Costa DB,Schumer ST,Tenen DG,Kobayashi S.Differential responses to erlotinib in epidermal growth factor receptor(EGFR)-mutated lung cancers with acquired resistance to gefitinib carrying the L747S or T790M secondary mutations[J].J Clin Oncol,2008,26(7):1182-1184.
[13]Lopez JP,Wang-Rodriguez J,Chang C,Chen JS,Pardo FS,Aguilera J,et al.Gefitinib inhibition of drug resistance to doxorubicin by inactivating ABCG2 in thyroid cancer cell lines[J].Arch Otolaryngol Head Neck Surg,2007,133(10):1022-1027.
[14]Lemos C,Kathmann I,Giovannetti E,Calhau C,Jansen G,Peters GJ.Impact of cellular folate status and epidermal growth factor receptor expression on BCRP/ABCG2-medi-ated resistance to gefitinib and erlotinib[J].Br J Cancer,2009,100(7):1120-1127.
[15]Shi Z,Peng XX,Kim IW,Shukla S,Si QS,Robey RW,et al.Erlotinib(Tarceva,OSI-774)antagonizes ATP-binding cassette subfamily B member 1 and ATP-binding cassette subfamily G member 2-mediated drug resistance[J].Cancer Res,2007,67(22):11012-11020.
[16]Szajnik M,Szczepanski MJ,Czystowska M,Elishaev E,Mandapathil M,Nowak-Markwitz E,et al.TLR4 signaling induced by lipopolysaccharide or paclitaxel regulates tumor survival and chemoresistance in ovarian cancer[J].Oncogene,2009,28(49):4353-4363.
[17]Hsu RY,Chan CH,Spicer JD,Rousseau MC,Giannias B,Rousseau S,et al.LPS-induced TLR4 signaling in human colorectal cancer cells increases beta1 integrin-mediated cell adhesion and liver metastasis[J].Cancer Res,2011,71(5):1989-1998.
[18]Wang AC,Su QB,Wu FX,Zhang XL,Liu PS.Role of TLR4 for paclitaxel chemotherapy in human epithelial ovarian cancer cells[J].Eur J Clin Invest,2009,39(2):157-164.

