雌二醇诱导雌性大鼠真性性早熟模型的建立
杨 嵘,张立实,王以美,张 丽,黄丽娜,张廷芬,束玉磊,赵 君,彭双清
(四川大学华西公共卫生学院1.毒理学教研室,3.营养与食品卫生学教研室,四川成都 610041;2.军事医学科学院疾病预防控制所毒理学评价研究中心,北京 100071)
性早熟是指女性儿童8岁前,男性儿童9岁前开始的第二性征发育。近年,全球儿童的性早熟发生率显著增加,其对患儿身心健康产生严重影响[1]。性早熟按其性质可分为真性性早熟和假性性早熟两种类型[2]。真性性早熟是由于下丘脑-垂体-性 腺 轴 (hypothalamic-pituitary-gonadal axis,HPGA)被提前激活而导致生殖能力的提前出现[3];假性性早熟是指HPGA并没有提前启动,仅表现为部分第二性征的提前出现。目前报道的真性性早熟模型的建立,主要有由达那唑[4]和N-甲基-DL-天冬氨酸[5]诱导的两种,雌激素诱导真性性早熟的发生罕见报道。大鼠青春期发育过程与人类近似[6],且大鼠性发育各项指征明确,性早熟建模时间短(2~3个月),性周期短(4~5 d),因此本次研究选择大鼠作为性早熟研究的实验动物。连续5 d给予青春期前雌性大鼠 17β-雌二醇50 μg·kg-1,观察大鼠性发育过程中HPGA功能的改变,探讨雌二醇诱导真性性早熟模型建立的意义,及其作用机制。
1 材料与方法
1.1 仪器与试剂
CR3i型低温高速冷冻离心机和MK3型多功能酶标仪(上海Thermo公司);BT224S型电子天平(德国Sartorius公司);CKX41型倒置显微镜和全自动高压灭菌器(日本Sanyo公司);TC-412型PCR仪(美国 ABI)。17β-雌二醇,购自美国Cayman公司;大鼠黄体生成素(luteinizing hormone,LH),卵泡刺激素(follicle stimulating hormone,FSH),雌激素(estradiol,E2)ELISA 检测试剂盒,购自美国Rapidbio.Lab公司;PCR转录试剂盒,购自美国Fermentas公司;促性腺激素释放激素(gonadotropin releasing hormone,GnRH)、Kiss-1、G蛋白偶联受体54(G protein-coupled receptor-54,GPR54)引物由Invitrogen公司合成(表1)。
参照文献[7]并经过一系列预实验,最终确定雌二醇的浓度为 50 μg·kg-1,生理盐水为溶剂。
1.2 动物
SPF级Sprague-Dawley(SD)未孕大鼠,雌、雄鼠各15只,体质量250~300 g(♀),300~350 g(♂),由军事医学科学院实验动物中心提供,动物生产许可证号:SCXK-(军)2007-004。恒温(22~26℃)、恒湿(40%~70%),自由摄食饮水。

Tab.1 Primers used in reversed transcriptase PCR
1.3 交配及动物分组给药
大鼠1∶1合笼交配,自由饮食。孕鼠单笼饲养,生产后,选用雌性仔鼠,由亲母自养。雌仔鼠在出生后(postnatal day)15日龄(PND15)时予以标记编号,随机分为溶剂对照组和雌二醇模型组。每组20只,溶剂对照组ig给予生理盐水,模型组ig给予雌二醇溶液 50 μg·kg-1(2.5 ml·kg-1),每天 1 次,连续5 d。仔鼠在PND21时断奶。
1.4 观察大鼠阴门开启时间并测定大鼠第一个发情间期及性周期稳定后第一个发情期出现的时间
给药结束后,随机选择溶剂对照组及模型组幼鼠各10只。每日观察幼鼠的阴门开启(vaginal opening,VO)情况,上、下午各检查一次。阴门开启后,阴道涂片法检查[8]大鼠第一个发情间期(first diestrus,D1)和性周期稳定后第一个发情期出现的时间(first estrus in regular estrous cycle,E1)。阴道涂片法即用生理盐水浸湿的棉签轻擦大鼠阴道,取出后于载玻片上涂片,片子自然风干后,HE染色,低倍光镜下观察其细胞形态以确定大鼠性周期各个阶段,每日8:00定时检测。
1.5 ELISA法测定血清中性激素水平
溶液对照组和模型组另外10只幼鼠,幼鼠阴门开启后定时做阴道涂片。模型组大鼠阴门开启当天(第一时间点)及出现第一个发情间期当天(第二时间点)眼眶静脉丛采血约1 ml,溶剂组大鼠同时1∶1采血,血浆室温静置 10 min,3500 ×g 离心15 min,取上清-80℃保存。ELISA法测定上述两个时间点雌性大鼠血清中LH,FSH,E2的水平。
1.6 性器官病理学检查及逆转录PCR检测下丘脑GnRH,Kiss-1,GPR54和垂体GnRH受体基因表达水平检测
同1.5步骤中所用幼鼠。模型组大鼠在出现第一个发情间期的当天下午4点颈椎脱臼处死,等数量处死溶剂对照组大鼠。取子宫、卵巢、阴道,称质量,计算子宫、卵巢和阴道系数,脏器系数=脏器质量(mg)/体质量(g)。取下丘脑、垂体,逆转录PCR法测定下丘脑GnRH,Kiss-1,GPR54 mRNA和垂体GnRH受体mRNA的表达。扩增片段分别为105,350,104,122和550 bp片段。提取下丘脑、垂体总 RNA,逆转录为 cDNA后,PCR扩增。扩增体系总体积25 μl,条件设置为:94℃预变性1 min;94℃变性 30 s,56℃退火 30 s,72℃延伸 30 s,共40个循环。扩增产物在琼脂糖凝胶中电泳,紫外凝胶图像分析系统摄片并对拍摄的照片进行密度扫描,以目的基因条带积分吸光度值(integrated absorbance,IA)对内参基因β肌动蛋白积分吸光度的比值表示目的基因的相对表达水平。
1.7 统计学分析
2 结果
2.1 一般状态观察
在整个实验过程中,溶剂对照和模型组大鼠均无死亡,且生长状况良好,进食及饮水均未见异常。与溶剂对照组大鼠比较,PND 15,PND 19和PND 35时,模型组体质量无统计学差异(表2)。
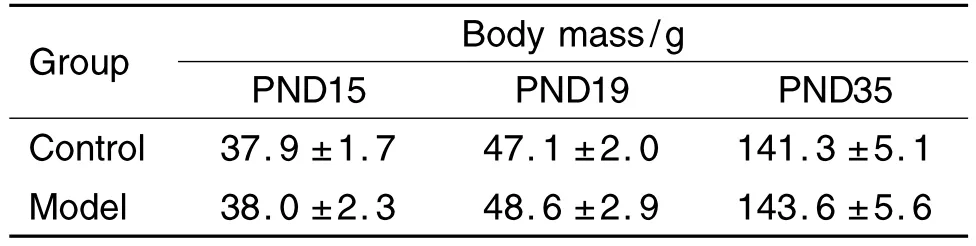
Tab.2 Effect of prepubertal exposure to 17β-estradiol(E2)on body mass of female SD rats
2.2 雌二醇对雌性大鼠VO,D1和E1的影响
如表3所示,与溶剂对照组比较,模型组大鼠VO,D1和E1出现的平均日龄著提前,分别提前了14.6 d,14.5 d 和11.3 d 左右(P<0.05)。提示雌二醇可诱导雌性大鼠的青春期启动显著提前。
2.3 雌二醇对SD大鼠动情周期中各阶段阴道细胞涂片表现的影响
阴道涂片结果显示,模型组大鼠脱落上皮细胞的周期性变化和溶剂组大鼠一样,出现规则的4~5 d四期性周期表现,顺序依次为发情期、发情后期、发情间期、发情前期,且两组大鼠动情周期中各阶段的阴道细胞涂片表现相同:发情期阴道涂片以无核的角化上皮细胞为主,一般无白细胞(图1A1,B1);发情后期阴道涂片可见白细胞、有核上皮细胞和角化上皮细胞,且三者比例相当(图1A2,B2);发情间期阴道涂片以白细胞为主,细胞量较多(图1A3,B3);发情前期阴道涂片可见大量有核上皮细胞和少量的角化上皮细胞,细胞量较多(图1A4,B4)。
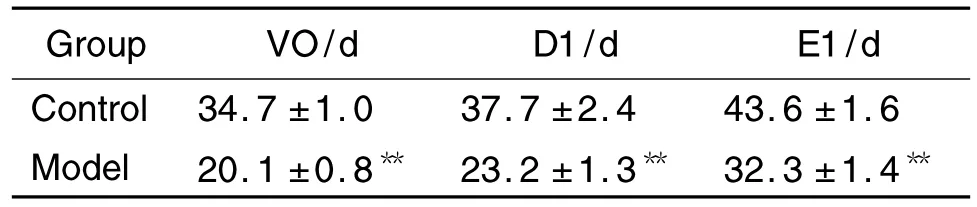
Tab.3 Effect of prepubertal exposure to E2on VO,D1 and E1 in SD rats
2.4 雌二醇对雌性大鼠子宫、卵巢和阴道指数的影响
如表4所示,与溶剂对照组比较,模型组大鼠阴道指数明显增加,差异有统计学意义(P<0.05),而子宫和卵巢指数无显著差异。
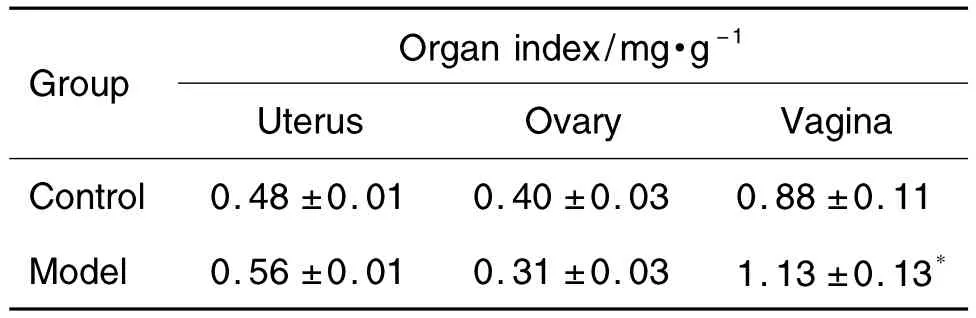
Tab.4 Effect of prepubertal exposure to E2on organ index in female rats
2.5 雌二醇对大鼠不同时间段血清LH,FSH和E2的变化
如表5所示,与溶剂对照组相比,模型组大鼠阴门开启当天(第一时间点)血清LH和FSH的含量分别显著增加了144%与139%(P<0.01);血清E2含量亦有增加,但无统计学差异。溶剂对照组和模型组大鼠 FSH/LH值均>1,但无统计学差异。
与溶剂对照组相比,模型组大鼠出现第一个发情间期当天(第二时间点)血清LH,FSH和E2含量分别显著增加了176%,124%和207%(P<0.05);模型组大鼠FSH/LH值<1,与溶剂对照组比较有统计学差异(P<0.05)。

Fig.1 Effect of E2on vaginal epithelium during estrous cycle stages of female SD rats(HE ×100).A:control group(A1,estrus;A2,metestrus;A3,diestrus;A4,proestrus);B:model group(B1,estrus;B2,metestrus;B3,diestrus;B4,proestrus).
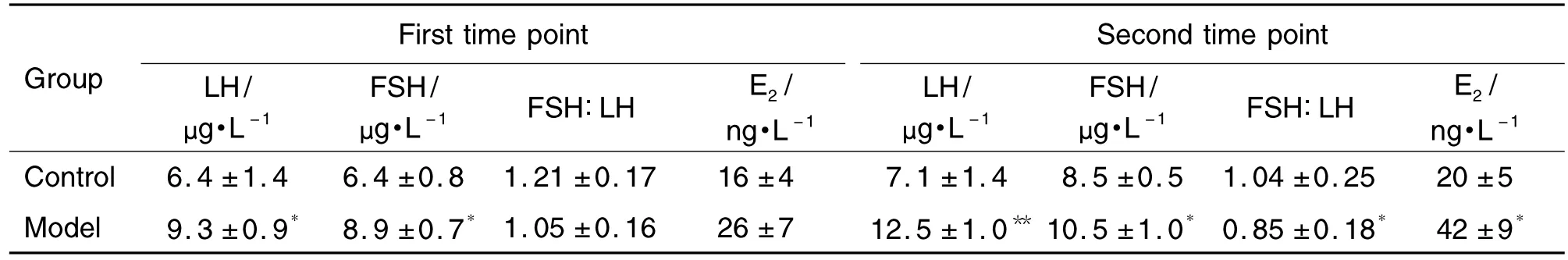
Tab.5 Effects of prepubertal exposure to E2on serum LH,FSH and E2levels in female SD rats
2.6 雌二醇对大鼠下丘脑GnRH,Kiss-1,GPR54与垂体GnRH受体mRNA表达水平的影响
逆转录PCR(图2A)及其定量结果(图2B)显示,与溶剂对照组相比,模型组大鼠下丘脑GnRH、Kiss-1、GPR54和垂体GnRH受体mRNA表达均明显增多(P<0.01);GnRH,Kiss-1,GPR54和GnRH受体mRNA相对表达水平分别增加了155%,130%,900%和175%(P<0.01)。
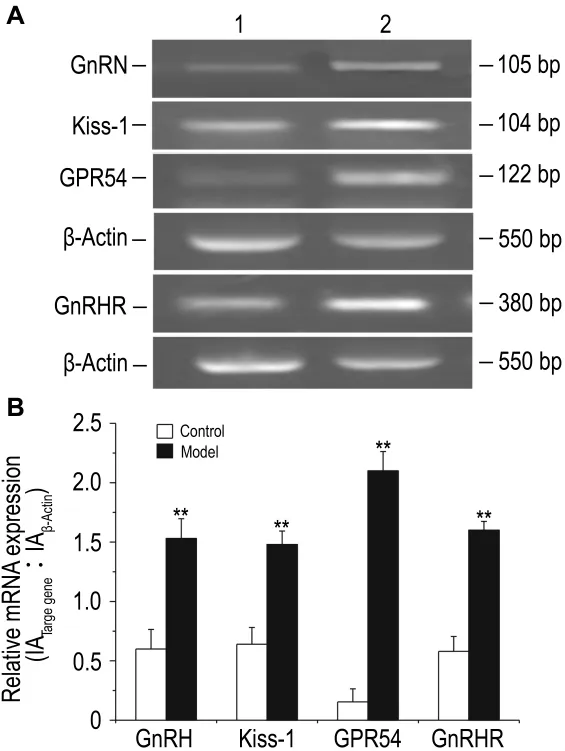
Fig.2 Effects of E2on mRNA expressions of GnRH,Kiss-1,GPR54 and GnRHR in female SD rats by reverse transcriptase PCR.See Tab.2 for rats treatment.B:quantitative analysis results of A.Lane 1:vehicle control;lane 2:model.±s,n=10.**P<0.01,compared with control group.
3 讨论
阴门开启和第一次排卵的发生是判断雌性大鼠青春期启动的两个决定性标准,第一次排卵发生的间接指征为第一个发情间期的出现[6];而第一个规则性周期的出现是判断女性青春期发育完成的终点[9],本次研究中采用E1代替第一个规则性周期的出现,提示模型组大鼠的青春期启动提前。溶剂对照组和模型组大鼠动情周期中各阶段阴道细胞涂片表现相同,动情周期的持续时间基本相同,说明给予雌二醇后,大鼠的动情周期表现与正常进入青春期组的大鼠相同。而模型组大鼠阴道指数相对升高,提示雌二醇可诱导大鼠第二性征提前出现。
临床上对于儿童性成熟诊疗的基本步骤,首先是确定性激素活性是否增加[10],而激素检测的基础内容主要是FSH,LH和E2值。若FSH/LH>1,提示处于青春期前,反之则说明进入青春期[11-12]。本研究结果显示,模型组大鼠LH,FSH和E2水平较溶剂对照组显著提高,同时还观察到溶剂对照组在血清性激素检测的两个时间点FSH/LH均>1,提示溶剂对照组大鼠在实验结束时尚处于青春期前;而模型组大鼠在第二个时间点FSH/LH<1,提示在实验结束时,模型组大鼠已出现真性性早熟。
激活GnRH释放是促进青春期启动的关键,近年研究发现,下丘脑GPR54与其配体kisspeptins(kiss-1基因编码产物)对GnRH释放的激活起关键作用[13]。研究显示,雄性猴发育期间Kiss-1和GPR54 mRNA 含量增加[14],且 Kiss-1 和 GPR54基因敲除小鼠很难正常启动性发育[15]。本研究发现,模型组下丘脑GnRH和垂体GnRH受体基因的表达水平明显增多,提示雌二醇可诱导下丘脑GnRH和垂体GnRH受体mRNA合成增加;且模型组大鼠Kiss-1及GPR54 mRNA表达水平显著增加,说明Kisspeptins/GPR54系统的激活在雌二醇诱导真性性早熟中发挥着重要的调节的作用。
综上所述,雌二醇可通过上调幼龄雌性大鼠下丘脑Kiss-1基因的表达,诱导GnRH的合成和分泌,从而使雌性大鼠HPGA功能提前启动,建立了良好的真性性早熟模型。
[1]Brito VN,Latronico AC,Arnhold IJ,Mendonça BB.Update on the etiology,diagnosis and therapeutic management ofsexualprecocity[J]. Arq BrasEndocrinol Metabol,2008,52(1):18-31.
[2]Tian Z,Zhao H,Sun Y,Cai D,Chen B.Evaluation of the true precocious puberty rats induced by neonatal administration of danazol:therapeutic effects of nourishing ″Yin″-removing ″Fire″Chinese herb mixture[J].Reprod Biol Endocrinol,2005,3:38.
[3]Massart F,Saggese G.Oestrogenic mycotoxin exposures and precocious pubertal development[J].Int J Androl,2010,33(2):369-376.
[4]Sun Y,Tian Z,Zhao H,Wong ST,Chen B.Characteristic of hypothalamic kisspeptin expression in the pubertal development of precocious female rats[J].Neurosci Lett,2007,420(1):12-17.
[5]Pan J,Li HL,Zheng YN.Experimental study of true precocious puberty model in female rats[J].Chin J Endocrinol Metab(中华内分泌代谢杂志),2004,20(1):84-85.
[6]Roth C,Leonhardt S,Theiling K,Lakomek M,Jarry H,Wuttke W.Ontogeny of the GNRH-,glutaminase-and glu-tamate decarboxylase-gene expression in the hypothalamus of female rats[J].Brain Res Dev Brain Res,1998,110(1):105-114.
[7]Suzuki S,Handa RJ.Regulation of estrogen receptor-beta expression in the female rat hypothalamus:differential effects of dexamethasone and estradiol[J].Endocrinology,2004,145(8):3658-3670.
[8]Matagne V, Rasier G, Lebrethon MC, Gérard A,Bourguignon JP.Estradiol stimulation of pulsatile gonadotropin-releasing hormone secretion in vitro:correlation with perinatal exposure to sex steroids and induction of sexual precocity in vivo[J].Endocrinology,2004,145(6):2775-2783.
[9]Ojeda SR,Skinner MK.Puberty in the rat[M]∥Knobil E,Neil JD.The Physiology of Reproduction.2nd ed.New York:Raven Press,1994:2006,2061-2126.
[10]Wacharasindhu S, Srivuthana S, Aroonparkmongkol S,Shotelersuk V.A cost-benefit of GnRH stimulation test in diagnosis of central precocious puberty(CPP)[J].J Med Assoc Thai,2000,83(9):1105-1111.
[11]Partsch CJ,Sippell WG.Pathogenesis and epidemiology of precocious puberty.Effects of exogenous oestrogens[J].Hum Reprod Update,2001,7(3):292-302.
[12]Castellano JM,Bentsen AH,Sánchez-Garrido MA,Ruiz-Pino F,Romero M,Garcia-Galiano D,et al.Early metabolic programming of puberty onset:impact of changes in postnatal feeding and rearing conditions on the timing of puberty and development of the hypothalamic kisspeptin system[J].Endocrinology,2011,152(9):3396-3408.
[13]Tena-Sempere M.The roles of kisspeptins and G proteincoupled receptor-54 in pubertal development[J].Curr Opin Pediatr,2006,18(4):442-447.
[14]Shahab M,Mastronardi C,Seminara SB,Crowley WF,Ojeda SR,Plant TM.Increased hypothalamic GPR54 signaling:a potential mechanism for initiation of puberty in primates[J].Proc Natl Acad Sci USA,2005,102(6):2129-2134.
[15]Lapatto R,Pallais JC,Zhang D,Chan YM,Mahan A,Cerrato F,et al.Kiss1-/-mice exhibit more variable hypogonadism than Gpr54-/-mice[J].Endocrinology,2007,148(10):4927-4936.

