一株黄原胶降解菌的筛选与鉴定
刘亚云,李洁,杨伍,苏柯,杨艳燕
(湖北大学生命科学学院,湖北 武汉 430062)
0 引言
黄原胶又称汉生胶,是由野油菜黄单胞菌分泌的一种胞外水溶性多糖.作为一种无毒性的生物多糖,具有良好的水溶性、增粘性、乳化稳定性及对酸、碱、盐、反复冻融的高稳定性等特点,被广泛用于食品、医药、日用化工及石油开采等多个领域,是一种用途广泛的微生物多糖[1-2].
但黄原胶具有的高稳定性是一把双刃剑,使黄原胶可以广泛应用于各个领域的同时,也带来了一些问题.比如,在石油开采工业中使用黄原胶作为驱替剂,可以增加驱替剂的粘度,提高采油率;但黄原胶的使用也使得采出液的油物性发生了变化,如原油密度增加,粘度增大,采出液含聚浓度增加,原油乳化状态复杂,增加了污水处理的难度,增加了后续工艺如油料运输及产品纯化成本[3].因此,唯有寻找到有效降解黄原胶的方法,才能使黄原胶更好地应用于石油开采业中[4-5].
本实验对一株从土壤中分离的能降解黄原胶的菌株进行了筛选鉴定,包括形态特征、生理生化特征和16S rDNA的序列分析,确定该菌株的菌属,为进一步利用该菌株降解黄原胶的研究奠定基础.
1 材料与方法
1.1供试菌湖北大学应用生化实验室保存的黄原胶降解菌菌液.
1.2菌株的富集培养取菌液接种至富集培养基,37 ℃、摇速180 r/min条件下进行培养,培养24 h后,吸取培养液转移至新的富集培养基中,以相同条件继续培养24 h.经过多次的富集培养,使培养液中可以降解黄原胶的菌株得到富集.在配制的黄原胶富集培养基[6]中添加的黄原胶浓度为5 g/L.
1.3菌株的分离纯化吸取富集培养后的培养液,稀释10-4倍后涂布于黄原胶固体培养基,观察平板上菌株的生长情况.挑取平板上生长良好的菌株接入黄原胶选择性培养基中,37 ℃、摇速180 r/min条件下培养24 h,观察培养液的粘度变化,制作菌株的生长曲线.黄原胶固体培养基和黄原胶选择性培养基参考刘晗等[7]配制.
1.4培养基粘度测定乌氏粘度计的使用参见《基础化学实验教程》[8].
1.5菌株的形态学观察(1)菌落形态的观察.将菌株接种于黄原胶固体平板培养基上中,37 ℃培养24 h,观察平板上菌落的生长状况及菌落形态.(2)革兰氏染色和芽胞染色.详细步骤参见《微生物学实验》[9].
1.6菌株的常规生理生化特征的鉴定将菌株接种于富集培养基中,于37 ℃条件下活化培养24 h后,参照Nankai H等[10-11]报道的方法,对该菌株分别进行淀粉水解试验、明胶液化试验、石蕊牛奶试验、甲基红试验、乙酰甲基甲醇(V·P)试验、柠檬酸盐利用试验、吲哚试验以及接触酶试验.
1.7菌株的碳源及氮源的选择将菌株接种至碳源利用基本培养基和氮源利用基本培养基中,37 ℃进行培养72 h,连续传代3次,观察菌株的生长情况,生长则为阳性,不生长则为阴性.测试用的碳源有蔗糖、木糖、乳糖、麦芽糖、甘露糖、葡萄糖、山梨醇和鼠李糖.测试用的氮源有尿素、硝酸铵、硝酸钾、氯化铵、硝酸钠和酪蛋白.碳源基本培养基用选择的碳源替代富集培养基中的黄原胶;氮源基本培养基用选择的氮源替代富集培养基中的硝酸钾.
1.8菌株的16SrDNA序列分析及系统发育进化树的构建当菌株细胞浓度OD600达到0.2~0.3时,进行总DNA的抽提.将已抽提出的菌株总DNA作为模板,利用PCR技术扩增出该菌株16S rDNA片段[7].采用琼脂糖凝胶电泳检测PCR的产物,再将PCR的产物交给上海桑尼生物科技有限公司进行目的片段基因测序,并将测序得到的基因序列输入NCBI数据库进行Blast比对,搜索相匹配的相关序列作为参比,用CLUSTAL X1.8.1软件进行序列比对,MEGA 3.1软件绘制供试菌株与参比菌株之间的系统进化树.
设计菌株 16S rDNA扩增引物[12],Primer F:F27(5′-AGAGTTTGATCATGGCTCAG-3′),Primer R:R1492(5′-ACGGTTACCTTGTTACGACTT-3′).
2 结果与分析
2.1黄原胶降解菌的筛选经过富集培养和选择性培养,从保存的菌液中筛选出一株能降解黄原胶的菌株,将其命名为XD-09.挑取一株单菌落进行培养,绘制其生长曲线.图1所示的XD-09生长曲线表明,菌株在生长至第10~16 h,其OD值急剧增大,表明菌株进入了对数生长期.
2.2菌株XD-09在培养过程中粘度的变化如图2所示,当菌株XD-09在黄原胶选择性培养基中生长时,培养液的粘度逐渐下降,当培养时间达到第18~30小时,培养液的相对粘度下降较明显,表明黄原胶多糖被降解了.
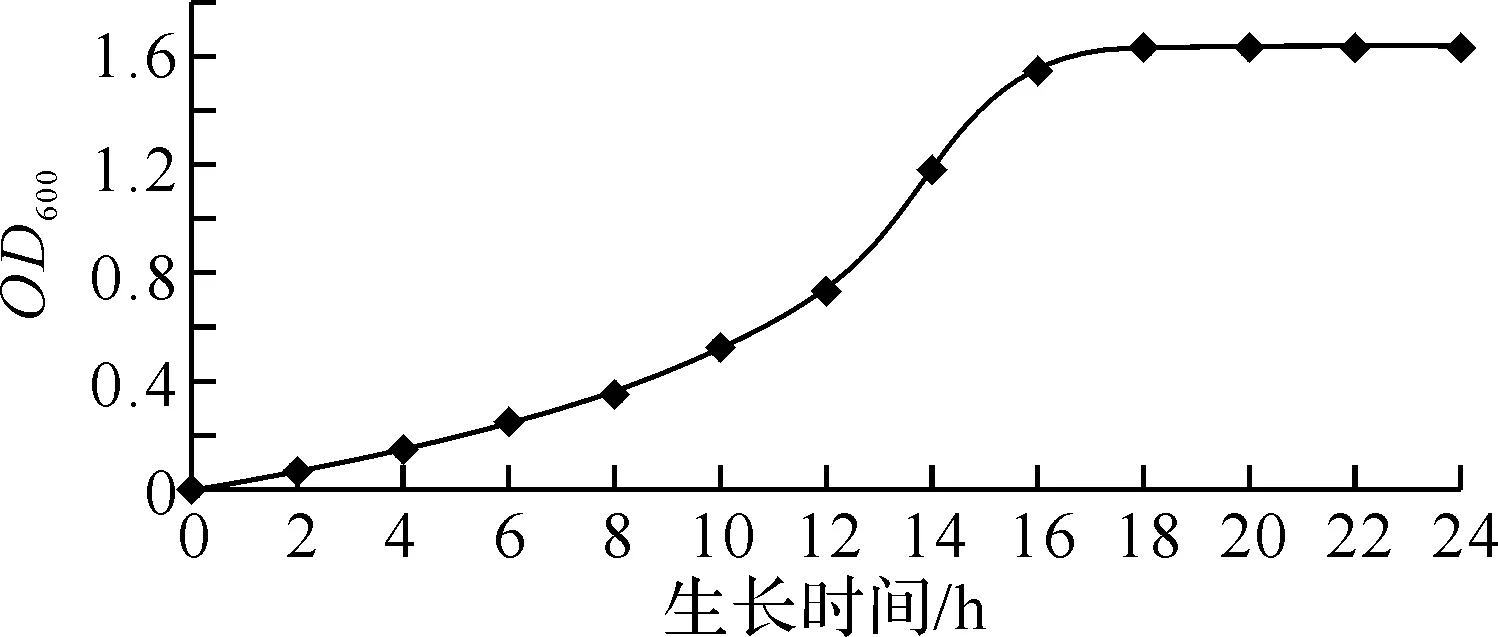
图1 菌株XD-09的生长曲线
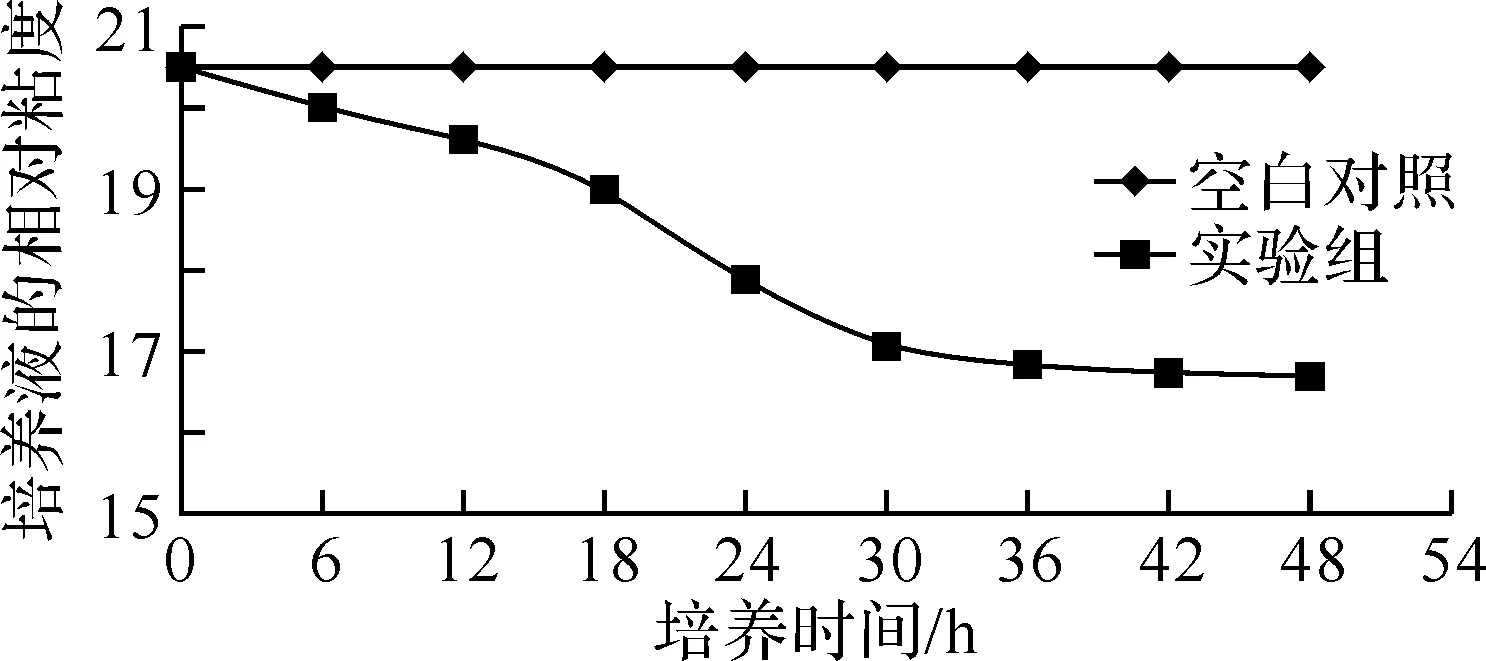
图2 菌株XD-09在培养中的粘度变化
2.3菌株XD-09的菌落形态观察由图3可见,菌株XD-09在黄原胶固体培养基上生长了24 h后,菌落呈圆形不透明状,乳白色,湿润,表面光滑,边缘整齐.
2.4菌株XD-09的革兰氏染色图4所示是菌株经革兰氏染色后在油镜下图像,菌株XD-09经革兰氏染色后,菌体呈蓝紫色,初步确定菌株XD-09为革兰氏阳性菌.
2.5菌株XD-09的芽胞染色如图5所示,在杆状菌体外包着一层绿色的卵圆形芽胞结构,由此表明,菌株XD-09可以产生芽胞.
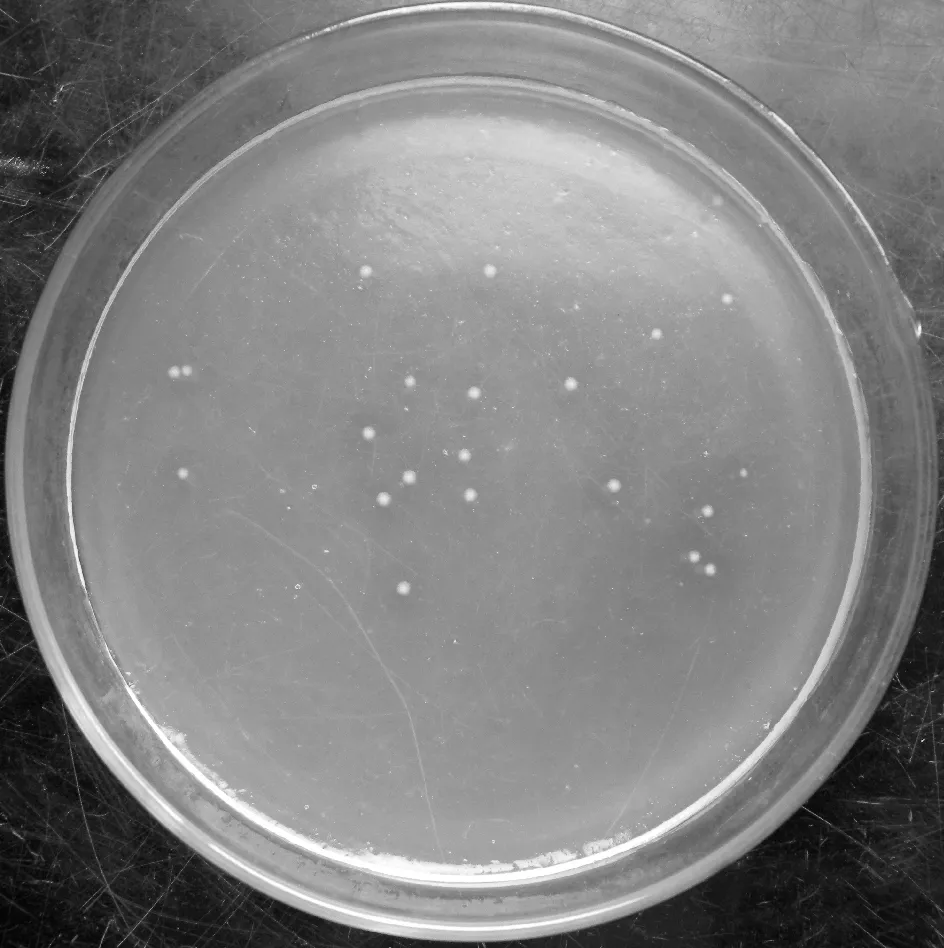
图3 XD-09在黄原胶固体培养基上的生长状况
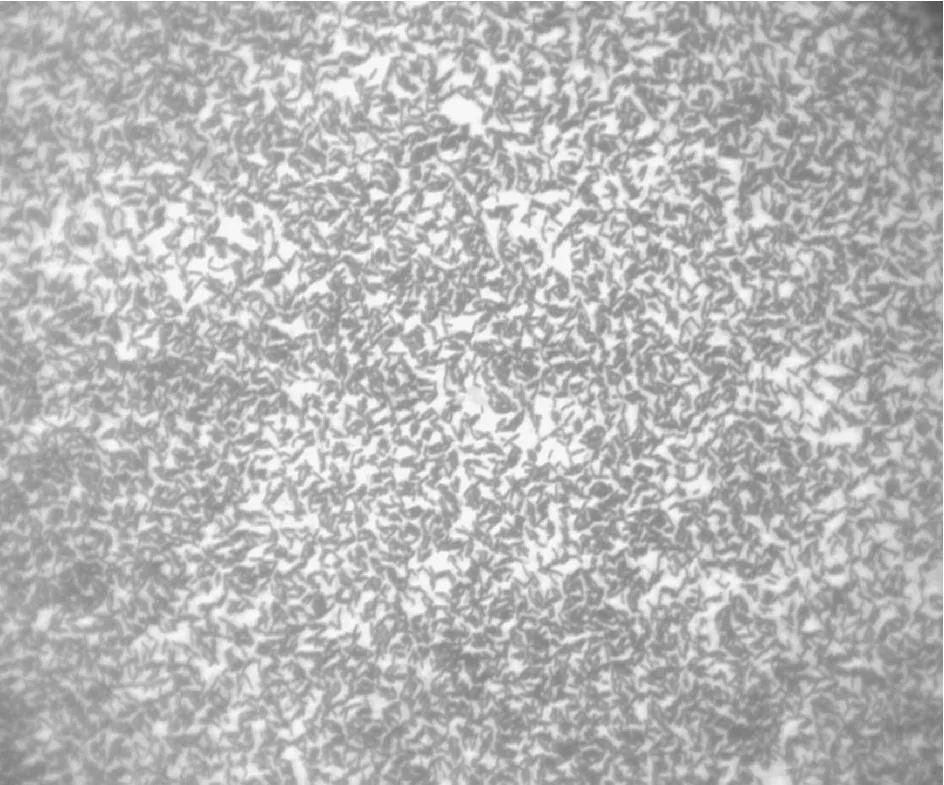
图4 菌株XD-09的革兰氏染色结果(×1 000)

图5 菌株XD-09的芽胞染色(×40)
2.6菌株XD-09的生理生化特征及对碳源氮源的利用菌株XD-09的生理生化试验结果为:明胶液化实验、石蕊牛乳试验、柠檬酸盐利用实验及接触没试验结果为阳性,其他结果为阴性.
菌株的碳源及氮源利用结果为:蔗糖、木糖、麦芽糖、甘露糖、葡萄糖为阳性,其他为阴性;尿素、硝酸钾、氯化铵、酪蛋白为阳性,其他为阴性.
根据菌株形态及生理生化特征等方面的鉴定结果,对照《伯杰细菌鉴定手册》[13]及《常见细菌系统鉴定手册》[14],初步确认该菌株属于芽胞杆菌属(Bacillus).
2.7菌株XD-09的16SrDNA序列分析及系统发育进化树的构建结果抽提菌株XD-09的基因组,并以基因组DNA为模板,扩增出菌株XD-09的16S rDNA片段,琼脂糖凝胶电泳鉴定扩增产物的片段大小约为1 500 bp,该片段大小与预期目的片段大小一致.序列交给上海桑尼生物公司测序.
将测序得到的基因序列进行Blast比对,搜索相匹配的相关序列.搜索结果显示,有14株菌的16S rDNA序列与菌株XD-09具有94%以上的相似性.将这14株菌株作为参比菌株,进行序列比对并绘制系统进化树.从图6可见,菌株XD-09与芽孢杆菌属(Bacillus)的几株细菌聚于一群,且与韦氏芽孢杆菌(BacillusweihenstephanensisstrainDSM11821)的关系最接近[15].

图6 菌株XD-09在系统发育树中的位置
3 结论
1)本实验的菌株XD-09可在以黄原胶为唯一碳源的培养基中生长,并可降低培养液的粘度,由此说明菌株XD-09可对黄原胶进行降解利用.
2)根据菌株XD-09的形态特征及生理生化特征的研究结果,对照《伯杰细菌鉴定手册》及《常见细菌系统鉴定手册》,初步确认该菌株属于芽孢杆菌属.
3)通过菌株16S rDNA序列分析及系统发育进化树的构建,发现菌株XD-09与芽孢杆菌属的几株细菌聚于一群,且与韦氏芽孢杆菌DSM11821在系统进化关系上最接近.
结合菌株的形态特征、生理生化特征及系统发育分析等研究结果,确认菌株XD-09属于芽孢杆菌科的芽孢杆菌属.国内外已有研究报道其他属的可降解黄原胶的菌株,如刘晗等[7]报道的可降解黄原胶的菌为鞘氨醇单胞菌,但本实验确定的菌株XD-09为芽孢杆菌属,且该菌株降解黄原胶的能力较强,可为进一步开展菌株的诱变选育及改良奠定基础.
[1] 聂凌鸿,周如金,宁正祥.黄原胶的特性、发展现状、生产及其应用[J].中国食品添加剂,2003(3):82-85.
[2] Higiro J, Herald T J, Alavi S, et al. Rheological study of xanthan and locust bean gum interaction in dilute solution[J]. Food Res Inr,2006,39:165-175.
[3] 谢俊,梁会珍.黄原胶作为油田驱替剂的性能研究[J].矿物岩石,2003,(32)2:103-107.
[4] 黄成栋,王洪荣,白雪芳,等.黄原胶降解菌的筛选及其降解酶性质的研究[J].微生物学报,2005,32(1):32-37.
[5] 古丽·艾合买提,穆斯塔帕.黄原胶降解菌的筛选及诱变选育[J].新疆农业科学,2008,45(1):79-83.
[6] 易绍金,李炳金,胡凯.黄原胶降解菌的筛选及紫外诱变选育[J].石油天然气学报,2010,32(5):118-120.
[7] 刘晗,刘鹏,崔铁军,等.1株黄原胶降解菌的鉴定[J].西北农业科技大学学报,2006,7(5):81-86.
[8] 古凤才,肖衍繁.基础化学实验教程[M].北京:科学出版社,2001:409-415.
[9] 沈萍,陈向东.微生物学实验[M].北京:高等教育出版社,2007:134-137.
[10] Nankai H, Hashimoto W, Miki H, et al. Microbial system for polysaccharide depolymerisation: enzymatic route for xanthan depolymerisation byBacillussp.Strain GL-1[J]. Appl Environ Microbiol,1999,65:2520-2526.
[11] Nankai H, Hashimoto W, Miki H, et al. Xanthan lyase ofBacillussp.Strain GL-1liberates pyruvylated mannose from Xanthan side chains[J]. Appl Environ Microbiol,2000,66:3765-3768.
[12] 都立辉,刘芳.16S r RNA基因在细菌菌种鉴定中的应用[J].乳业科学与技术,2006(5):207-209.
[13] Holt J. Bergey’s manual of determinative bacterial[M]. Baltimore: Williams and Wilkins,1994.
[14] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[15] Thompson J D, Gibson T J, Plewniak F, et al. The clustal X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Res,2000,24:4876-4882.

