异丙酚联合电休克对抑郁大鼠海马卡配因I-细胞周期依赖性蛋白激酶5通路的影响☆
李晓 闵苏 李炜 罗洁 魏珂 黎平 刘小滨
细胞周期依赖性蛋白激酶5(cyclin-dependent kinase 5,Cdk5)属于脯氨酸限定性丝/苏氨酸细胞周期素依赖性蛋白激酶的家族成员,受激活蛋白p35、p39、p25、p29的调节,近年来研究证实其在突触传递中发挥着重要的作用,与学习记忆关系密切[1,2]。卡配因 I(calpain I)可将 p35 蛋白裂解为p25,p25较p35更稳定,与Cdk5结合后使其活性明显增强[2,3],Zhu等[4]发现在慢性应激诱导的抑郁大鼠模型中Cdk5激酶活性增高。电休克治疗(Electroconvulsive therapy,ECT)是重症抑郁症的一种有效治疗手段,但可引起严重的学习记忆损害[5],而异丙酚联合电休克能够显著减轻ECT引起的学习记忆损害[6,7],但是引起这种保护的作用机制尚不清楚。因此,本研究拟通过观察观察异丙酚联合电休克对抑郁大鼠中海马calpain I-Cdk5通路的影响,探讨异丙酚改善电休克治疗抑郁大鼠致学习记忆损害的分子机制。
1 材料与方法
1.1 动物分组及建模 健康成年雄性SD大鼠50只(由重庆医科大学实验动物中心提供),2~3月龄,体重180~220g,适应性饲养1周。所有大鼠按照随机数字表随机分为5组(n=10):抑郁模型组、异丙酚组、电休克组、异丙酚联合电休克组(简称联合组)、正常对照组。
1.2 研究方法
1.2.1 模型制备和各组的处理 前4组大鼠参照文献[8,9]采用慢性轻度不可预见性应激建立抑郁模型。模型建立成功后,电休克组腹腔注射生理盐水8 mL/kg后给予ECT治疗,ECT采用改良电休克治疗仪(Niviqure technique,印度),参数设置为双相矩形波、波幅0.8A、波宽 1.5ms、125 脉冲/s,以引起强直-阵挛抽搐发作为治疗成功;联合组腹腔注射异丙酚(AstraZeneca,意大利)80mg/kg,待翻正反射消失后给予电休克组相同的电刺激。异丙酚组腹腔注射异丙酚80 mg/kg,抑郁模型组和正常对照组腹腔注射生理盐水8 ml/kg,双耳夹电极但不给予电刺激。以上处理每天1次,连续7d,药物剂量选择和处理方法参照本课题组的前期研究[10]。
1.2.2 行为学评定和学习记忆功能检测 建模前、建模后及治疗后参照文献[7,11]分别采用open-field实验评价抑郁状态和Morris水迷宫检测学习记忆功能。Open-field实验结果以运动活动距离和直立次数表示。Morris水迷宫实验以逃避潜伏期和空间探索时间来表示。逃避潜伏期越短说明学习能力越强,空间探索时间越短表示记忆成绩越差。
1.2.3 样本制备 各组随机选取5只大鼠用0.5%戊巴比妥钠(50mg/kg)麻醉后4%多聚甲醛灌流内固定,切取视交叉后4 mm处至小脑前的脑组织作免疫组化。各组剩余大鼠麻醉后快速断头,分离双侧海马,液氮冻存备用。
1.2.4 免疫组织化学法检测calpain I蛋白的表达采用SABC法检测calpain I蛋白的表达,DAB法显色,PBS液代替一抗calpain I(北京博奥森生物科技)作为阴性对照。每张切片取5个视野,显微镜(Olympus,日本)下观察照相。以Image-Pro Plus 6.0图像分析系统分析海马CA1和CA3区阳性表达区的光密度平均值(mean optical density,MOD)。
1.2.5 Western blot法检测Cdk5蛋白的表达 用细胞裂解液将研磨后的左侧海马组织溶解,用BCA法进行蛋白定量。以SDS-聚丙烯酰胺凝胶电泳分离,转移至PVDF膜,室温下放入含脱脂奶粉的封闭液封闭2 h后,将封闭后的膜加入一抗Cdk5(Santa Cruz),4℃孵育过夜。加入辣根氧化物酶标记的二抗,室温反应1h,ECL显影。采用Quantity One图像分析软件分析目标蛋白Cdk5和内参GAPDH的灰度值。
1.2.6 液闪法检测Cdk5的活性 用细胞裂解液将研磨后的左侧海马组织溶解,加入Cdk5孵育过夜,再加入A-Sepharose使免疫复合物沉淀,离心后用清洗缓冲液将免疫复合物清洗3次,去除上清液。收集到的免疫复合物加入Cdk5缓冲液(其中包括2μg组蛋白H1和 5μCi的32P 标记的γ-ATP溶液),反应终体积为50 μl。在30℃环境下孵育30min,在滤纸上风干脱水,最后用液体闪烁计数器测定产物的CPM值,用该值反应Cdk5活性的大小,该值越大表明Cdk5的活性越高。
1.2.7 RT-PCR法检测calpainⅠ和Cdk5 mRNA的表达 引物根据GenBank提供的模板,由上海鼎安生物技术有限公司合成。按Trizol试剂说明提取右侧海马总RNA,反应体系成分和条件设定均参照逆转录试剂盒进行相应调整。PCR产物以1%琼脂糖凝胶电泳检测,紫外透射灯下观察拍照。用凝胶图像分析系统(Quantity One系统)分析PCR电泳结果,结果以目的基因与GAPDH吸光度的比值表示。
1.3 统计学方法 采用SPSS 18.0进行分析,计量资料以(均数±标准差)表示,组间比较采用方差分析和q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠open-field评分比较 建模前,各组间水平活动距离和直立次数差异无统计学意义(P>0.05);建模后,与正常对照组比较,其余4组水平活动距离和直立次数减少(F=27.56,P<0.01;F=42.56,P<0.01);治疗后,与正常对照组比较,其余4组水平活动距离和直立次数减少,与抑郁模型组比较,电休克组、联合组水平活动距离和直立次数增加(F=27.82,P<0.01;F=39.99,P<0.01),抑郁模型组与异丙酚组之间的水平活动距离和直立次数差异无统计学意义(P>0.05)。见表1。
2.2 各组大鼠Morris水迷宫学习记忆成绩比较 建模前,各组间逃避潜伏期及空间探索时间差异无统计学意义(P>0.05);建模后,与正常对照组比较,其余4组逃避潜伏期延长、空间探索时间缩短(F=8.54,P<0.01;F=10.34,P<0.01);治疗后,与正常对照组比较,其余4组逃避潜伏期延长、空间探索时间缩短;与抑郁模型组比较,电休克组逃避潜伏期延长、空间探索时间缩短,抑郁模型组与异丙酚组、联合组之间的逃避潜伏期和空间探索时间差异无统计学意义(P>0.05),与电休克组比,联合组逃避潜伏期缩短、空间探索时间延长(F=53.23,P<0.01;F=40.33,P<0.01)。见表2。
表1 大鼠open-field评分比较()

表1 大鼠open-field评分比较()
1)与对照组比较,经q检验,P<0.052)与抑郁模型组比较,经q检验,P<0.053)与异丙酚组比较,经q检验,P<0.05
建模前 建模后 治疗后组别n 水平活动距离(cm)直立次数(次)水平活动距(cm)直立次数(次)水平活动距离(cm)直立次数(次)抑郁模型组异丙酚组电休克组异丙酚联合电休克组对照组1010101010761.87±114.90753.94±131.96756.51±157.25746.50±119.92741.74±105.9117.60±2.9917.50±3.0618.00±3.5616.90±3.0016.90±2.28316.80±99.381)312.30±97.231)292.33±97.181)309.10±102.541)692.32±120.654.50±2.461)4.90±2.031)4.30±2.981)3.50±2.461)17.30±3.86314.24±102.151)300.69±84.081)506.73±108.911)2)3)507.21±105.201)2)3)726.82±119.234.40±2.321)4.60±1.901)9.90±2.961)2)3)10.70±2.161)2)3)16.90±3.28
表2 大鼠Morris水迷宫学习记忆成绩比较()
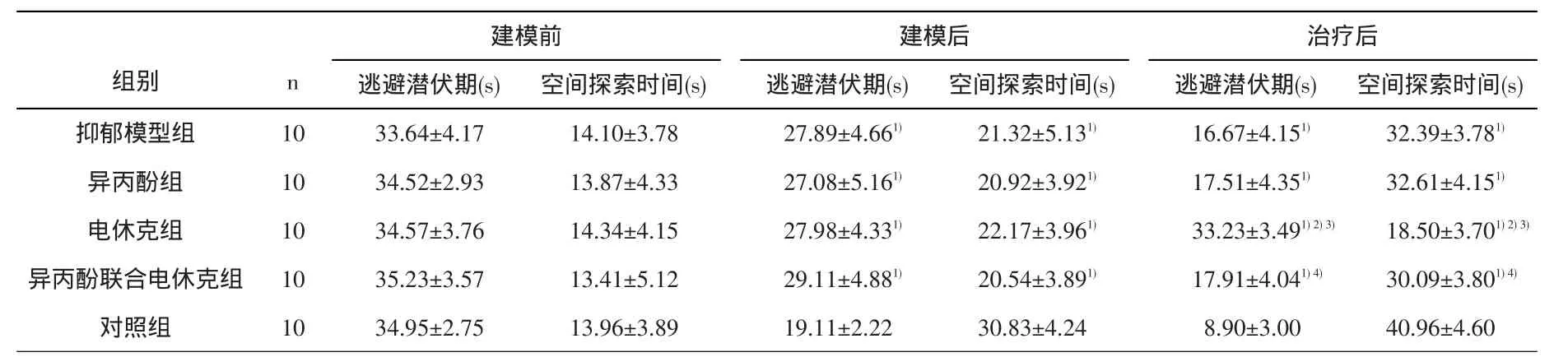
表2 大鼠Morris水迷宫学习记忆成绩比较()
1)与对照组比较,经q检验,P<0.052)与抑郁模型组比较,经q检验,P<0.053)与异丙酚组比较,经q检验,P<0.054)与电休克组比较,经q检验,P<0.05
组别抑郁模型组异丙酚组电休克组异丙酚联合电休克组对照组n 1010101010建模前逃避潜伏期(s)33.64±4.1734.52±2.9334.57±3.7635.23±3.5734.95±2.75空间探索时间(s)14.10±3.7813.87±4.3314.34±4.1513.41±5.1213.96±3.89建模后逃避潜伏期(s)27.89±4.661)27.08±5.161)27.98±4.331)29.11±4.881)19.11±2.22空间探索时间(s)21.32±5.131)20.92±3.921)22.17±3.961)20.54±3.891)30.83±4.24治疗后逃避潜伏期(s)16.67±4.151)17.51±4.351)33.23±3.491)2)3)17.91±4.041)4)8.90±3.00空间探索时间(s)32.39±3.781)32.61±4.151)18.50±3.701)2)3)30.09±3.801)4)40.96±4.60
表3 大鼠海马calpain I与Cdk5的蛋白表达、mRNA表达和Cdk5活性()

表3 大鼠海马calpain I与Cdk5的蛋白表达、mRNA表达和Cdk5活性()
1)与对照组比较,经q检验,P<0.052)与抑郁模型组比较,经q检验,P<0.053)与异丙酚组比较,经q检验,P<0.054)与电休克组比较,经q检验,P<0.05
calpain I Cdk5组别抑郁模型组异丙酚组电休克组异丙酚联合电休克组对照组n 5 5 5 5 5 CA1区平均光密度值0.13±0.031)0.15±0.041)0.20±0.031)2)3)0.15±0.031)4)0.11±0.03 CA3区平均光密度值0.17±0.041)0.16±0.031)0.22±0.031)2)3)0.17±0.031)4)0.13±0.03 mRNA相对表达量0.54±0.021)0.55±0.031)0.82±0.051)2)3)0.58±0.021)4)0.32±0.02蛋白相对表达量0.50±0.070.49±0.061.13±0.051)2)3)0.76±0.051)2)3)4)0.51±0.03 CPM值3148.42±196.651)3145.95±158.511)5770.24±202.261)2)3)3272.92±137.571)4)1966.92±155.67 mRNA相对表达量0.37±0.030.35±0.020.63±0.031)2)3)0.46±0.011)2)3)4)0.36±0.02
2.3 各组大鼠海马内calpain I与Cdk5的蛋白和mRNA表达及Cdk5活性的比较 与正常对照组比较,其余4组calpain I蛋白和mRNA表达增加、Cdk5活性升高(CA1区:F=28.97,P<0.01,CA3区:F=28.25,P<0.01;F=160.08,P<0.01;F=329.58,P<0.01),仅电休克组、联合组Cdk5蛋白和mRNA表达增加(F=139.40,P<0.01;F=126.51,P<0.01);与抑郁模型组比较,电休克组calpain I和Cdk5蛋白表达及mRNA表达均增加、Cdk5活性升高,联合组Cdk5蛋白和mRNA表达增加(P<0.05);与电休克组比较,联合组calpain I和Cdk5蛋白表达及mRNA表达减少,Cdk5活性降低(P<0.05)。见表3,图1、2、3。
3 讨论
慢性轻度不可预见性应激(Chronic unpredictable mild stress,CUMS)方法建立抑郁模型广泛应用于抑郁症机制的研究,能够有效的模拟人类环境应激所导致的抑郁症[12]。Open-field实验可以反映动物在新环境中的探索能力和兴奋程度,能辅助评定动物的抑郁状态。Morris水迷宫是评价动物学习记忆能力的经典方法,主要反映动物的空间学习记忆能力。本实验的研究结果发现,建模后大鼠的open-field评分明显下降,提示抑郁模型是建立成功的;治疗后,电休克组和联合组对新环境的探索能力和兴奋程度得到了明显改善,说明单纯电休克和异丙酚联合电休克都可以有效地缓解抑郁症状,而异丙酚组大鼠行为学和抑郁模型组没有统计学差异,说明单纯异丙酚对抑郁大鼠没有治疗作用。同时,本研究发现电休克组大鼠的逃避潜伏期比联合组延长,空间探索时间缩短,而抑郁模型组、异丙酚组和联合组的逃避潜伏期和空间探索时间无差异,表明单纯电休克处理引起了抑郁大鼠学习记忆的损害,而异丙酚可以减轻单纯电休克处理对抑郁大鼠学习记忆的损害,这与本课题组的前期研究是一致的[6,7]。

图1 大鼠海马CA1区(A1-E1)和CA3区(A2-E2)CalpainⅠ的表达(SABC法免疫组化染色,DAB显色,标尺50μm)A:对照组;B:抑郁组;C:单纯异丙酚组;D:单纯电休克组;E:异丙酚联合电休克组

图2 大鼠海马Cdk5蛋白的表达(Western-blot法)
Cdk5高表达于外周和中枢神经系统中,特别是海马的锥体细胞和皮层神经元等一些大神经元,单体Cdk5无活性,它的激活依赖于激活蛋白p35和p39[13]。研究表明,在一些刺激因素如炎症、氧化应激和兴奋性毒性刺激促使细胞内钙离子增加的情况下,二者可被calpain裂解为半衰期更长的p25和p29[14],使Cdk5的活性增加。本研究发现,与抑郁模型组比较,电休克组大鼠海马calpain I和Cdk5蛋白及mRNA表达增加、Cdk5活性升高,提示电刺激可引起细胞内钙离子增加,进而导致上述指标变化。
目前的研究认为,LTP是学习记忆的神经基础,其产生主要依赖于海马NMDA-NR2B受体的激活[15]。Hawasli等[16]的研究发现,Cdk5 可通过与NMDA受体亚基的相互作用影响NR2A的磷酸化或NR2B在细胞膜上的表达。也有研究表明,抑制Cdk5的活性后通过Src激酶与PSD-95的结合可增加NMDA受体NR2B亚基第1472位酪氨酸的磷酸化,从而减少NR2B亚基的内吞,增加其在细胞膜上的表达[17]。Chen等的研究发现重复的电刺激可导致Cdk5基因的表达上调[18]。本研究中单纯的电休克处理不仅增加了calpain I和Cdk5的蛋白表达及mRNA表达,同时使Cdk5的活性显著升高,虽然有效缓解了大鼠的抑郁状态,使大鼠的行为学指标得到了明显改善,但是其引起的兴奋性神经毒性作用可能造成了钙离子的内流,活化calpain I和Cdk5,最终使海马LTP上调至饱和状态,造成学习记忆的严重损害[19]。
在本研究中,异丙酚联合电休克处理抑郁大鼠后发现,与电休克组比较,calpain I和Cdk5的蛋白表达及mRNA表达减少,Cdk5活性降低,提示异丙酚抑制了calpain I和Cdk5蛋白表达。Hans等研究认为异丙酚能够减弱NMDA受体介导的神经毒性与其抑制了谷氨酸触发的细胞内钙离子浓度增加有关[20],这可能是异丙酚联合电休克后使calpain I和Cdk5向正常方向变化的原因。
结合本研究的结果,单纯的电休克处理会导致大鼠海马calpain I-Cdk5通路上calpain I和Cdk5的蛋白表达及mRNA表达增加、Cdk5活性升高,这些表达的异常可最终影响LTP,造成突触可塑性的变化,引起学习记忆损害。异丙酚减轻大鼠电休克处理后学习记忆损害,可能与其在一定程度上抑制了calpain I和Cdk5的表达及Cdk5的活性有关。本实验中在研究calpain I-Cdk5通路时未采用calpain I抑制剂来进一步验证此通路,存在一定的局限性。综上所述,异丙酚减轻抑郁大鼠电休克处理后学习记忆损害,其机制可能与异丙酚降低了电休克处理后calpain I-Cdk5通路的表达有关。
[1]李培培,张丽丽,李敏.Cdk5在突触可塑性和学习记忆中的作用[J].中国神经精神疾病杂志,2009,35(3):188-190.
[2]Barnett DG,Bibb JA.The role of Cdk5 in cognition and neuropsychiatric and neurological pathology[J].Brain Res Bull,2011,85(1-2):9-13.
[3]Hisanaga S,Endo R.Regulation and role of cyclin-dependent kinase activity in neuronal survival and death[J].J Neurochem,2010,115(6):1309-1321.
[4]Zhu WL,Shi HS,Wang SJ,et al.Increased Cdk5/p35 activity in the dentate gyrus mediates depressive-like behaviour in rats[J].Int J Neuropsychopharmacol,2011:1-15.
[5]Lisanby SH.Electroconvulsive therapy for depression[J].N Engl J Med,2007,357(19):1939-1945.
[6]Dong J,Min S,Wei K,et al.Effects of electroconvulsive therapy and propofol on spatial memory and glutamatergic system in hippocampus of depressed rats[J].J ECT,2010,26(2):126-130.
[7]刘媛媛,闵苏,董军,等.无抽搐电休克对抑郁大鼠学习记忆功能的影响及其突触可塑性机制[J].中国神经精神疾病杂志,2010,36(2):70-74.
[8]Banasr M,Valentine GW,Li XY,et al.Chronic unpredictable stress decreases cell proliferation in the cerebral cortex of the adult rat[J].Biol Psychiatry,2007,62(5):496-504.
[9]刘永峰,闵苏,董军,等.无抽搐电休克治疗大鼠抑郁症与海马γ-氨基丁酸通路的关系[J].中国神经精神疾病杂志,2009,35(4):238-241.
[10]刘媛媛,闵苏,董军,等.不同剂量异丙酚联合电休克对抑郁大鼠海马突触素表达的影响[J].中华麻醉学杂志,2010,30(1):22-25.
[11]Luo DD,An SC,Zhang X.Involvement of hippocampal serotonin and neuropeptide Y in depression induced by chronic unpredicted mild stress[J].Brain Res Bull,2008,77(1):8-12.
[12]Zheng S,Yu M,Lu X,et al.Urinary metabonomic study on biochemical changes in chronic unpredictable mild stress model of depression[J].Clin Chim Acta,2010,411(3-4):204-209.
[13]Cruz JC,Tseng HC,Goldman JA,et al.AberrantCdk5 activation by p25 triggerspathologicaleventsleading to neurodegeneration and neurofibrillary tangles[J].Neuron,2003,40(3):471-483.
[14]Kusakawa G,Saito T,Onuki R,et al.Calpain-dependent proteolytic cleavage of the p35 cyclin-dependent kinase 5 activator to p25[J].J Biol Chem,2000,275(22):17166-17172.
[15]Foster KA,McLaughlin N,Edbauer D,et al.Distinct roles of NR2A and NR2B cytoplasmic tails in long-term potentiation[J].J Neurosci,2010,30(7):2676-2685.
[16]Hawasli AH,Benavides DR,Nguyen C,et al.Cyclin-dependent kinase 5 governs learning and synaptic plasticity via control of NMDAR degradation[J].Nat Neurosci,2007,10(7):880-886.
[17]Zhang S,Edelmann L,Liu J,et al.Cdk5 regulates the phosphorylation oftyrosine 1472 NR2B and the surface expression ofNMDA receptors[J].JNeurosci,2008,28(2):415-424.
[18]Chen J,Zhang Y,Kelz MB,et al.Induction of cyclin-dependent kinase 5 in the hippocampus by chronic electroconvulsive seizures:role of[Delta]FosB[J].J Neurosci,2000,20(24):8965-8971.
[19]Bazan NG. Synaptic lipid signaling: significance of polyunsaturated fatty acids and platelet-activating factor[J].J Lipid Res,2003,44(12):2221-2233.
[20]Hans P,Bonhomme V,Collette J,et al.Propofol protects cultured rat hippocampal neurons against N-methyl-D-aspartate receptor-mediated glutamate toxicity[J].J Neurosurg Anesthesiol,1994,6(4):249-253.

