哺乳动物正呼肠孤病毒反向遗传学研究进展
柯飞 王赟 侯丽芳 胡兴安 李佩佩
(河南城建学院生命科学与工程学院,平顶山 467036)
呼肠孤病毒(Reovirus)广泛存在于自然界中,从最高等的脊椎动物人类到非脊椎动物、植物、真菌等物种中都有此病毒分布,是目前已知分布范围最广的病毒之一,与许多疾病有关,且其独特的多节段双链RNA 基因组使其成为研究病毒基因组复制及遗传变异的好材料。根据国际病毒分类委员会第七次报告,正呼肠孤病毒属共有4 个成员,分3 个亚群:第一个亚群包括非融合基因哺乳动物正呼肠孤病毒(Mammalian orthoreovirus,MRV);第二个亚群为融合基因正呼肠孤病毒,包括禽呼肠孤病毒(Avian reovirus,ARV)和从飞狐(Flying fox)分离到的内尔森海湾病毒(Nelson bBay reovirus,NBV);第三个亚群包括从狒狒体内分离到的呼肠孤病毒(Baboon orthoreovirus,BRV)。从蛇体内分离到的两株呼肠孤病毒暂且将其归为第VI 亚群[1]。哺乳动物正呼肠孤病毒(MRV)主要感染哺乳动物的呼吸道和肠道。其中人类呼肠孤病毒的感染多数是不显性的或者只有轻微的症状,但某些呼肠孤病毒可引起人的呼吸道和胃肠道疾病,而MRV 在小鼠等动物中引起明显感染症状,包括中枢神经系统、心脏及肝脏损伤。MRV 的基因组为线性、双链、分节段的RNA,病毒核酸由10 个RNA 节段组成,大小从约1-4 kb,编码11 个蛋白[2]。
反向遗传学(Reverse genetics)是相对经典遗传学而言的,即直接从生物体的遗传物质入手,通过对遗传物质的加工和修饰来改变生物体的性状,从而研究遗传物质的改变与生物性状的关系,相关技术统称为反向遗传学技术。反向遗传学技术已应用到许多病毒的研究中,通过改变病毒的核酸,观察相应的性状改变,从而研究病毒基因组的结构与功能、复制机制及致病机理等。近10 年来,MRV的反向遗传学技术逐步完善并取得了许多研究进展。本文试图对MRV 反向遗传学操作技术的建立过程及运用该技术取得的最新成果作一简要综述。
1 MRV 反向遗传学操作技术
由于MRV 基因组由多个节段组成,比较复杂,给遗传操作带来了难度,因而MRV 的反向遗传学研究开始的较晚。Roner 等[3]于2001 年建立了MRV 的第一个反向遗传学系统(基于MRV 感染性RNA 的反向遗传学技术),他们将氯霉素转乙酰酶(Chloramphenicol transacetylase,CAT)基因插入ST3 型MRV S2 节段,体外获得CAT-S2 节段后,与基因组其余9 种节段同时转入表达S2 编码蛋白的L 细胞,在ST2 型MRV 病毒的帮助下,获得表达CAT 蛋白的重组ST3 型MRV 病毒。而Kobayashi 等[4]进一步发展了MRV 的反向遗传学技术(基于质粒的MRV 反向遗传学技术),他们将MRV 的10 个基因组节段都构建成重组质粒,将这10 个质粒同时转染到细胞内,在T7 RNA 聚合酶的作用下,成功获得了MRV 病毒。下面分别对这两种方法的基本原理和操作步骤作一概述。
1.1 基于MRV感染性RNA的反向遗传学技术
Roner 等[5]于1990 年发现体外转染的MRV dsRNA 或者ssRNA 能在辅助病毒的帮助下产生病毒粒子,因而也将MRV 基因组RNA 称为感染性RNA。在此基础上,发展了基于感染性RNA 的反向遗传学系统,主要操作步骤见图1。
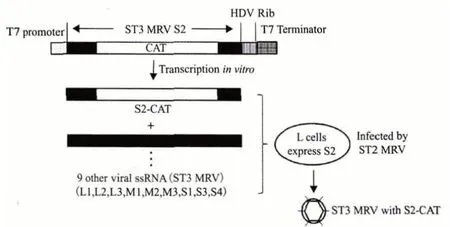
图1 基于MRV 感染性RNA 的反向遗传学技术示意图
1.1.1 构建插入CAT 基因的重组ST3 型MRV S2 基因组片段 CAT 基因被选择作为外源基因。首先以ST3 型MRV 基因组为模板,扩增得到S2 节段的cDNA,然后使用CAT 基因(752 bp)替换S2 节段199-1 046 区域的核酸序列。下一步将获得的S2-CAT 杂合片段连接在T7 启动子序列的3'端,同时在S2-CAT 的5'端连接HDV 核酶序列和T7 终止子序列。最后将获得的片段插入pUC18 载体,得到重组质粒pS2-CAT13。
1.1.2 获得感染性RNA 包括获得ST3 型MRV 的基因组dsRNA(除去S2)和S2-CAT RNA。
提取纯化ST3 型MRV 的病毒粒子,去除衣壳蛋白,得到病毒核酸。然后合成与S2 部分序列互补的寡核苷酸,并与得到的ssRNA 杂交,使用RNaseH 处理杂交后的混合物,其中的S2 由于杂交了互补序列,呈双链形式,因而被RNaseH 水解,余下其他9 条ST3 型MRV ssRNA 节段。
另外使用体外蛋白合成系统(兔网织红细胞裂解物)处理重组质粒pS2-CAT13,在系统具有的T7 RNA 聚合酶作用下,生成S2-CAT RNA。
1.1.3 获得重组病毒 将上述获得的9 条ST3 型MRV ssRNA 节段与S2-CAT 节段混合,转染到表达σ2 蛋白的L929 细胞中,然后感染ST2 型MRV 作为辅助病毒。5 d 后收集感染细胞,分离重组的ST3 型MRV。
1.2 基于质粒的MRV反向遗传学技术
Kobayashi 等[4]构建了包含MRV 所有基因组节段的重组质粒,利用这些质粒建立了新的MRV 反向遗传学系统,其主要步骤见图2。
图2 基于质粒的MRV 反向遗传学技术示意图
1.2.1 构建插入MRV 基因组节段的重组质粒 以MRV 基因组核酸为模板,通过RT-PCR 扩增得到所有10 个节段的全长cDNA,并通过引物设计在每段cDNA 的5'端连接上T7 启动子序列,3'端连接HDV 核酶序列,最后将得到的杂合片段插入载体构建成重组质粒。
1.2.2 获得重组病毒 将上述获得的10 个重组质粒同时转入小鼠成纤维(L929)细胞,然后感染rDIs-T7pol(表达T7RNA 聚合酶的重组痘苗病毒)。在rDIs-T7pol 提供的T7RNA 聚合酶的作用下,重组质粒开始转录,由于HDV 核酶序列的存在,使得转录的序列自我剪切得到与野生型病毒一致的3'端。可产生与野生型序列一致的10 条ssRNA,然后这10条ssRNA 开始翻译,表达蛋白质,启动病毒的装配与复制。一般在痘苗病毒感染24 h 后就可以检测到MRV 病毒粒子的出现。
1.2.3 基于质粒的MRV 反向遗传学系统的优化 采用上述系统,当同时转染这10 个质粒的时候,重组病毒的出现率是比较低的,24 h 的成功率大约为2-3个/106细胞。可能有两个原因产生这种结果:①能全部拥有10 个质粒的细胞的百分比太小;②从质粒直接转录的RNA 不包括5'端,并且这些RNA 的转录效率比病毒直接生成的RNA 的转录效率低。后来,Kobayashi 等[6]进一步优化了这个系统,即减少质粒的数量,将多个基因合并成单一的质粒。最终用于转染的质粒为4 个。与10 个质粒系统相比,病毒恢复的效率增加了很多。
另外,为了消除rDIs-T7 pol 的影响,在BHK(幼仓鼠肾细胞)细胞中转入T7RNA 聚合酶基因,筛选得到稳定表达T7RNA 聚合酶的BHK 细胞系BHKT7。利用这种细胞系进行MRV 的反向遗传学操作,也获得了较好的效果。
2 MRV 反向遗传技术的应用
哺乳动物正呼肠孤病毒的结构蛋白包括λ3(由L1 编码)、λ2(L2)、λ1(L3)、μ2(M1)、μ1(M2)(多数为断裂的片段μ1N 和μ1C)、σ1(S1)、σ2(S2)和σ3(S4)。其中,外壳蛋白由λ2、μ1、σ1 和σ3 组成,λ2 具有脒基转移酶功能,μ1 与转录激活有关,σ1具有细胞吸附、血凝素和血清型决定簇的作用,σ3可与dsRNA 结合具有转录后翻译功能[2]。MRV 反向遗传技术已应用于其基因组包装、病毒粒子吸附、病毒粒子稳定性、致病机制及细胞嗜性等方面的研究。
2.1 MRV基因组包装信号
MRV 基因组的10 个节段均具有相同的5'和3'末端残基,相同的末端可能是不同序列能够包装进同一病毒粒子的信号。Roner 等[7]利用基于RNA感染性的反向遗传体系研究了5'端的包装信号,将MRV S2 节段的中间部分序列用CAT 基因代替,然后检测S2-CAT 能否被包装进MRV 病毒粒子,结果发现S2 5'端的96 个核苷酸影响S2-CAT 序列的包装,而其中第79-81 位的3 个核苷酸是必需的。另外,通过构建MRV M1 节段部分序列替换的M1-CAT 病毒,以及对M1 和S2 的末端序列进行交换重组,将MRV 的包装信号定位在基因组RNA 的5'端序列而不是3'端序列[8]。
2.2 MRV与细胞表面受体的吸附作用
MRV σ1 蛋白已被证明是细胞吸附蛋白,用来与细胞表面作为病毒受体的糖蛋白分子结合。利用基于质粒的反向遗传学系统,Reiter 等[9]发现σ1蛋白的第198 和202-205 位氨基酸残基对于其吸附细胞表面分子是必需的。同时,对σ1 蛋白的结构生物学测定表明,σ1 拥有一个具有头尾的延伸三聚体构型,其具有3 个结构域,3 个结构域之间由柔性区域(Inter-domain regions,IDRs)连接。Bokiej 等[10]进一步构建了σ1 各功能区域缺失的重组病毒,分析了σ1 各功能区对病毒吸附及复制的影响。结果发现,σ1 的长度对于其吸附到细胞表面非常重要,IDR1和IDR2 区域分别在σ1 蛋白的稳定组装和病毒复制中的后脱壳过程中发挥作用。另外,Frierson 等[11]利用第202 位氨基酸残基突变的MRV-σ1R202W 重组病毒研究了细胞表面受体对于MRV 致病的重要性,MRV-σ1R202W 只能结合到细胞表面的连接黏附分子JAM-A,而不能结合到其他受体,如碳水化合物等。与野生型相比,此病毒感染小鼠后,在神经系统中的滴度和毒力都大为降低,表明细胞表面的碳水化合物受体在病毒的神经毒力方面具有重要作用。
2.3 MRV病毒粒子衣壳的稳定性
MRV 病毒粒子进入细胞后需要经历的过程是衣壳蛋白的解聚。在这个过程中,外衣壳蛋白σ3 最先受到细胞内蛋白酶的裂解。不同分离株对蛋白酶的敏感性不一样。Doyle 等[12]构建了σ3 上不同位点突变的重组病毒,系统研究了不同位点突变后病毒粒子对蛋白酶的敏感性。结果发现,σ3 上第198 位、233 位、347 位和354 位氨基酸残基突变后,病毒粒子对蛋白酶的敏感性各不相同,且第198 位突变可以回复第354 位突变的影响,表明MRV σ3 的裂解及衣壳的稳定受到一个氨基酸残基网络的影响。
2.4 MRV的致病机制
MRV 感染机体的一个显著症状是心肌炎的出现,而干扰素治疗可以缓解这种症状。MRV 不同分离株诱导机体产生干扰素的能力不同,因而导致机体心肌病变的能力也不一样。Irvin 等[13]利用基于质粒的反向遗传技术对MRV μ2 蛋白上的氨基酸残基进行了缺失、替换或突变,突变后的病毒感染细胞和小鼠。μ2 蛋白第208 位氨基酸残基突变的MRV抑制干扰素β 产生的能力减弱,进而影响病毒的复制、扩散和病毒造成的心肌病变。
σ1s 是MRV S1 节段编码的一个非结构蛋白,其功能一直未知。Boehme 等[14]将编码σ1s 基因的起始密码子突变,从而得到了不表达σ1s 的重组MRV(σ1s-null)。将野生型和σ1s-null 的MRV 分别感染小鼠,两种病毒均可以在小鼠肠道中复制,但σ1s-null MRV 不能传播到病毒次轮复制的位置,包括脑、心脏和肝脏,进一步检测显示σ1s-null MRV不能到达肠系膜淋巴结,从而不能进入血液系统。这些结果表明σ1s 蛋白对于病毒从宿主的肠道进入血液,从而建立全身性的感染至关重要。进一步通过σ1s-null MRV 的研究显示,σ1s 对于MRV 的血液传播是必需的,但对于病毒在神经系统的传播不是必需的[15]。已有研究表明,MRV μ1 蛋白是MRV穿透细胞膜,引起细胞凋亡的影响因子,Danthi 等[16]利用基于质粒的反向遗传系统构建了μ1 蛋白关键区域突变的重组病毒。μ1 蛋白φ 区域突变后的病毒透过细胞膜的能力大大减弱,进而导致细胞凋亡的能力也受到影响。这种突变病毒在小鼠体内感染时,病毒引起的神经毒性也大为减弱,进一步凸显了μ1蛋白φ 区域在病毒毒力上的重要性。
2.5 MRV的细胞嗜性
MRV 的不同分离株具有不同的细胞嗜性(Cell tropism),即不同的分离株在同一细胞中展现出不一样的感染性、复制时间或细胞病变。造成这种现象的分子机制一直不清楚。Ooms 等[17]利用反向遗传技术研究了这种现象,将1 型(T1L)和3 型(T3D)MRV 进行基因组节段的互相组合,结果发现,病毒编码的复制蛋白μ2 和RNA 依赖的RNA 聚合酶λ3与这种现象有关,并且μ2 蛋白第347 位氨基酸残基对病毒的复制效率非常重要,说明MRV 不同分离株的细胞嗜性可能是由病毒复制能力的细胞特异性所决定的。
3 结语
综上所述,MRV 反向遗传技术的开发成功对MRV 的相关研究起到了巨大的推动作用,在病毒结构、基因功能及致病机制方面已经积累了若干研究资料。可以预见,反向遗传技术必将为MRV 的研究带来更深入的进展。
另外,MRV 反向遗传技术的成功开发必将为其他呼肠孤病毒相应技术的研究带来启示。如与MRV同属正呼肠孤病毒的禽呼肠孤病毒,其对禽类养殖带来危害,至今未见禽呼肠孤病毒反向遗传技术的报道。还有对我国水产养殖造成很大危害的水生呼肠孤病毒(与MRV 具有很高的进化相关性),也未见反向遗传技术的运用。若能将反向遗传技术运用到这两类病毒的研究中,将会对相关病毒的致病机理和预防控制等方面起到巨大的推动作用,从而服务于禽类及水产养殖。
[1] 张云, 刘明, 欧阳岁东, 童光志.正呼肠孤病毒及其分类学依据研究进展[J].动物医学进展, 2004, 25(6):46-49.
[2] King AMQ, Carstens E, Adams M, et al. Virus Taxonomy, 9th Report of the ICTV[M]. London:Elsevier/Academic Press, 2011, 541-637.
[3] Roner MR, Joklik WK. Reovirus reverse genetics:Incorporation of the CAT gene into the reovirus genome[J]. Proc Natl Acad Sci USA, 2001, 98(14):8036-8041.
[4] Kobayashi T, Antar AA, Boehme KW, et al. A plasmid-based reverse genetics system for animal double-stranded RNA viruses[J]. Cell Host Microbe, 2007, 1(2):147-157.
[5] Roner MR, Sutphin LA, Joklik WK. Reovirus RNA is infectious[J]. Virology, 1990, 179(2):845-852.
[6] Kobayashi T, Ooms LS, Ikizler M, et al. An improved reverse genetics system for mammalian orthoreoviruses[J]. Virology, 2010, 398(2):194-200.
[7] Roner MR, Bassett K, Roehr J. Identification of the 5'sequences required for incorporation of an engineered ssRNA into the Reovirus genome[J]. Virology, 2004, 329(2):348-360.
[8] Roner MR, Steele BG. Localizing the reovirus packaging signals using an engineered m1 and s2 ssRNA[J]. Virology, 2007, 358(1):89-97.
[9] Reiter DM, Frierson JM, Halvorson EE, et al. Crystal structure of reovirus attachment protein σ1 in complex with sialylated oligosaccharides[J]. PLoS Pathog, 2011, 7(8):e1002166.
[10] Bokiej M, Ogden KM, Ikizler M, et al. Optimum length and flexibility of reovirus attachment protein σ1 are required for efficient viral infection[J]. J Virol, 2012, 86(19):10270-10280.
[11] Frierson JM, Pruijssers AJ, Konopka JL, et al. Utilization of sialylated glycans as coreceptors enhances the neurovirulence of serotype 3 reovirus[J]. J Virol, 2012, 86(24):13164-13173.
[12] Doyle JD, Danthi P, Kendall EA, et al. Molecular determinants of proteolytic disassembly of the reovirus outer capsid[J]. J Biol Chem, 2012, 287(11):8029-8038.
[13] Irvin SC, Zurney J, Ooms LS, et al. A single-amino-acid polymorphism in reovirus protein μ2 determines repression of interferon signaling and modulates myocarditis[J]. J Virol, 2012, 86(4):2302-2311.
[14] Boehme KW, Guglielmi KM, Dermody TS. Reovirus nonstructural protein sigma1s is required for establishment of viremia and systemic dissemination[J]. Proc Natl Acad Sci USA, 2009, 106(47):19986-19991.
[15] Boehme KW, Frierson JM, Konopka JL, et al. The reovirus sigma1s protein is a determinant of hematogenous but not neural virus dissemination in mice[J]. J Virol, 2011, 85(22):11781-11790.
[16] Danthi P, Coffey CM, Parker JS, et al. Independent regulation of reovirus membrane penetration and apoptosis by the μ1 φ domain[J]. PLoS Pathog, 2008, 4(12):e1000248.
[17] Ooms LS, Kobayashi T, Dermody TS, Chappell JD. A postentry step in the mammalian orthoreovirus replication cycle is a determinant of cell tropism[J]. J Biol Chem, 2010, 285(53):41604-41613.

