L-苹果酸生物合成研究进展
吴军林,吴清平*,张菊梅,张 文,莫树平,柏建玲
(1.广东省微生物研究所,省部共建华南应用微生物国家重点实验室,广东省微生物菌种保藏与应用重点实验室,广东省微生物新技术公共实验室,广东 广州 510070;2.广东环凯微生物科技有限公司,广东 广州 510643)
L-苹果酸生物合成研究进展
吴军林1,2,吴清平1,*,张菊梅1,张 文2,莫树平1,柏建玲1
(1.广东省微生物研究所,省部共建华南应用微生物国家重点实验室,广东省微生物菌种保藏与应用重点实验室,广东省微生物新技术公共实验室,广东 广州 510070;2.广东环凯微生物科技有限公司,广东 广州 510643)
L-苹果酸是生物体代谢过程中产生的重要有机酸,具有许多生物功能和生物活性,尤其在能量代谢方面对保护人类健康起着重要的作用。近年来微生物发酵法生产L-苹果酸的优势逐渐显现,随着苹果酸生物合成途径的阐明及其相关基因的克隆,运用基因工程手段调控微生物合成苹果酸已成为可能。本文对苹果酸生物合成代谢途径及重要酶和相关基因的研究进展进行综述,并对近年来苹果酸产生菌的最新研究进行总结,最后展望了未来构建苹果酸基因工程菌的研究方向。
微生物;发酵;L-苹果酸;生物合成
L-苹果酸(malic acid,L-羟基丁二酸)是一种重要的天然有机酸,广泛分布于植物、动物与微生物细胞中,其口感接近天然苹果的酸味,与柠檬酸相比酸度大、味道柔和、不损害口腔与牙齿,生理代谢上有利于氨基酸吸收、不积累脂肪,属于新一代的食品酸味剂,被生物界和营养界誉为“最理想的食品酸味剂”,是目前世界食品工业中用量和发展前景较好的有机酸之一。L-苹果酸是一种四碳酸,具有手性结构,因此一般以3种形式存在,即D-苹果酸、DL-苹果酸和L-苹果酸,只有具有左旋结构的L-苹果酸才能被生物体利用。L-苹果酸是苹果酸天冬氨酸穿梭的重要组成部分,对胞液和线粒体之间的还原当量(NADH)的转移起重要作用[1]。因此,L-苹果酸在机体内具有重要的代谢意义,同时具有显著的生理功能,能够有效的提高运动能力,具有抗疲劳、保护心脏、促进羧酸盐的代谢、促进线粒体呼吸、改善记忆能力、增强钙的活性、降低抗癌药物毒副作用等生理功能,可应用于功能食品及医药产品中[2]。在食品工业中L-苹果酸是继柠檬酸、乳酸之后用量排第3位的食品添加剂,已广泛用于高档饮料、调味品、糖果等食品中。
由于L-苹果酸属于发酵生产的产品,安全性能有保障,因此,国际市场上需求量快速增加,近年来需求量保持在年均10%左右的高速度增长,市场发展空间巨大。目前世界苹果酸主要生产国有美国、加拿大、日本等,世界总产量每年约为10万t,其中L-苹果酸产量每年约为4万t,而世界市场潜在需求量达到每年6万t[3]。目前我国最大L-苹果酸生产厂家为常茂生物化学工程股份有限公司,生产方法为酶法生产。化学合成法生产的苹果酸,一般是以石油为原料,经过化学合成的方法生产。主要包括反丁烯二酸或顺丁烯二酸经高温高压催化加水等几种方法。化学合成的苹果酸为DL型,虽成本低廉,但不易吸收,有一定的毒性,不适于大量在食品与医药工业中应用。目前酶转化法生产L-苹果酸主要以富马酸酶转化为主,因此原料依然依赖于高纯度化学合成的富马酸,存在富马酸原料价格昂贵、生产污染大、产品中杂酸含量偏高等缺点[4]。微生物发酵生产L-苹果酸日益受到重视,具有原料来源丰富、产品成本低廉(约为酶法的1/4)、杂酸含量低(约为酶法的1/5)、食用安全性高等特点[5]。发酵法生产L-苹果酸克服了对石化原料的依赖,被认为是最有前途的方法。
1 苹果酸的生物合成途径
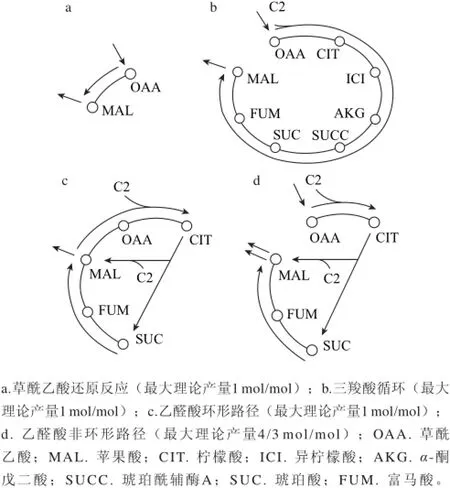
图1 曲霉细胞内4条合成L-苹果酸途径[[66]]Fig.1 Four possible pathways for malate production in Aspergillus[[66]]
目前研究发现L-苹果酸在微生物细胞内有4条合成途径(图1):1)丙酮酸羧化或磷酸烯醇式丙酮酸羧化为草酰乙酸,再还原为L-苹果酸,该途径的糖酸转化率最大理论值为200%;2)由草酰乙酸与乙酰辅酶A合成柠檬酸后进入三羧酸循环生成L-苹果酸,该途径糖酸转化率的最大理论值为100%;3)支路乙醛酸循环合成L-苹果酸,该途径糖酸转化率的最大理论值为100%;4)延胡索酸由延胡索酸酶转化生成L-苹果酸,该途径糖酸转化率的最大理论值为133%[6]。
已有研究表明丙酮酸羧化支路途径是曲霉等微生物积累L-苹果酸的主要途径[7]。郝夕祥等[8]从限氧发酵、碳酸钙添加量、乙醛酸循环和TCA循环相应酶的抑制剂等几个方面初步探讨黄曲霉积累L-苹果酸的代谢机制,发现丙酮酸羧化支路(二氧化碳固定途径)是积累L-苹果酸的主要途径。限氧发酵时总酸下降15%左右,但L-苹果酸在总酸中的比例大约上升了6%,在线粒体内进行的TCA循环和乙醛酸循环受到抑制,使得柠檬酸等杂酸的产量下降;在细胞质中进行的CO2固定途径并未受到影响。发酵培养基中不添加碳酸钙时,苹果酸产量极少,培养基中碳酸钙浓度逐渐增大,产酸水平也相应提高[9]。通过在发酵培养基中添加琥珀酸(异柠檬酸裂解酶的反馈抑制剂),发酵产物中L-苹果酸占总酸的比率基本没有变化,排除了乙醛酸循环途径在L-苹果酸的合成中的主要作用。通过丙二酸、双氧水、氯霉素对苹果酸发酵的影响,发现TCA循环在黄曲霉SFW-7菌株积累L-苹果酸中不占主导位置,并推测丙酮酸羧化支路(二氧化碳固定途径)是积累L-苹果酸的主要途径。
周小燕等[10]研究表明,曲霉N1-14’胞质酶在发酵早期合成位于代谢途径前端的丙酮酸羧化酶(pyruvate carboxlase,pyc)及胞质苹果酸脱氢酶(malate dehydrogenase,mdh),后期合成琥珀酸脱氢酶(succinate dehydrogenase,sdh),证实在曲霉N1-14’细胞内合成L-苹果酸代谢流走的是丙酮酸羧化支路途径,即图1中草酰乙酸还原途径,在丙酮酸羧化酶催化下,细胞线粒体内丙酮酸转变为草酰乙酸,再由苹果酸脱氢酶催化为L-苹果酸。Osmani等[11-12]从丙酮酸羧化酶在细胞中的定位研究,发现构巢曲霉(Aspergillus nidulans)和少根根霉(Rhizopus arrhizus)等曲霉细胞内丙酮酸羧化酶主要存在于胞质中,丙酮酸羧化支路途径是有机酸积累的机制;Zelle等[6]通过在丙酮酸脱羧酶缺陷型酿酒酵母中过表达内源性丙酮酸羧化酶基因、苹果酸脱氢酶MDH3的等位基因及苹果酸转运蛋白基因SpMAE1,苹果酸得率达到59 g/L,较出发菌株的12 g/L显著提高。苹果酸转运蛋白(oxoglutarate-malate carrier,OMC)在苹果酸和α-酮戊二酸进出线粒体过程中起到载体的作用[13],因L-苹果酸不能直接穿过线粒体到胞外,只能由位于线粒体膜上的苹果酸转运蛋白转运到胞质中,苹果酸转运蛋白的转运效率制约L-苹果酸转运到胞外的效率[14-15]。目前L-苹果酸在微生物中代谢途径方面的研究,大多认为二氧化碳固定反应是L-苹果酸生成及积累的重要过程,有研究表明,曲霉胞质中羧化酶类合成的增多和减少是其活力增强或减弱的重要原因,从而引起L-苹果酸生成速度加快或减慢,胞质中羧化酶蛋白分子的合成是产生苹果酸的重要机制[16-17]。
2 苹果酸合成途径中的重要酶及相关基因
苹果酸合成途径中的重要酶是位于三羧酸循环途径中的丙酮酸羧化酶、胞质苹果酸脱氢酶及富马酸酶。虽然苹果酸酶也是调控苹果酸代谢的关键酶,可以催化苹果酸氧化脱羧的可逆反应,但在微生物合成苹果酸代谢过程中并不起主导作用。尹升明等[18]利用农杆菌介导的转化方法转化黑曲霉,通过同源重组敲除黑曲霉苹果酸基因,筛选苹果酸酶基因敲除菌株,对其进行发酵实验来研究苹果酸基因在三羧酸循环中的作用,发现苹果酸基因敲除菌株的三羧酸循环中各种有机酸的产量与野生菌株相比没有明显变化,表明苹果酸酶基因的敲除对三羧酸循环没有产生明显影响。
2.1 丙酮酸羧化酶
丙酮酸羧化酶是一个生物素依赖性的四聚体酶,催化丙酮酸转化为草酰乙酸的羧化过程。因pyc位于在细胞质中丙酮酸代谢的分支点,丙酮酸羧化酶是胞质中还原型(非线粒体中氧化型)三羧酸循环途径的关键酶。真核生物中pyc一般位于线粒体内,而在一些丝状真菌和酿酒酵母(Saccharomyces cerevisiae)中pyc位于细胞质,对细胞积累高浓度的苹果酸非常重要。通过添加影响pyc催化活性的物质,如抗生物素蛋白,可以使丝状真菌和酿酒酵母积累高浓度的苹果酸。酿酒酵母有两个丙酮酸羧化酶基因,在氨基酸水平表现出90%的同源性,核苷酸水平表现出85%的同源性,在发酵生长期,缺失任何一个pyc基因对酵母细胞的生长影响不大,而同时敲除两个pyc基因,只有在培养基中添加天门冬氨酸,酵母细胞才能正常生长[3]。
2.2 苹果酸脱氢酶
苹果酸脱氢酶催化苹果酸与草酰乙酸之间的相互转化。真核细胞中至少存在两种形式的酶,根据不同的功能分为线粒体MDH和胞质MDH,而在酿酒酵母中存在的第3种苹果酸脱氢酶(MDH3)位于核糖体。研究发现黄曲霉在连续培养6 d后,MDH的活性增加了6~10倍,富马酸的活性变化不大,电泳分析发现线粒体MDH、胞质MDH及富马酸酶存在于黄曲霉细胞,产酸过程中MDH电泳迁移率发生了变化,而富马酸没有变化,表明MDH表达与苹果酸的生产具有很强的相关性,且MDH是产酸的一个限制因素。放线菌酮完全抑制L-苹果酸的生产,主要同功酶的MDH并没有增加,而不会影响总活性延胡索酸酶或其同工酶[19]。这些结果表明该同功酶是L-苹果酸生产和积累关键酶。所有曲霉菌株均产生L-苹果酸,已有研究发现产苹果酸为主要有机酸的曲霉菌株(如米曲霉、黄曲霉、大豆疫霉和寄生曲霉)均存在MDH的一个特定电泳条带,这种技术可以用来筛选高产L-苹果酸的生产株菌[3]。
2.3 延胡索酸酶
延胡索酸酶又名富马酸酶、苹果酸裂合酶及延胡索酸水化酶,催化延胡索酸与苹果酸之间相互转化。目前发现存在两种延胡索酸酶,一种是易与氧气反应不稳定的同源二聚体酶(class Ⅰ fumarases),存在于大肠杆菌及嗜热脂肪芽孢杆菌中;另一种是稳定的同源四聚体酶(class Ⅱ fumarases),存在比较广泛。原核生物有3种形式的延胡索酸酶,分别由fumA、fumB及fumC编码;真核细胞的延胡索酸酶存在于细胞质核线粒体基质中,由单个基因编码。延胡索酸酶在酵母积累L-苹果酸过程中所起的作用研究的比较清晰,酿酒酵母能够产生的L-苹果酸,而不产生延胡索酸,原因在于胞质中延胡索酸酶具有较高的活性,不断催化延胡索酸转化为苹果酸,且反应不可逆[20]。E.coli中有两个class Ⅰ fumarases基因(fumA和fumB),fumA在有氧条件下行使功能,而fumB在无氧条件下行使功能;以及一个class Ⅱ fumarases基因fumC,fumC在有氧和无氧条件下都可以表达,表达产物fumC的酶学性质和fumA类似,在胁迫环境中可以代替fumA的作用。
3 苹果酸的产生菌
筛选或构建能用于工业化生产的高产菌株,并优化出最佳培养条件是生物转化法生产L-苹果酸研究的热点。改造L-苹果酸产生菌的趋势主要是用基因敲除技术改变菌株代谢途径或利用基因扩增技术增加限速步反应的基因表达,增强菌株L-苹果酸代谢途径,同时强化表达L-苹果酸转运基因,最大限度的降低代谢产物在生产菌株细胞内的积累,筛选出高产菌株。在得到优秀菌株的基础上找到廉价底物,优化发酵工艺和研究控制发酵条件使代谢流最大限度的流向L-苹果酸。
与柠檬酸相比,微生物发酵法生产苹果酸的菌种较少[21-22],天然菌株的产酸能力低,对糖及底物的耐受性较差。L-苹果酸高产菌株的选育工作主要集中于两个方面:运用传统的诱变方法,在特异性很强的选择性平板上筛选L-苹果酸高产菌株;运用分子生物学方法来构建基因工程菌,通过生物工程技术对菌种进行改造,这方面的研究已成为高产苹果酸育种的主要工作的方向。
3.1 诱变筛选
苹果酸是许多微生物的代谢中间体,可通过这类微生物的生理代谢活动由糖类或氨基酸而产生。产L-苹果酸的微生物主要有:黄曲霉(Aspergillus flavus),最高产酸量达到113g/L,总转化速率0.59g/(L·h)[23]。Z. rouxii最高产酸量达75g/L,总转化速率0.54g/(L·h)[24]。S. cerevisiae最高产酸量达到59 g/L,总转化速率0.19g/(L·h)[6]。何皓等[25]利用诱变米根霉(Rhizopus oryzae)ME-M15菌株发酵生产L-苹果酸,最高产酸量21.7 g/L,总转化速率0.23 g/(L·h)。刘建军等[26]筛选出一株能直接利用淀粉的高产菌株HA5800,在7 000 L发酵罐中产酸量达86.8 g/L,糖酸转化率达83.5%,有望成为工业化生产菌株。周小燕等[10,16]从出发菌株曲霉中选育出变异株N1-14’(Aspergillus sp. N1-14’),变异株产苹果酸的能力达到105.88 g/L。目前已报道发酵产L-苹果酸的菌种中最高产量的是黄曲霉,达到113 g/L,具有巨大的商业价值[27-28]。
3.2 苹果酸基因工程菌的构建
3.2.1 大肠杆菌
Zhang等[29]在构建了生产琥珀酸的大肠杆菌(KJ060和KJ073)基础上进一步敲除富马酸还原酶构建的工程菌(XZ372和XZ316),其琥珀酸的产量减少了90%,即使在延胡索酸酶存在的情况下,该菌株苹果酸的产量实现了大幅提高,丙酮酸的产量也相应的提高。仅敲除延胡索酸同功酶基因构建的工程菌(XZ273和XZ276)对苹果酸的产量无影响。在工程菌XZ316细胞中敲除苹果酸酶SfcA基因构建菌株XZ347,使细胞产率增加20%,且苹果酸产量提高了3倍,达到70 mmol/L。在XZ347中敲除苹果酸酶maeB基因构建菌株XZ654,苹果酸产量有所下降(40 mmol/L),但苹果酸产率有所增加,且副产物丙酮酸基本清除。在工程菌XZ654中敲除延胡索酸同功酶基因(fumB和fumAC)构建工程菌XZ658,细胞产量增加了128%,苹果酸产量达到197 mmol/L,提高了4倍,但乳酸产量增加明显。进一步敲除丙酮酸激酶基因pykA或pykB,乳酸产量下降同时苹果酸的产量下降明显,高产苹果酸的大肠杆菌工程菌均缺乏延胡索酸还原酶。
3.2.2 枯草芽孢杆菌
Mu等[30]将来源于大肠杆菌的磷酸烯醇丙酮酸羧化酶和来源于酿酒酵母的苹果酸脱氢酶克隆到枯草芽孢杆菌(Bacillus subtilis)中构建工程菌BSUPM,有效建立了一个异源生物合成途径,该工程菌L-苹果酸产量达到(6.04±0.19)mmol/L。进一步敲除引起副产物乳酸产生的乳酸脱氢酶基因,构建了BSUPML基因工程菌,苹果酸的产量增加了1.5倍,达到(9.18±0.22)mmol/L,通过优化发酵条件,最大产量达到(15.65±0.13)mmol/L,这是在枯草芽胞杆菌工程菌中产L-苹果酸的首次尝试,为枯草芽孢杆菌产苹果酸的基因工程研究奠定了基础。
3.2.3 酵母
野生型的酿酒酵母苹果酸产量一般只有1~2 g/L,近年来,随着酿酒酵母基因工程菌研究的开展苹果酸的产量提高很快。最初的酿酒酵母中敲除延胡索酸酶构建工程菌,发现苹果酸脱氢酶的活性提高,使得苹果酸的产量提高到6 g/L,进一步过表达胞质同功酶MDH2,使得苹果酸的产量提高到12 g/L。Zelle等[6]通过在丙酮酸脱羧酶缺陷型酿酒酵母中过表达内源性丙酮酸羧化酶基因、苹果酸脱氢酶MDH3的等位基因及苹果酸转运蛋白基因SpMAE1,通过摇瓶发酵苹果酸得率达到59 g/L,较出发菌株的12 g/L显著提高,进一步转移到1 L发酵罐中扩大发酵,优化pH值、CO2浓度、碳酸钙及O24个工艺参数,苹果酸转化率比摇瓶增加19%以上[31]。Oba等[32]从清酒醪中分离出苹果酸产生菌酿酒酵母,比较这些菌株与亲本株DNA微阵列的基因表达时发现,苹果酸生产菌株中的应激反应基因如HSP12,通常被上调,而硫胺素合成基因,如THI4和SNZ2,在高产苹果酸菌株中被下调。因此,可以在酿酒酵母细胞中过表达应激反应基因,敲除硫胺素合成基因构建苹果酸工程菌株。Nakayama等[33]研究酿酒酵母No. 28产苹果酸机制时,发现在No. 28菌株及其亲代菌株K1001合成苹果酸过程中涉及的酶活性差异不大,但用罗丹明123进行细胞染色发现,No. 28菌株较亲代菌株K1001淡,呼吸缺失菌株K1001的苹果酸产量是野生型K1001和野生型No. 28菌株的2.5倍,表明菌株No. 28生产苹果酸的主要机制是细胞线粒体活性受到抑制,为我们提示了一个利用酿酒酵母构建苹果酸工程菌的研究方向。
4 展 望
利用基因工程菌发酵生产L-苹果酸已成为一个重要的研究方向。通过对苹果酸生物合成途径的全面研究,可以有效指导生物合成途径的遗传修饰从而调节微生物对苹果酸的生产、增加苹果酸产量和提高苹果酸的积累。在较好理解苹果酸生物合成途径的基础上,利用遗传工程和代谢工程对苹果酸的代谢途径进行重新设计,苹果酸基因工程菌的构建思路主要包括两个方面。1)加速限速反应:细胞内过表达丙酮酸羧化酶,增强丙酮酸转化为草酰乙酸的反应;过表达苹果酸脱氢酶,增强草酰乙酸转化为L-苹果酸的反应,提高L-苹果酸在胞内的积累;2)改变分支代谢途径流向:在细胞内敲除fum基因,阻止苹果酸转化为延胡索酸,敲除sdh基因,阻止副产物琥珀酸的生成。深入开展苹果酸生物合成代谢调控研究不仅可以为提高苹果酸产量的研究指明方向,也可为其他有机酸的研究奠定基础。
[1] 梅郁, 张缨. L-苹果酸代谢与运动[J]. 中国运动医学杂志, 2005, 24(4): 509-511.
[2] 吴军林, 吴清平, 张菊梅. L-苹果酸的生理功能研究进展[J]. 食品科学, 2008, 29(11): 650-654.
[3] GOLDBERGL I, ROKEML J S, PINES O. Organic acids: old metabolites, new themes[J]. Journal of Chemical Technology and Biotechnology, 2006, 81(10): 1601-1611.
[4] 吴清平, 周小燕. L-苹果酸的生产及用途[J]. 广州食品工业科技, 1992, 8(2): 6-8.
[5] 刘建龙, 刘建军, 杨连生. 酶转化法及微生物发酵法生产L-苹果酸的研究进展[J]. 中国酿造, 2005(7): 5-7.
[6] ZELLE R M, de HULSTER E, van WINDEN W A, et al. Malic acid production by Saccharomyces cerevisiae: engineering of pyruvate carboxylation, oxaloacetate reduction, and malate export[J]. Applied and Environmental Microbiology, 2008, 74(9): 2766-2777.
[7] 金其荣, 许赣荣, 吴燕萍. 直接发酵法与酶转化法生产L-苹果酸的比较[J]. 食品科学, 1994, 15(1): 25-28.
[8] 郝夕祥, 刘建军, 赵祥颖, 等. 黄曲霉积累L-苹果酸代谢机制初探[J].中国酿造, 2011(6): 122-124.
[9] 郝夕祥, 赵祥颖, 田延军, 等. CO2固定途径在L-苹果酸积累中的作用[J]. 山东食品发酵, 2011(1): 23-26.
[10] 周小燕, 陈素云, 吴清平, 等. 通气条件对曲霉N1-14’产生L-苹果酸的影响[J]. 食品与发酵工业, 2000, 26(1): 11-15.
[11] OSMANI S A, SCRUTTON M C. The sub-cellular localisation and regulatory properties of pyruvate carboxylase from Rhizopus arrhizus[J]. European Journal of Biochemistry, 1985, 147(1): 119-128.
[12] OSMANI S A, SCRUTTON M C. The sub-cellular localisation of pyruvate carboxylase and of some other enzymes in Aspergillus nidulans[J]. European Journal of Biochemistry, 1983, 133(3): 551-560.
[13] RUBI B, del ARCO A, BARTLEY C, et al. The malate-aspartate NADH shuttle member Aralar1 determines glucose metabolic fate, mitochondrial activity, and insulin secretion in beta cells[J]. Journal of Biological Chemistry, 2004, 279(53): 55659-55666.
[14] VOLSCHENK H, van VUUREN H J, VILJOEN-BLOOM M. Maloethanolic fermentation in Saccharomyces and Schizosaccharomyces[J]. Current Genetics, 2003, 43(6): 379-391.
[15] JALIL M A, BEGUM L, CONTRERAS L. Reduced N-acetylaspartate levels in mice lacking aralar, a brain- and muscle-type mitochondrial aspartate-glutamate carrier[J]. Journal of Biological Chemistry, 2005, 280(35): 31333-31339.
[16] 周小燕, 吴清平, 蔡芷荷, 等. 曲霉N1-14’胞质酶活性与产L-苹果酸能力的关系[J]. 微生物学报, 2000, 40(5): 500-506.
[17] 黄艳红, 田延军, 郝夕祥, 等. L-苹果酸代谢流分析及高产菌株构建[J]. 山东食品发酵, 2009(3): 3-7.
[18] 尹升明, 耿红冉, 周闯, 等. 黑曲霉苹果酸酶基因的敲除及其功能研究[J]. 化学与生物工程, 2012, 29(8): 21-25.
[19] PELEG Y, BARAK A, SCRUTTON M C, et al. Malic acid accumulation by Aspergillus fl avus III. 13C-NMR and isoenzyme analysis[J]. Applied and Environmental Microbiology, 1989, 32: 334-339.
[20] PINES O, EVEN RAM S, ELNATHAN N, et al, The cytosolic pathway of L-malic acid synthesis in Saccharomyces cerevisiae: the role of fumarase[J]. Applied and Environmental Microbiology, 1996, 46: 393-399.
[21] 刘建军, 赵祥颖, 田延军, 等. 直接利用糖质原料生产L-苹果酸菌种的选育[J]. 工业微生物, 2003, 33(4): 27-30.
[22] 郝夕祥, 张家祥, 田延军, 等. L-苹果酸生产、提取及一步发酵法发酵机理研究[J]. 山东食品发酵, 2010 (3): 3-6.
[23] BATTAT E, PELEG Y, BERCOVITZ A, et al. Optimization of L-malic acid production by Aspergillus fl avus in a stirred fermentor[J]. Biotechnology and Bioengineering, 1991, 37: 1108-1116.
[24] TAING O, TAING K. Production of malic and succinic acids by sugar-tolerat yeast Zygosaccharomyces rouxii[J]. European Food Research and Technology, 2007, 224: 343-347.
[25] 何皓, 李霜, 徐晴, 等. 放线菌酮对米根霉积累L-苹果酸代谢途径的调控作用[J]. 过程工程学报, 2009, 9(1): 153-156.
[26] 刘建军, 赵祥颖, 田延军, 等. 糖质原料直接发酵生产L-苹果酸的工艺条件[J]. 食品与发酵工业, 2005, 31(1): 5-9.
[27] CHANG P K, EHRLICH K C. What does genetic diversity of Aspergillus flavus tell us about Aspergillus oryzae?[J]. International Journal of Food Microbiology, 2010, 138(3): 189-99.
[28] ZOU X, ZHOU Y, YANG S T. Production of polymalic acid and malic acid by Aureobasidium pullulans fermentation and acid hydrolysis[J]. Biotechnology and Bioengineering, 2013, 110(8): 2105-2113.
[29] ZHANG X, WANG X, SHANMUGAM K T, et al. L-malate production by metabolically engineered Escherichia coli[J]. Applied and Environmental Microbiology, 2011, 77(2): 427-434.
[30] MU L, WEN J. Engineered Bacillus subtilis 168 produces L-malate by heterologous biosynthesis pathway construction and lactate dehydrogenase deletion[J]. World Journal of Microbiology and Biotechnology, 2013, 29(1): 33-41.
[31] ZELLE R M, DE HULSTER E, KLOEZEN W, et al. Key process conditions for production of C(4) dicarboxylic acids in bioreactor batch cultures of an engineered Saccharomyces cerevisiae strain[J]. Applied and Environmental Microbiology, 2010, 76(3): 744-750.
[32] OBA T, SUENAGA H, NAKAYAMA S, et al. Properties of a high malic acid-producing strains of Saccharomyces cerevisiae isolated from sake mash[J]. Bioscience Biotechnology and Biochemistry, 2011, 75(10): 2025-2029.
[33] NAKAYAMA S, TABATA K, OBA T, et al. Characteristics of the high malic acid production mechanism in Saccharomyces cerevisiae sake yeast strain No. 28[J]. Journal of Bioscience and Bioengineering, 2012, 114(3): 281-285.
Progress in L-Malic Acid Biosynthesis
WU Jun-lin1,2, WU Qing-ping1,*, ZHANG Ju-mei1, ZHANG Wen2, MO Shu-ping1, BAI Jian-ling1
(1. Guangdong Institute of Microbiology, State Key Laboratory of Applied Microbiology of Southern China, Guangdong Provincial Key Laboratory of Microbial Culture Collection and Application, Guangdong Open Laboratory of Applied Microbiology, Guangzhou 510070, China; 2. Guangdong Huankai Microbial Sci. & Tech. Co. Ltd., Guangzhou 510643, China)
L-malate, an important organic acid in the process of metabolism, is greatly beneficial to human health owning to its diverse biological functions. In recent years, the advantages of microbial fermentation for producing L-malic acid by are gradually emerging. The metabolic pathway of L-malic acid has been clarified and many related genes have been cloned. Therefore, the development of genetic engineering technologies has made it possible to improve the biosynthesis of L-malic acid. In this paper, the recent progress in the biosynthesis pathway of L-malic acid and the cloning of the genes encoding key enzymes involved in L-malic acid biosynthesis in microorganisms is reviewed, and the latest research on malic acidproducing strains is summarized. At last, we propose further directions and prospects in the construction of genetically engineered strains for malic acid biosynthesis.
microorganism; fermentation; L-malic acid; biosynthesis
TS201.2
A
1002-6630(2014)03-0238-05
10.7506/spkx1002-6630-201403048
2013-03-20
国家自然科学基金项目(31271940;31000762);广州市珠江科技新星专项(2013J2200079)
吴军林(1978—),男,副研究员,博士,研究方向为食品与发酵工程。E-mail:tigerwjl@163.com
*通信作者:吴清平(1962—),男,研究员,博士,研究方向为食品安全与监测。 E-mail:wuqp203@aliyun.com

