缺氧预处理对创伤性脑损伤大鼠脑组织HIF-1α、VEGF表达的影响
张 磊,刘家传,杨艳艳,王金标,张永明,张 星,王春琳,黄振山
缺氧预处理对创伤性脑损伤大鼠脑组织HIF-1α、VEGF表达的影响
张 磊,刘家传,杨艳艳,王金标,张永明,张 星,王春琳,黄振山
目的研究缺氧预处理(HPC)对创伤性脑损伤大鼠挫伤周围脑组织缺氧诱导因子(HIF-1α)及血管内皮生长因子(VEGF)表达的影响,探讨缺氧预处理对创伤性脑损伤保护机制。方法Sprague-Dawley大鼠102只,随机分为对照组(Con组,n=6)、创伤组(TBI组,n=48)和HPC组(n=48)。HPC组大鼠首先置于低压氧舱中进行HPC(50.47 kPa,3 d,3h/d),随后HPC组和TBI组分别采用改良自由落体打击建立大鼠创伤性脑损伤模型。颅脑创伤后1、4、8、12h和1、3、7、14 d,分别采用RT-PCR和Western blot法检测各个时间点挫伤周围脑组织HIF-1α、VEGF表达变化。结果TBI组与Con组比较,HIF-1α表达在伤后4、8、12h和1、3 d均明显上升(P<0.05);VEGF表达在伤后4、8、12h和1、3、7 d均明显上升(P<0.05)。HPC组与TBI组比较,HIF-1α和VEGF表达在伤后1h逐渐上升,伤后4、8、12h和1、3 d显著上升,直至伤后7 d(P<0.05)。结论HPC可提高创伤性脑损伤对缺氧耐受性,诱导血管内皮细胞功能活化,发挥早期脑保护,其机制可能涉及HPC在创伤性脑损伤早期促进HIF-1α、VEGF高表达。
缺氧预处理;颅脑损伤;HIF-1α;VEGF;大鼠;脑组织
缺氧预处理(hypoxic preconditioning,HPC)是指预先给予机体短时间的重复轻程度的缺氧,能够显著提高机体对随后严重缺血缺氧的耐受力,为机体提供有效神经保护[1-2]。缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)是依赖氧浓度调节主要因子,对周围氧环境具有较强敏感性。研究[3-4]表明HIF-1α能通过对应靶蛋白调节产生神经保护作用。血管内皮生长因子(vascular endothelial growth factor,VEGF)是HIF-1α下游编码靶蛋白,可参与神经血管重塑而达到脑保护作用[5]。目前关于HPC在创伤性脑损伤神经保护作用机制尚不完全清楚。该研究通过检测HPC后创伤性脑损伤脑组织中HIF-1α、VEGF表达变化,探讨HPC对创伤性脑损伤的脑保护机制。
1 材料与方法
1.1 实验动物102只健康清洁级雄性Sprague-Dawley大鼠,8~10周龄,体重250~300 g,由安徽医科大学实验动物中心提供。
1.2 主要试剂与仪器兔抗HIF-1α单克隆抗体(货号:ab51608)、鼠抗VEGF单克隆抗体(货号:ab1316)购自英国Abcam公司;TRIzol Reagent(美国Invitrogen公司);逆转录试剂盒(美国ThermoFish公司);GAPDH引物合成(上海生工生物工程技术服务公司);低压氧舱(上海减压器厂);ZH-ZYQ型自由落体脑损伤模型打击器(淮北正华生物仪器设备有限公司);笔式小型磨钻(韩国世新精密公司);VN-180型活塞式无油真空泵(昆山佑诚至信电机设备有限公司);DYY-11型电泳仪(北京市六一仪器厂)。
1.3 动物分组采用随机数字法分成对照组(Con组,n=6)、创伤组(TBI组,n=48)、HPC组(n=48),TBI组和HPC组按取材时间点不同又随机分为伤后1、4、8、12h和1、3、7、14 d,每亚组6只。实验中所涉及实验动物的饲养和实验方案均获得安徽医科大学实验动物伦理委员会的批准,并经过相关培训后进行。
1.4 制备低压缺氧、创伤性脑损伤模型和取材低压舱由真空泵和密闭容器组成,通过真空泵持续抽吸维持密闭容器内的低压力以模拟低压低氧条件,负压大小由进气孔口径大小调节,并换算成海拔高度5 500 m大气压(50.47 kPa,舱内温度保持18~25℃),处置3 d,每天3h。经过低压舱预处理后的大鼠给予10%水合氯醛(500 mg/kg)腹腔注射麻醉成功后,固定于脑立体定向仪,常规消毒后沿正中线切开头皮,钝性分离软组织、骨膜,暴露颅骨,在前囟后3.0 mm,矢状缝向右旁开3.0 mm处用磨钻钻穿颅骨,形成直径约5 mm骨窗,保持硬膜完整。采用改良Feeney自由落体打击法[6]建立大鼠创伤性脑损伤模型,以打击重量50 g砝码离骨窗面约25 cm高处下落打击,打击后给予缝合头皮。苏醒后大鼠分笼饲养。在相应时间点处死大鼠,断头取脑切取距挫伤区边缘0.5 cm皮层脑组织100~150 mg。
1.5 RT-PCR荧光定量检测HIF-1α及VEGF mRNA的表达取挫伤区周围脑组织100 mg,加入1 ml TRIzol,使用组织匀浆器在冰上进行匀浆,提取总RNA后按照逆转录试剂盒说明书行逆转录。以cDNA为模板进行荧光定量PCR扩增反应。引物序列:HIF-1α上游:5′-AGAGTCAAGCCCAGAGTCAC-3′,下游:5′-TGGGACTGTTAGGCTCAGGT-3′,产物长度为116 bp;VEGF上游:5′-CGGTTCCAGAAGGGAGAGGA-3′,下游:5′-CTGGGACCACTTGGCATGG-3′,产物长度为188bp;GADPH上游:5′-GGGCTCTCTGCTCCTCCCTGT-3′,下游:5′-ACGGCCAAATCCGTTCACACC-3′,产物长度为107 bp。扩增条件如下:95℃10 min;95℃15 s,60℃1 min,共40个循环。采用2-ΔΔCT表示各样本目的基因mRNA的相对表达量,并作为最终数据进行统计学分析。
1.6 Western blot法检测HIF-1α、VEGF蛋白表达取挫伤区周围皮层脑组织约100 mg,加入RIPA细胞裂解液100 μl(含1 μl PMSF)进行裂解,并进行组织匀浆,提取总蛋白,测定蛋白含量,进行SDSPAGE电泳、转膜、室温封闭2h、滴加一抗、二抗进行免疫反应,化学发光、显影、定影,最后拍照。采用Quantity one灰度软件进行分析,以HIF-1α、VEGF蛋白与β-actin的蛋白产物条带灰度值之比作为其蛋白水平的相对表达量。
1.7 统计学处理采用SPSS 20.0统计软件进行分析,数据以±s表示,多组间比较采用单因素方差分析,两组间比较采用t检验。
2 结果
2.1 HIF-1α及VEGF mRNA水平相对表达量HIF-1α mRNA在正常脑组织中表达量相对较少,伤后4h出现表达上调,12h出现峰值,3 d开始下调(P<0.05),伤后1h和7、14 d与Con组比较差异无统计学意义(P>0.05)。HPC组与TBI组比较,HIF-1α mRNA伤后1、4、8、12h和1、3、7 d表达显著上调(P<0.05),伤后14 d差异无统计学意义(P>0.05)。VEGF mRNA在正常脑组织中表达量相对较少,伤后4h出现表达上调,1 d出现峰值,直至7 d开始表达下调(P<0.05),伤后1h、14 d与Con组比较差异无统计学意义(P>0.05)。HPC组与TBI组比较,VEGF mRNA伤后1h表达上调,以12h和1 d维持高表达,直至7 d表达下降(P<0.05),伤后14 d差异无统计学意义(P>0.05)。见图1。
2.2 HIF-1α及VEGF蛋白表达变化HIF-1α蛋白在正常脑组织中相对表达量为(0.255±0.019),伤后4h HIF-1α出现表达上调,1 d达到峰值,直至3 d开始下调(P<0.05),伤后1h和7、14 d与Con组比较差异无统计学意义(P>0.05)。HPC组与TBI组比较,HIF-1α伤后1h即表达上调,在12h和1、3 d维持高表达,直至7 d表达下调(P<0.01,P<0.05),伤后14 d差异无统计学意义(P>0.05)。VEGF蛋白在正常脑组织中相对表达量为(0.245±0.017),伤后4h VEGF出现表达上调,3 d出现峰值,直至7 d开始下调(P<0.05),伤后1h、14 d与Con组比较差异无统计学意义。HPC组与TBI组比较,HPC组VEGF伤后1h表达上调,以12h和1、3 d维持高表达(P<0.01),直至7 d表达下调(P<0.05),伤后14 d差异无统计学意义。见表1、图2。
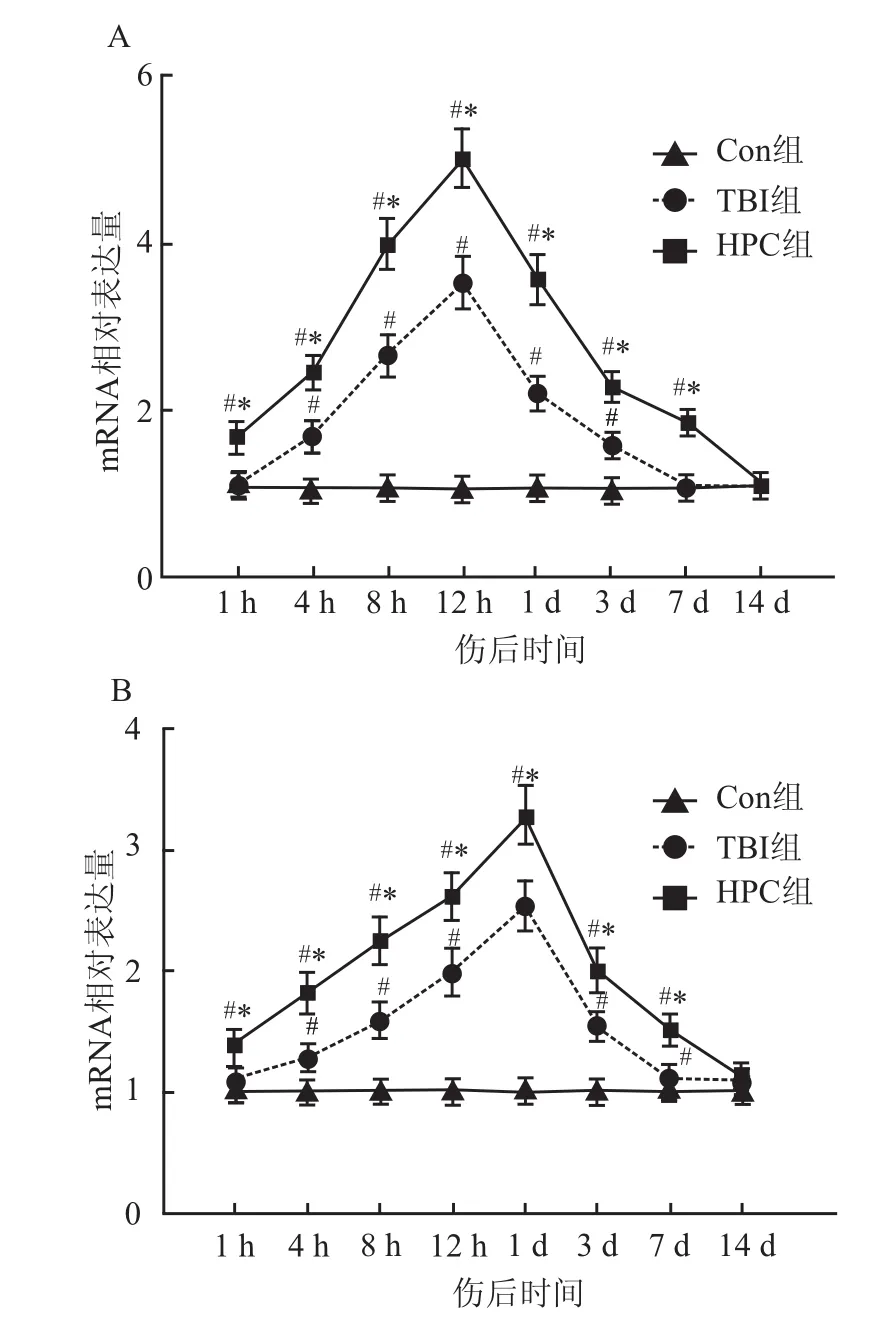
图1 大鼠创伤后不同时间点HIF-1α及VEGF mRNA表达
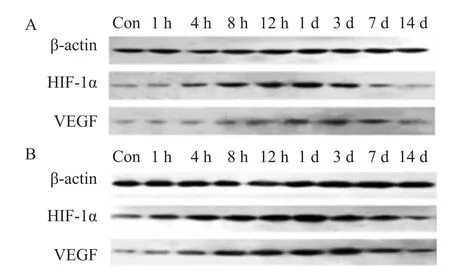
图2 创伤性脑损伤大鼠各时间点HIF-1α、VEGF蛋白表达
3 讨论
颅脑创伤后局部脑组织继发性的缺血缺氧是导致脑损害主要因素[7]。脑创伤后挫伤中心的神经细胞呈不可逆损伤状态,而挫伤周围的神经细胞在一定条件下有逆转趋势,因此创伤性脑损伤挫伤周围脑组织保护是颅脑损伤救治核心。有研究[1]报道HPC可减轻缺血缺氧对神经细胞损伤,并显示氧含量5.5%HPC 3h将降低缺血缺氧对皮层、海马及纹状体神经细胞损伤。该课题组在研究颅脑损伤后早期行高压氧治疗具有脑保护[8-9]基础上,将深入探讨HPC对颅脑损伤神经保护作用及其机制。该研究在平原地区利用低压氧舱模拟海拔5 500 m高原(大气50.47 kPa)处置3h,连续3 d,后续给予自由落体致伤。结果显示HPC组HIF-1α、VEGF mRNA及蛋白伤后1h提前表达并明显上调,在4h~7 d维持高表达,提示该条件下HPC可早期促进脑组织HIF-1α、VEGF上调并维持高表达,有效促进挫伤区血管内皮细胞功能恢复,减轻缺血缺氧对神经细胞损伤,进而达到脑保护作用。
表1 大鼠创伤后脑组织HIF-1α、VEGF蛋白表达情况(n=6,±s)

表1 大鼠创伤后脑组织HIF-1α、VEGF蛋白表达情况(n=6,±s)
与Con组比较:#P<0.05;与TBI组比较:**P<0.01,*P<0.05
项目HIF-1α蛋白相对表达量TBI组HPC组VEGF 蛋白相对表达量TBI组HPC组伤后1h0.294±0.0320.333±0.024#*0.256±0.0230.305±0.028#*伤后4h0.433±0.037#0.518±0.030#**0.346±0.033#0.409±0.033#*伤后8h0.575±0.041#0.658±0.046#*0.435±0.032#0.553±0.029#**伤后12h0.679±0.047#0.802±0.066#**0.537±0.034#0.652±0.048#**伤后1 d0.752±0.058#0.992±0.056#**0.654±0.059#0.752±0.054#**伤后3 d0.589±0.027#0.779±0.048#**0.743±0.047#0.882±0.066#**伤后7 d0.293±0.0310.442±0.029#**0.428±0.034#0.488±0.039#**伤后14 d0.268±0.0340.279±0.0340.257±0.0240.263±0.036
本研究显示,Con组中HIF-1α表达较弱。在颅脑损伤4h,挫伤周围脑组织HIF-1α mRNA及蛋白表达逐渐上调,提示缺血缺氧是触发HIF-1α主要诱因。与TBI组比较,HPC组HIF-1α mRNA及蛋白在伤后1h提前表达上调,并在4h~7 d持续高表达,提示HPC可早期激活HIF-1α mRNA及蛋白并维持高表达。HIF-1α高表达可能是因为在常氧条件下,HIF-1α通过泛素-蛋白酶体途径迅速降解,但HPC造成低氧环境可抑制降解酶体系,进而导致HIF-1α降解受到抑制,促进与HIF-1β形成二聚体,在细胞内聚集;其次可能因为颅脑损伤后缺血灶及周围水肿带引起占位效应,引起脑微血管调节发生障碍,局部血流下降,从而导致不同程度缺血缺氧,进一步触发HIF-1α在脑组织蓄积。在7~14 d时,HIF-1α mRNA及蛋白表达下调,可能因为后期挫伤区受损神经细胞对缺血缺氧敏感性降低。实验结果表明HPC可促进颅脑损伤挫伤周围脑组织HIF-1α早期上调并维持高表达,进而加强神经细胞对缺氧耐受性。
HIF-1α是颅脑损伤后缺血缺氧环境激活的关键性转录因子[10],其靶蛋白VEGF可参与神经保护[2-3]。在缺氧条件下,HIF-1α结合转录起始点上游HRE区域调控着VEGF转录、表达,其表达的VEGF作为一种内源性多效性生长因子,参与脑缺血中神经血管重塑,促进血管形成及神经细胞保护[11-12]。本研究显示TBI组VEGF mRNA及蛋白在4h出现表达上调,3 d达到峰值,7 d表达下调。此过程VEGF蛋白表达变化与刘科等[13]采用聚焦定量分析VEGF蛋白表达变化基本一致。HPC组VEGF mRNA及蛋白在伤后1h提前出现表达上调,以1、3、7 d维持高表达水平。因此,HPC早期可能激活VEGF基因序列并维持高表达水平,并有效活化血管内皮细胞功能。HPC VEGF高表达可能是HPC预先诱导脑组织HIF-1α蓄积,同时激发着VEGF低氧反应结构域HRE;再者因颅脑损伤缺血缺氧环境诱导HIF-1α上调,这些因素共同促进HIF-1α与VEGF结构域低氧反应原件HRE结合,加快VEGF转录、翻译到表达过程。VEGF表达上调将减轻神经细胞DNA双链损伤[14],促进脑组织修复过程;加快脑组织挫伤区新血管形成及微环境构建[5],为挫伤周围脑组织提供氧糖供应。实验结果表明HPC可早期促进血管内皮细胞活化,改善缺血缺氧对神经细胞损伤。
总之,HPC可早期促进颅脑损伤大鼠挫伤周围脑组织HIF-1α、VEGF激活并维持二者高表达,其机制可能是通过重复性、短暂性HPC提高脑组织对缺氧耐受能力及血管内皮细胞功能活化。因此,本研究将为进入高原前在内陆进行缺氧预适应训练提供理论基础。目前HPC在颅脑损伤神经保护尚缺乏多方面诠释,现有的实验尚不能完全体现HPC对神经细胞作用,进一步的深入研究正在进行中。
[1] Galle A A,Jones N M.The neuroprotective actions ofhypoxic preconditioning and postconditioning in a neonatal rat model ofhypoxic-ischemic brain injury[J].Brain Res,2013,1498:1-8.
[2] Feng Y,Rhodes P G,Bhatt A J.Hypoxic preconditioning provides neuroprotection and increases vascular endothelial growth factor A,preserves the phosphorylation of Akt-Ser-473 and diminishes the increase in caspase-3 activity in neonatal rathypoxic-ischemic model[J].Brain Res,2010,1325:1-9.
[3] Anderson J,Sandhir R,Hamilton E S,et al.Impaired expression of neuroprotective molecules in the HIF-1alpha pathway following traumatic brain injury in aged mice[J].J Neurotrauma,2009,26(9):1557-66.
[4] Taie S,Ono J,Iwanaga Y,et al.Hypoxia-inducible factor-1 alphahas a key role inhypoxic preconditioning[J].J Clin Neurosci,2009,16(8):1056-60.
[5] Sun Y,Jin K,Xie L,et al.VEGF-induced neuroprotection,neurogenesis,and angiogenesis after focal cerebral ischemia[J].J Clin Invest,2003,111(12):1843-51.
[6] Feeney D M,Boyeson M G,Linn R T,et al.Responses to cortical injury:Methodology and local effects of contusions in the rat[J].Brain Res,1981,211(1):67-77.
[7] Huang R Q,Cheng H L,Zhao X D,et al.Preliminary study on the effect of trauma-induced secondary cellularhypoxia in brain injury[J].Neurosci Lett,2010,473(1):22-7.
[8] 许少年,刘家传,王金标,等.兔颅脑爆炸伤后早期行高压氧治疗对Cyt C、Bax、Bcl-2表达的影响[J].中国微侵袭神经外科杂志,2012,17(6):270-3.
[9] 孙文江,刘家传,张永明,等.兔颅脑爆炸伤后水通道蛋白-4表达与高压氧治疗作用[J].中国微侵袭神经外科杂志,2011,16(3):136-8.
[10]Umschweif G,Alexandrovich A G,Trembovler V,et al.Hypoxia-inducible factor 1 is essential for spontaneous recovery from traumatic brain injury and is a key mediator ofheat acclimation induced neuroprotection[J].J Cereb Blood Flow Metab,2013,33(4):524-31.
[11]Ding Y H,Luan X D,Li J,et al.Exercise-induced overexpression of angiogenic factors and reduction of ischemia/reperfusion injury in stroke[J].Curr Neurovasc Res,2004,1(5):411-20.
[12]Ma Y,Liu W,Wang Y,et al.VEGF protects rat cortical neurons from mechanical trauma injury induced apoptosis via the MEK/ERK pathway[J].Brain Res Bull,2011,86(5-6):441-6.
[13]刘 科,唐文渊.大鼠创伤性脑损伤VEGF表达的定量分析[J].中华神经外科疾病研究杂志,2008,7(2):165-6.
[14]Yang Z J,Bao W L,Qiu M H,et al.Role of vascular endothelial growth factor in neuronal DNA damage and repair in rat brain following a transient cerebral ischemia[J].J Neurosci Res,2002,70(2):140-9.
Effect ofhypoxia preconditioning on the changes of HIF-1α and VEGF in the brain tissue in rats with traumatic brain injury
Zhang Lei,Liu Jiachuan,Yang Yanyan,et al
(Dept of Neurosurgery,The Clinical College of PLA Affiliated Anhui Medical University,The 105th Hospital of PLA,Hefei 230031)
ObjectiveTo observehypoxic preconditioning on traumatic brain injury(TBI)in rat brain tissue of contusion area ofhypoxia inducible factor-1 and vascular endothelial growth factor expression affect,and to investigatehypoxic preconditioning on brain injury protection mechanism.Methods102 SD rats were randomly divided into control group(Con,n=6),traumatic brain injury group(TBI,n=48)andhypoxic preconditioning group(HPC,n=48).HPC group of rats were firstly placed in ahypobaric chamber forhypoxic preconditioning(50.47 kPa,3 d,3h/d).Subsequently HPC group and TBI group were established rat model of traumatic brain injury by adopting improved feeney free fall.RT-PCR and Western blot were used to detect the changes of HIF-1α and VEGF in each group of brain of contusion area on the 1,4,8,12h and 1,3,7,14 d after injury.ResultsCompared with the control group,the expressions of HIF-1α in the TBI group significantly increased at 4,8,12h and 1,3 d(P<0.05).At the same time,the expressions of VEGF in the TBI group werehigher than those in the control group 4,8,12h and 1,3,7 d after injury(P<0.05).Compared with TBI group,the expression levels of HIF-1α and VEGF increased at 1h in the HPC group,and increased significantly at 4,8,12h and 1,3 d until maintained 7 d after injury(P<0.05).ConclusionHypoxic preconditioning can improve the traumatic brain injury ofhypoxia tolerance,induce the activation of vascular endothelial growth factor,and thus play a role of early brain protection,and its mechanism may be related to HIF-1α and VEGF expression up-regulation.
hypoxic preconditioning;traumatic brain injury;HIF-1α;VEGF;rat;brain tissue
R 651.15
A
1000-1492(2014)04-0447-05
2013-10-28接收
全军医学科技“十二五”科研项目(面上)(编号:CWS11J262);2009年南京军区医学科技创新重点课题(编号:09Z009)
安徽医科大学解放军临床学院(中国人民解放军第105医院)神经外科,合肥 230031
张 磊,男,硕士研究生;刘家传,男,教授,主任医师,硕士生导师,责任作者,E-mail:ljc571017@sina.com

