RP-HPLC法测定大鼠尿及粪中异甘草素含量
杨燕云,许亮,郝淞瑶,张振秋
(辽宁中医药大学药学院,辽宁大连116600)
分析测试
RP-HPLC法测定大鼠尿及粪中异甘草素含量
杨燕云,许亮,郝淞瑶,张振秋*
(辽宁中医药大学药学院,辽宁大连116600)
大鼠空腹12h后,灌胃给药异甘草素(剂量4.0mg·kg-1),按拟定时间间隔收集尿液和粪便,HPLC法测定尿和粪便中异甘草素的含量,研究大鼠口服异甘草素以后排泄规律。结果显示异甘草素在尿和粪便中的累积排泄率分别为2.34±0.13%和5.23±0.54%;异甘草素在尿与粪便中的回收率很低,表明异甘草素在体内极易发生代谢转化。
异甘草素;高效液相色谱法;尿;粪
异甘草素(Isoliquiritigenin,ILG)是甘草黄酮中的一种查尔酮[1],具有抗肿瘤、抗病毒、抗自由基、抑制脂质过氧化等生物活性,能抑制肺癌乳腺癌前列腺癌和宫颈癌等多种肿瘤细胞增殖[2,3],是一种极具开发前景的抗肿瘤药物。因此,鉴于异甘草素较强的药理活性和药用价值,本实验对异甘草素进行排泄研究,为异甘草素新药和含异甘草素的中药新剂型的研制提供一定的体内过程数据。
1 实验部分
1.1 仪器与材料
Agilent 1200型高效液相色谱仪、紫外检测器带色谱工作站(安捷伦科技有限公司);电子分析天平(傲豪斯公司));TGL-16C高速离心机(上海安亭科学仪器厂);WX-80A微型旋涡混合仪(上海沪西分析仪器厂);FJ-200高速分散均质机(上海标本模型厂)。
异甘草素(纯度>98%西安小草植物科技有限公司);异甘草素、槲皮素对照品均购自中国药品生物制品检验所;色谱纯乙腈、甲醇和分析纯磷酸、乙酸均购自山东禹王实业有限公司化工分公司;色谱用水是娃哈哈纯净水。
实验动物:雌性SD大鼠,清洁Ⅱ级,体重180~220g,购自大连医科大学实验动物中心。
1.2 色谱条件
Diamonsil C18(150mm×4.6mm,5μm)色谱柱;以甲醇(含乙酸1%)-水(含乙酸1%)(65∶35)为流动相;流速1.0mL·min-1;检测波长370nm;柱温为室温。
1.3 给药方案与尿粪样品采集
取健康SD大鼠6只,分别置于代谢笼中,收集空白尿样和粪样,禁食24h后灌胃给于异甘草素溶液(4.0mg·kg-1),分别收集0~4,4~8,8~12,12~24,24~36,36~48,48~60和60~72h各时间段的尿样粪样,尿样记录体积,粪样低温干燥后称重,-20℃冷冻保存至分析测定。
1.4 标准系列溶液及内标溶液的配制
异甘草素标准系列溶液的配制取异甘草素对照品20.00mg,精密称定,置于25mL量瓶中,用甲醇溶解并定容至刻度,摇匀即得异甘草素浓度为800μg·mL-1的标准溶液,-20℃保存备用。精密取适量储备液,用甲醇逐级稀释得到异甘草素浓度分别为0.20、0.50、1.00、2.00、5.00、10.0和20.0μg·mL-1的标准系列溶液,在4℃下保存备用。
内标溶液的配制精密称取槲皮素适量,用甲醇溶解配置成2000μg·mL-1的储备液。取0.1mL内标储备液至10mL量瓶中,用甲醇稀释至刻度,制成20.00μg·mL-1的内标溶液,置4℃冰箱中保存。
1.5 样品处理
1.5.1 尿样样品处理取尿样0.2mL,加入甲醇溶液50uL,加入内标溶液20uL(20.00μg·mL-1),加入乙腈-磷酸(95∶5)溶液1mL,涡旋混匀1min,加氯仿1.0mL,涡旋混匀1min,离心5min(10000×10-6),分离上清液,于40℃空气流下挥干,残留物于50uL甲醇溶解,取20μL进样。
1.5.2 粪样样品处理干燥后粪样研细混匀,称取约0.1g,加甲醇100μL,加入内标溶液50μL(20.00μg· mL-1),加入甲醇溶液1.00mL,超声提取30min,离心5min(10000r·min-1),分离上清液,取20μL进样。
2 方法与结果
2.1 部分分析方法确证
方法专属性:在本实验条件下,尿液、粪便中内源性物质不干扰异甘草素测定,见图1。
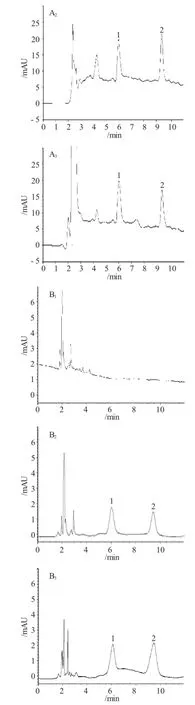
图1 典型色谱图Fig.1 Typical HPLC chromatograms of the isoliquiritigenin in rat urine and feces(1-Quercetin,2-isoliquiritigenin)
A1是尿样空白尿样色谱图,A2是空白尿样加标准品色谱图,A3是大鼠灌胃异甘草素单体的尿样色谱图;B1是粪样空白尿样色谱图,B2是空白粪样加标准品色谱图,B3是大鼠灌胃异甘草素单体的粪样色谱图。由图谱可以看出,空白尿液中内源性物质不影响尿液中异甘草素和槲皮素的测定,而给药后收集的大鼠尿样经处理后得到的色谱图显示尿液中其他代谢产物也不影响异甘草素(2号峰)和内标槲皮素(1号峰)的测定。同样,粪便中内源性物质和代谢产物也不影响粪便中异甘草素和内标槲皮素的测定。
工作曲线制备取空白尿样0.2mL,加入异甘草素对照品系列溶液20μL,配制成相当于异甘草素尿样浓度分别为0.02,0.05,0.10,0.20,0.50,1.00,2.00 μg·mL-1的尿样标准系列样品,除加入50μL甲醇外,按“尿样样品处理”项下操作,建立工作曲线。
取空白粪样0.1g,加入异甘草素对照品系列溶液100μL,配制成相当于异甘草素尿样浓度分别为0.20,0.50,1.00,2.00,5.00,10.0,20.0μg·g-1的粪样系列标准样品,除加入100μL甲醇外,按“粪样样品处理”项下操作,建立工作曲线。
以待测物浓度为横坐标,待测物与内标物峰面积比值为纵坐标,用加权最小二乘法进行计算回归运算,求得尿样直线回归方程Y=5.252X+0.001,r=0.9969;粪样直线回归方程为Y=0.497X+0.001,r=0.9933。
提取回收率取空白尿样0.2mL,按“标准曲线和线性范围”项下的方法配制异甘草素低、高两个浓度(分别为0.05、1.6μg·mL-1)的质量控制样品(QC)分析,按“尿样样品预处理”项下操作,每一个浓度进行三样本分析,进样20μL。峰面积和相同浓度的标准溶液的峰面积的比值计算提取回收率。经测定,异甘草素在低、高两个浓度的提取回收率分别为:68.5±8.3%,72.4±6.7%。
取空白粪样0.1g,按“标准曲线和线性范围”项下的方法配制异甘草素低、高两个浓度(分别为0.5、16μg·g-1)的质量控制样品(QC)分析,按“粪样样品预处理”项下操作,每一个浓度进行三样本分析,进样20μL。峰面积和相同浓度的标准溶液的峰面积的比值计算提取回收率。经测定,异甘草素在低、高两个浓度的提取回收率分别为:92.5±6.1%,89.4±5.5%。
2.2 未知样品测定
按“样品处理”项下操作,每个分析批制备一条工作曲线,同时做高、低两个浓度质控样品,每个浓度进行三样本分析。根据每1个分析批的工作曲线计算QC样品的浓度,6个QC样品中最多允许2个不同浓度的样品超出理论值的15%(最低点为20%),否则此批数据不被接受。
2.3 大鼠给药后尿样、粪样中异甘草素的排泄
大鼠灌胃给药异甘草素单体后,异甘草素在尿样和粪样中的累计排泄量占剂量百分比数据及平均曲线见表1和图2A、2B。
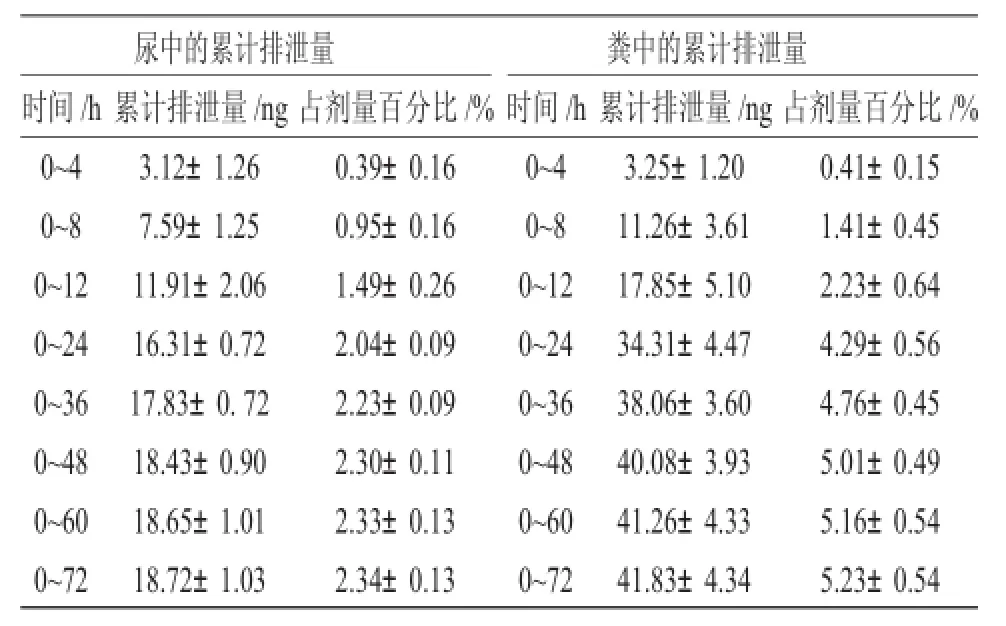
表1 大鼠灌胃异甘草素单体后异甘草素在尿、粪中的累计排泄量Tab.1 Accumulated elimination results of isoliquiritigenin in rat urine and feces
由表1可知,给大鼠灌胃异甘草素后72h后,由尿中排出的异甘草素的量仅达到给药量的2.34± 0.13%,而从粪便中排出的异甘草素的量也仅达到给药量的5.23±0.54%。
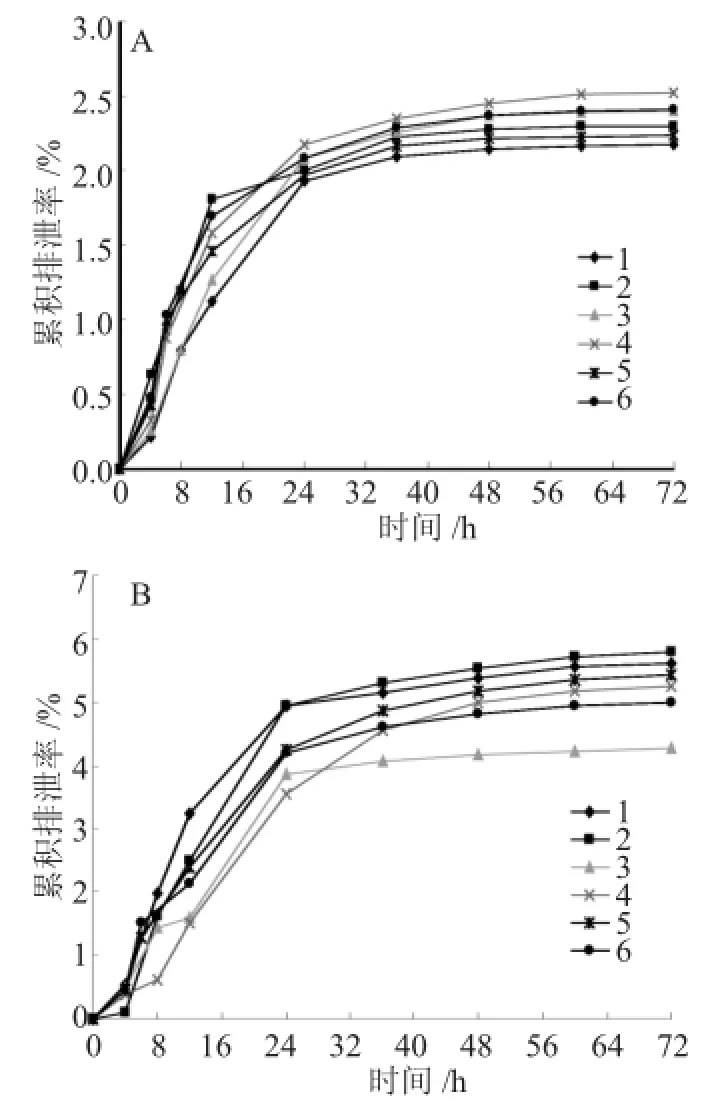
图2 异甘草素在尿、粪中的累计排泄率
由图2可知,异甘草素在尿液中排泄到36h时,达到排泄坪值,达到了排泄总量的95%以上,在粪便中经36h排泄总量也达到粪便中排泄总量的90%以上,大鼠给药后36h,异甘草素原型基本排泄出体外。
3 结论
(1)样品处理时加入磷酸溶液,使异甘草素和槲皮素以游离形式存在,利于氯仿的提取。
(2)尿样研究结果表明,大鼠灌胃异甘草素单体后,尿样累计排泄量在48h基本达到坪值。
(3)异甘草素是查尔酮类,在体内的极易转化代谢,因此,在尿液和粪便中的排泄的总量还不到占给药量的8%。在粪便中排泄量大于在尿中的排泄量,说明,异甘草素可能存在Ⅱ相代谢产物[4],经胆汁排泄入肠道,经肠道菌群代谢后,以原形排出体外。
[1]NIU L.,HU X.W.,GAO J.Study on the isolation of liquiritigenin and isoliquiritigenin[J].Chem World.1996,37(10):539-541.
[2]HSU Y L,KUO P L,LIN CC.Isoliquiritigenin induces apoptosis and cell cycle arrest through p532 dependent pathway in Hep G2 cells[J].Life Sci.,2005,77(3):279-292.
[3]ZHANG J,YANG J,WU J L,et al.Preparation of isoliquiritigenin liposome and its depressive effecton proliferation ofhuman cervical cancer cells in vitro[J].Chin.J.Clin.Pharmacol Ther.2004,9(11): 1268-1272.
[4]Muriel Cuendet,Jian Guo,Yan Luo,Shaonong Chen,et al.Cancer chemopreventive activity and metabolism of isoliquiritigenin,a compound found in licorice[J].Cancer Prev.Res.(Phila).,2010,3(2):221-232.法[S].
[2]王力,汪世联.双波长分光光度法同时测定水样中的Cr(Ⅲ)和Cr(Ⅵ)[J].黑龙江科技信息,2007,(2):13.
[3]徐红纳,王英滨.双波长分光光度法同时测定水样中的Cr(Ⅲ)和Cr(Ⅵ)[J].分析试验室,2008,27(5):34-37.
[4]陈亚红,田丰收,马青青.双波长分光光度法测定废水中痕量铬(Ⅵ)[J].冶金分析,2009,29(1):67-69.
[5]赖永忠,王亮根.两种双波长法用于减小浊度对废水中六价铬测定结果的影响[J].化学工程师,2012,26(10):27-30;35.
[6]赖永忠.减小水样浊度对废水中六价铬测定结果影响的方法探讨[J].岩矿测试,2012,31(1):172-177.
[7]金洪洙,张晓霞,刘东方,等.浊点萃取-分光光度法测定水中痕量六价铬[J].环境监测管理与技术,2009,21(4):51-53.
[8]左银虎.离子液体萃取二苯碳酰二肼分光光度法测定水中的Cr(Ⅵ)[J].光谱实验室,2011,28(6):3004-3007.
[9]US EPA Method 218.6.Determination of dissolved hexavalent chromium in drinking water,groundwater,and industrialwastewater effluents by ion chromatography[S].1994.
[10]吴德好.测定饮用水中六价铬的新方法[J].中国卫生检验杂志,2005,15(7):832;866.
[11]Sun Z,Liang P.Determination ofCr(III)and totalchromiumin water samples by cloud pointextraction and flame atomic absorption spectrometry[J].Microchimica Acta,2008,162(1-2):121-125.
[12]莫曦明,彭寨玉,徐淑暖,等.电感耦合等离子体质谱法(ICP-MS)测定饮用水中六价铬[J].中国卫生检验杂志,2009,19(8):1784-1785.
[13]Xing L,Beauchemin D.Chromium speciation at trace level in potable water using hyphenated ion exchange chromatography and inductively coupled plasma mass spectrometry with collision/reaction interface[J].JournalofAnalyticalAtomic Spectrometry,2010,25(7):1046-1055.
[14]Wu X,Zhao H,Chen X,Hu Z,Zhao Z,Hooper M.Direct spectrophotometric determination ofchromium by microwave-oven induced flow-injection analysis[J].Analytica Chimica Acta,1998,374(1):61-66.
[15]曹凤梅,张新申,赵欢欢.流动注射分析法测定制革排放污水中的铬(Ⅵ)[J].化学研究与应用,2011,23(3):381-384.
[16]曾铭,李树伟,李小燕.罗丹明B荧光猝灭法测定痕量Cr(Ⅵ)的研究[J].西南民族大学学报(自然科学版),2005,31(5):728-730.
[17]王骏,胡梅,张卉,张喜琦,等.液相色谱-质谱法对饮用水中六价铬的测定[J].分析测试学报,2009,28(12):1468-1470.
[18]Grabarczyk M.Speciation analysis of chromium by adsorptive stripping voltammetry in tap and river water samples[J].Electroanalysis,2008,20(20):2217-2222.
[19]董国斌,朱永春.蟹壳粉-铋修饰碳糊电极吸附测定污水中的Cr(Ⅵ)[J].分析测试学报,2010,29(12e):1205-1208.
[20]王玉娥.示波极谱法测定水中的六价铬[J].现代预防医学,2003,30(5):745.
Determination of contents of isoliquiritigenin in rat urine and feces by RP-HPLC
YANG Yan-yun,XU Liang,HAO Song-yao,ZHANG Zhen-qiu*
(College of Pharmacy,Liaoning University of TCM,Dalian 116600,China)
The rats were fasted for 12h but allowed water ad libitum before the isoliquiritigenin was orally administered at a dose of 4.0mg·kg-1,and urine and feces were collected after an proposed interval.An HPLC method was applied to determine the contents of isoliquiritigenin in rat urine and feces,the elimination law of isoliquiritigenin was studied.The results showed that rate of accumulation elimination of isoliquiritigenin in rat urine and feces were 2.34±0.13%and 5.23±0.54%respectively and showed the isoliquiritigenin was metabolism or conversion highly in vivo.
isoliquiritigenin;RP-HPLC;urine;feces
O657.7
A
1002-1124(2014)03-0021-03
2014-01-08
杨燕云(1978-),博士,辽宁中医药大学,讲师,主要从事药物分析工作。
张振秋(1964-),教授,博士生导师,主要从事中药质量控制和复方配伍机制研究。

