重组腺相关病毒质量控制的qPCR技术研究进展
肖桂清,杨会勇,刁勇
(华侨大学 分子药物研究院,福建 泉州362021)
重组腺相关病毒(r AAV)载体是基因治疗领域最具前景的载体之一,世界范围内已有100余项r AAV基因药物已完成或正在进行临床研究,且治疗效果显著,如治疗Leber′s先天性黑内障[1-3],以及治疗脂蛋白脂酶缺乏症.除产业化制备工艺外,r AAV基因药物的质量控制技术,也是制约其临床应用的因素之一,特别是在缺少准确、可靠的测定r AAV滴度的标准方法[4-7].当前,r AAV滴度测定所采用的方法按原理的不同可分为生物测定和物理测定两大类.其中生物测定法包括感染滴度法和转导滴度法,物理测定法包括病毒颗粒滴度法和基因组滴度法.因r AAV基因组滴度(GC)理论上与其颗粒滴度(P)和转导滴度(TU)成线性关系,且测定简便,所以成为最常用的滴度指标[8].qPCR是常用的r AAV基因组滴度测定法[9],但传统的qPCR法存在适用范围窄[10]、易产生系统性误差[11]和受杂质干扰[12]等问题.基于此,本文对qPCR技术在r AAV的GC测定中的最新应用成果进行综述,并对qPCR在r AAV的GC测定中存在的问题及解决策略进行分析.
1 ITR-qPCR法的普适性
传统qPCR法测定r AAV的GC时,其靶标序列主要是转基因序列或调控元件序列[13].因此,每种r AAV载体均需要根据自身转基因表达体系而设计引物或探针,qPCR的反应条件也不尽一致,难以GC为质控指标进行横向比较.即使对于同一种r AAV载体,不同实验室所采用的靶标序列及反应条件也存在很大差异.如果能设计出一种不依赖于转基因表达体系,对于各种r AAV可以普遍适用的GC定量方法,以及对于r AAV载体的质量控制都显得意义重大.

图1 线型单链r AAV载体基因组结构图[10]Fig.1 Schematic drawing of linear and single-stranded r AAV vector genomes[10]
腺相关病毒(AAV)为单链线状DNA病毒,其基因组仅编码病毒复制与包装所必需的Rep和Cap基因.AAV基因组两端的反向末端重复序列(ITR)是包装AAV所必需的最少的自身序列[14-16].每个ITR含有145个核苷酸,前125个核苷酸会形成回文序列,折叠成“T”形二级发夹结构(图1).ITR在AAV复制起始阶段发挥关键作用,是AAV基因组自我复制的引物[16],也是形成环状AAV中间体的关键结构[17].ITR是各种r AAV载体基因组所保留的AAV源序列,也是唯一的共同序列.因此,将ITR序列作为qPCR的检测靶标,正好能满足普适性质量控制指标的设计理念.
Aurnhammer等[10]首次以r AAV中的ITR序列为靶标,探索了通用性ITR-qPCR方法的可行性.AAV2 ITR序列(图2)的5′端含有两个臂回文结构(B-B′和 C-C′)和一个茎回文结构(A-A′),3′末端是单链形式的 D序列位.ITR-qPCR法所设计的引物和探针,其特异性靶向AAV 5′-ITR序列的一个 DNA 序列(62nt):反向引物(16nt)从 C′向 A′方向扩增,正向引物(21nt)由D向 A′方向扩增,探针(21nt)位于ITR正反引物间.通过定性PCR证明所设计的引物能够扩增出62 bp的PCR产物,且退火温度在55~64.2℃之间,扩增特异性良好.
ITR-qPCR法具有以下几个优点:适用范围广,普遍适用于定量检测绝大多数r AAV载体颗粒中的单链DNA(ssDNA)和载体质粒的双链DNA(dsDNA);灵敏度高,检测阈值约为50个质粒拷贝数,即200个AAV ITR靶向位点;重复性好,批间及批内误差均低于目前被广泛认可的临床试验阈值15%,能满足临床实验室所制定的最严格的质量标准[18-20].蒙青林等[21]同样用靶向ITR序列的qPCR法检测r AAV2的GC,并与ELISA法测定的r AAV病毒滴度和转导法测定的r AAV转导滴度进行比较,结果P/GC为59.6,GC/TU 为91.2,与 M.Lock等[22]报道的 AAV2标准品(AAV2 RSM)所测结果相近(P/GC=28,GC/TU=64.4).ITR-qPCR法所具有的普适性,使其在r AAV滴度测定中具有更广泛的应用价值,且有助于推动AAV滴度检测的标准化.但该法也存在不足:r AAV广泛存在的ITR发夹结构会影响qPCR过程中的变性与退火等过程,特别是对自身互补型r AAV(scr AAV)影响更显著.
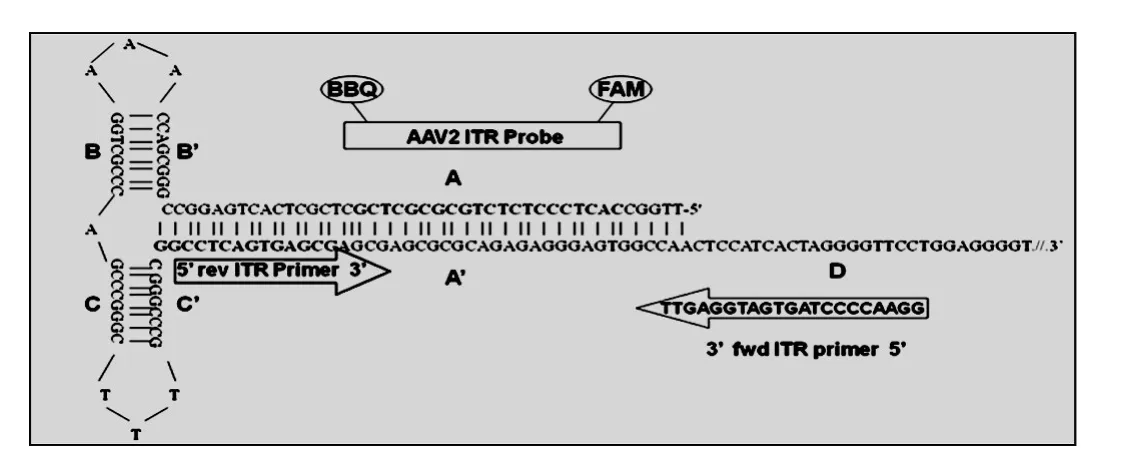
图2 r AAV2 ITR-qPCR法特异性引物和探针的设计[10]Fig.2 Design of r AAV2 ITR-qPCR primers and probe[10]
2 测定scr AAV基因组滴度时的系统误差
scr AAV由于其转染效率高于单链r AAV(ssr AAV),越来越受到科研工作者的亲睐.在Hela细胞中,scr AAV的转染效率是相应ssr AAV的5~140倍,对于ssr AAV难转导的细胞,如B16F10,NIH3T3和3LL细胞,scr AAV都能有效转染[23].不同于ssr AAV的DNA单链结构,scr AAV载体的末端之一为突变的ITRΔtrs[24],在包装时不能被切割而形成自身互补的DNA双链结构 (图3).在变性过程,scr AAV基因组形成单链结构.但在退火过程中,由于scr AAV基因组中ITRΔtrs的存在,可以迅速形成发夹结构,促进与其相连的互补DNA链的退火(图4a).因此,引物与模板基因组结合的几率则大大降低,导致所测GC低于DNA dot blotting等测得的GC值达10倍之高[11].
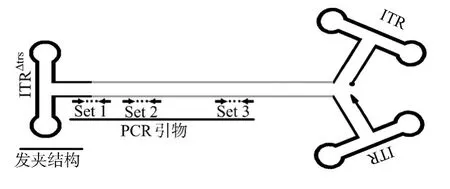
图3 自身互补型r AAV载体结构及其引物位置设计示意图[11]Fig.3 Diagram of the self-complementary r AAV vector genome with primer sites indicated[11]
Fagone等[11]研究了如何降低qPCR法的系统误差,发现特异性引物的作用位置对qPCR法所测结果影响很大.目的扩增产物距离ITRΔtrs发夹结构越远,系统误差越小,如图3中引物set3距ITRΔtrs1 204 bp,所引起系统误差显著小于set 1与set 2.因此,排除scr AAV的ITRΔtrs发夹结构对与其相邻扩增子的干扰,是成功降低qPCR法系统误差的关键.
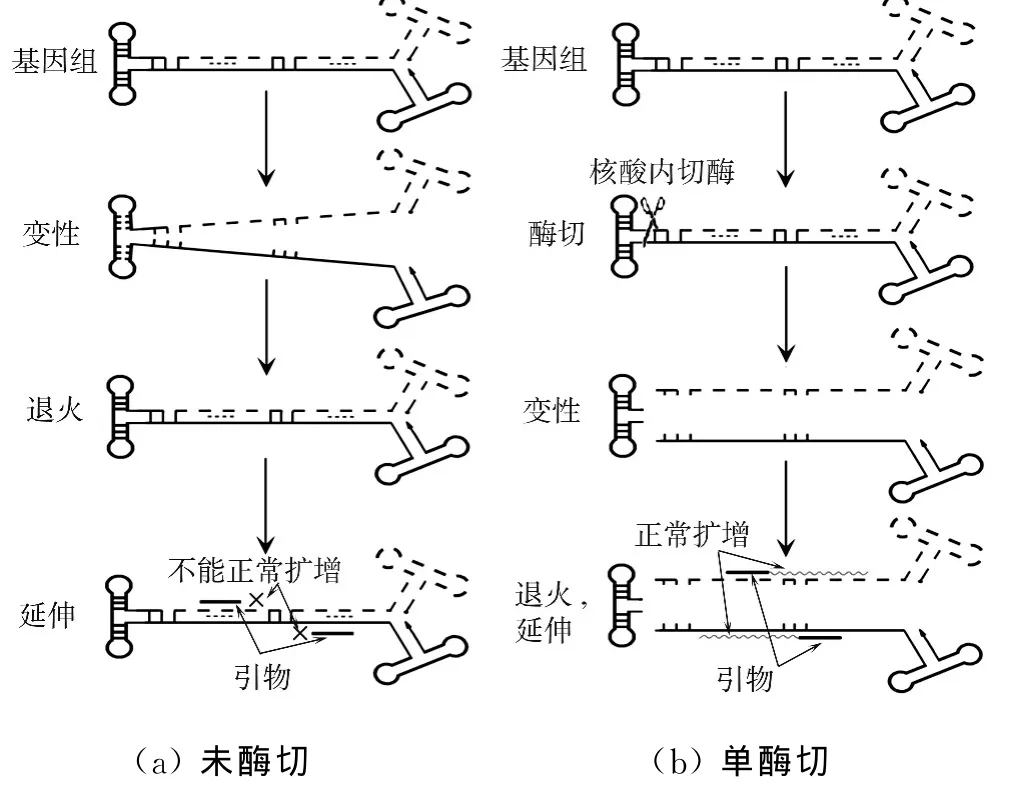
图4 scr AAV双链病毒基因组酶切的qPCR流程示意图Fig.4 Scheme of qPCR of scr AAV vector genome digested with endonuclease
Fagone等[11]对传统qPCR法进行了改良,用限制性核酸内切酶去除ITRΔtrs发夹结构,得到核酸内切酶qPCR法(ED-qPCR).ED-qPCR的变性过程使互补结合的双链结构解链成两条单链,在退火时引物与模板基因组的结合排除了ITRΔtrs的影响,可以进行正常的扩增(图4b),从而成功解决了qPCR法测定scr AAV的系统误差问题.
3 r AAV感染滴度的测定
GC并不能反映r AAV的功能,感染滴度和转导滴度(TU)才是最好的功能指标.研究发现,r AAV的GC与病毒感染滴度的比值变动范围很宽,可达56~1 000[25-27].所以GC的数值尚不能表征r AAV的功能,而r AAV感染滴度所反映的是r AAV感染细胞及其在细胞内的复制效率,是评价其细胞内功能的重要指标,只有成功感染后才可能表达转基因.因此,r AAV感染滴度的测定对于r AAV的临床前及临床研究很重要.
Clark等[28]首次利用qPCR法定量r AAV的GC和感染滴度,所得二者比值为60~120.Zhen等[29]改进了以上方法,将野生型腺病毒与r AAV共同感染可表达AAV2 Rep/Cap基因的D7-4细胞系,以促进r AAV基因组的复制;共感染48 h后,采用qPCR法测定r AAV基因组拷贝数,最后经寇式方程计算感染滴度.因在每一个成功感染r AAV的细胞内r AAV基因组均得以大量复制,大大提高qPCR测定灵敏度,可实现单个病毒感染事件的检测.用该法测定6种含不同转基因的AAV-2载体,GC与感染滴度比值为4~19,均低于先前文献的报道.与之前的方法相比,该法更能准确地反映r AAV感染滴度的真实性.
改良后的qPCR法不仅适用于已纯化的r AAV样品,对于未纯化的r AAV样品同样适用.未纯化的r AAV样品经高度稀释可降低未知成分的干扰,采用DnaseⅠ可降解未包装的DNA,NaOH可去除非特异性RNA,从而可成功消除影响qPCR法准确测定的杂质干扰[12].该法适用于多种AAV-2载体感染滴度的测定,而对于不同表型的r AAV,只需对其靶细胞类型和感染条件进行重新调整.但该法也存在不足,因为r AAV载体在浓缩的时候易发生不同程度的聚集,会干扰该法的测定;Zhen等[29]发现发生聚集的r AAV载体的GC与感染滴度比值高于未发生聚集的AAV载体达12.8倍,这可能是由于聚集的r AAV失去感染活性所致.
4 r AAV中rcAAV污染率的检测
在r AAV载体的生产过程中,表达衣壳蛋白的辅助质粒或宿主细胞DNA会被误包装或重组,成为可复制型AAV(rc AAV)或复制缺陷型AAV,其中rc AAV转导细胞后表达的衣壳蛋白被认为是引起细胞免疫毒性的原因之一.采用传统工艺生产的r AAV,rc AAV污染率可高达10%[30],即使采用优化工艺,rc AAV污染率也可达0.4%~1.0%.因此,r AAV中rc AAV污染率的测定非常必要.
由于r AAV制品中rc AAV的危害不小,但量相对较低,因此必须设计出高度灵敏的方法才能对其进行检测和定量分析.Mayfield等[31]设计出一种通过靶向3′末端的AAV-2 ITR D序列和5′末端的AAV-2 rep序列的高度灵敏的qPCR法,用于检测和定量分析r AAV中rc AAV的污染率,该法可以定量的最低限度(LOQ)为1×109vg(载体基因组)r AAV制品中所含的0.256 fg线性质粒DNA或拷贝数为56的rc AAV,从而成功解决r AAV中rc AAV污染率检测的难题.
5 展望
r AAV基因药物的临床研究已充分证实其有效性和安全性,但其质量控制体系的建立却滞后于临床应用.r AAV基因药物的准确定量,是临床用药规范化的前提,也是不同工艺或不同厂家生产产品横向比较的依据[32].qPCR技术操作简单,无需复杂的产物处理过程,整个测定过程只需2~3 h,且灵敏度高,测定GC的最低检测限为100 vg[28];批间及批内误差均低于目前被广泛认可的临床试验阈值15%[18-20].
ITR-qPCR具有普适性,可定量检测绝大多数r AAV载体,使r AAV滴度检测更加标准化;ED-qPCR则成功解决了qPCR定量scr AAV滴度所引起的系统性误差问题,弥补了长期以来人们对qPCR检测scr AAV滴度认识的不足;检测r AAV感染滴度的qPCR法灵敏度的提高,可测到比以往更高的病毒感染滴度,使应用于临床研究的r AAV功能指标更加可靠;rc AAV污染率的qPCR法准确测定,为合格的r AAV进入临床进行严格把关.qPCR技术所具备的优势已充分展现了其未来广阔的应用前景,为此,负责制定高质量r AAV参比标准的腺相关病毒参比标准事务委员会推荐qPCR作为定量r AAV滴度的方法[33].随着qPCR技术不断改进和发展,其作为r AAV质量控制标准的方法广受推广,极大促进了r AAV基因药物的临床应用进程.
[1] BAINBRIDGE J W B,SMITH A J,BARKER S S,et al.Effect of gene therapy on visual function in Leber′s congenital amaurosis[J].N Engl J Med,2008,358(21):2240-2248.
[2] MAGUIRE A M,HIGH K A,AURICCHIO A,et al.Age-dependent effects of RPE65 gene therapy for Leber′s congenital amaurosis:A phase1 dose-escalation trial[J].Lancet,2009,374(9701):1597-1605.
[3] MAGUIRE A M,SIMONELLI F,PIERCE E A,et al.Safety and efficacy of gene transfer for Leber′s congenital amaurosis[J].N Engl J Med,2008,358(21):2240-2248.
[4] VELDWIJK M R,SCHIEDLMEIER B,KLEINSCHMIDT J A,et al.Superior gene transfer into solid tumour cells than into human mobilised peripheral blood progenitor cells using helper virus-free adeno-associated viral vector stocks[J].Eur J Cancer,1999,35(7):1136-1142.
[5] GRIMM D,KERN A,PAWLITA M,et al.Titration of AAV-2 particles via a novel capsid ELISA:Packaging of genomes can limit production of recombinant AAV-2[J].Gene Therapy,1999,6(7):1322-1330.
[6] SUMMERFORD C,SAMULSKI,R J.Viral receptors and vector purification:New approaches for generating clinical-grade reagents[J].Nat Med,1999,5:587-588.
[7] SALVETTI A,ORÈVE S,CHADEUF G,et al.Factors influencing recombinant adeno-associated virus production[J].Hum Gene Ther,1998,9(5):695-706.
[8] 刁勇,马健,李欣燕,等.表达血管抑制因子的腺相关病毒载体的构建及其体内外活性[J].生物工程学报,2008,24(11):1949-1954.
[9] VELDVIJK M R,TOPALY J,LAUFS S,et al.Development and optimization of a real-time quantitative PCR-based method for the titration of AAV-2vector stocks[J].Mol Ther,2002,6(2):272-278.
[10] AURNHAMMER C,HAASE M,MUETHER N,et al.Universal real-time PCR for the detection and quantification of adeno-associated virus serotype 2-derived inverted terminal repeat sequences[J].Hum Gene Ther Methods,2012,23(1):18-28.
[11] FAGONE P,WRIGHT J F,NATHWANI,et al.Systemic errors in quantitative polymerase chain reaction titration of self-complementary adeno-associated viral vectors and improved alternative methods[J].Hum Gene Ther Methods,2011,23(1):1-7.
[12] MAYGINNES J P,REED S E,BERG H G,et al.Quantitation of encapsidated recombinant adeno-associated virus DNA in crude cell lysates and tissue culture medium by quantitative,real-time PCR[J].Journal of Virological Methods,2006,137(2):193-204.
[13] ROHR U P,WULF M A,STAHN S,et al.Fast and reliable titration of recombinant adeno-associated virus type-2 using quantitative real-time PCR[J].Journal of Virological Methods,2002,106(1):81-88.
[14] YAN Z,ZAK R,ZHANG Y,et al.Inverted terminal repeat sequences are important for intermolecular recombination and circularization of adeno-associated virus genomes[J].J Virol,2005,79(1):364-379.
[15] MCALISTER V J,OWENS R A,VICTOR J.Preferential integration of adeno-associated virus type 2 into a polypyrim-idine/polypurine-rich region within AAVS1[J].J Virol,2007,81(18):9718-9726.
[16] DAYA S,BERNS K I.Gene therapy using adeno-associated virus vectors[J].Clinical microbiology reviews,2008,21(4):583-593.
[17] MUSATOV S,ROBERTS J,PFAFF D,et al.A cis-acting element that directs circular adeno-associated virus replication and packaging[J].Journal of Virology,2002,76(24):12792-12802.
[18] BARNETT D,GRANGER V,KRAAM J,et al.Reduction of intra-and interlaboratory variation in CD34+stem cell enumeration using stable test material,standard protocols and targeted training[J].Br J Haematol,2000,108(4):784-792.
[19] CHEN J C,BIGELOW N,DAVIS B H.Proposed flow cytometric reference method for the determination of erythroid F-cell counts[J].Cytometry,2000,42(4):239-246.
[20] RUMKE C L.The statistically expected variability in differential leukocyte counting[M].KOEPKE J A.Differential Leukocyte Counting.Illinois:College of American Pathologists,1977:39-45.
[21] 蒙青林,张彬彬,张春.测定重组腺相关病毒基因组滴度的qPCR新方法[J].生物工程学报,2013,29(2):235-242.
[22] LOCK M,MCGORRAY S,AURICCHIO A,et al.Characterization of a recombinant adeno-associated virus type 2 reference standard material[J].Hum Gene Ther,2010,21(10):1273-1285.
[23] WANG Z,MA H I,LI J,et al.Rapid and highly efficient transduction by double-stranded adeno-associated virus vectors in vitro and in vivo[J].Gene Ther,2003,10(26):2105-2211.
[24] MCCARTY D M,FU H,MONAHAN P E,et al.Adenoassociated virus terminal repeat(TR)mutant generates self complementary vectors to overcome the rate-limiting step to transduction in vivo[J].Gene Ther,2003,10(26):2112-2118.
[25] FLOTTE T R,SOLOW R,OWENS R A,et al.Gene expression from adeno-associated virus vectors in airway epithelial cells[J].American Journal of Respiratory Cell and Molecular Biology,1992,7(3):349-356.
[26] RUFFING M,ZENTGRAF H,KLEINSCHMIDT J A.Assembly of viruslike particles by recombinant structural proteins of adeno-associated virus type 2 in insect cells[J].J Virol,1992,66(12):6922-6930.
[27] ZOLOTUKHIN S,BYRNE B J,MASON E,et al.Recombinant adeno-associated virus purification using novel methods improves infectious titer and yield[J].Gene Ther,1999,6(6):973-985.
[28] CLARK K R,LIU X,MCGRATH J P,et al.Highly purified recombinant adeno-associated virus vectors are biologically active and free of detectable helper and wild type viruses[J].Hum Gene Ther,1999,10(6):1031-1039.
[29] ZHEN Z,ESPINOZA Y,BLEU T,et al.Infectious titer assay for adeno-associated virus vectors with sensitivity sufficient to detect single infectious events[J].Hum Gene Ther,2004,15(7):709-715.
[30] WRIGHT J F.Transient transfection methods for clinical adeno-associated viral vector production[J].Hum Gene Ther,2009,20(7):698-706.
[31] MAYFIELD T L,KORYTOV I,FRANCIS J D,et al.Detection and quantification of rc AAV in r AAV stocks by real-time qPCR[J].Molecular Therapy,2006,13:S196-S197.
[32] MOULLIER P,SNYDER R O.International efforts for recombinant adeno-associated viral vector reference standards[J].Molecular therapy:The Journal of the American Society of Gene Therapy,2008,16(7):1185-1188.
[33] SNYDER R O,FLOTTE T R.Production of clinical-grade recombinant adeno-associated virus vectors[J].Current opinion in biotechnology,2002,13(5):418-423.

