食品过敏原大豆成分LAMP实时浊度检测法的建立
邝筱珊,成晓维,游淑珠,王小玉,刘李登,冯家望
(珠海出入境检验检疫局检验检疫技术中心,广东珠海 519015)
食品过敏原大豆成分LAMP实时浊度检测法的建立
邝筱珊,成晓维,游淑珠,王小玉,刘李登,冯家望*
(珠海出入境检验检疫局检验检疫技术中心,广东珠海 519015)
根据过敏原大豆的保守内源基因Lectin的序列,设计6条特异性LAMP引物,利用实时浊度仪对反应体系中扩增产物的实时监控筛选出最佳引物,建立食品中过敏原大豆成分的环介导等温扩增(LAMP)检测方法,并对该方法的特异性、灵敏度、稳定性进行了评价。结果表明:该方法能够特异性检出食品中的过敏原大豆成分,特异性高,灵敏度达0.1%(w/w)。对含有大豆成分为10%、1%、0.1%、0%(w/w)的样品分别进行20次重复实验,其稳定性好,假阳性和假阴性率为0%。本实验建立的LAMP方法适用于特异性快速检测食品中的过敏原大豆成分。
环节导等温扩增法(LAMP),实时浊度仪,过敏原,大豆,检测
食物过敏是人的机体对外源物质(过敏原)产生的一种常见变态反应。在过去的20年里,食物过敏的发病率显著上升,过敏原己成为食品安全隐患之一[1]。各国政府和国际组织非常重视这个问题,先后通过严密的科学调查和理发论证,相继修改和出台规范食品中过敏物质标识的法律方案,对食品标签上过敏原成分的标注作出严格规定,尤其是欧美、日本等发达国家[2]。我国的国家标准GB7718-2011《预包装食品标签通则》也推荐标识大豆等常见致敏物质。大豆作为含有丰富蛋白质的豆科植物,由于其丰富的营养特性和功能属性被广泛应用于配方食物、肉类和家禽类产品、面包点心、乳制品和各种可食用产品中。据报道,有90%的食物过敏情况都是由八大类食品造成的,而大豆就是其中之一[3]。大豆过敏患者在摄食大豆及其制品或者吸入大豆粉末时可能出现恶心、呕吐、舌咽肿、嘴唇红肿、口腔疼痛和一些肠道疾病等临床症状,严重的会导致休克甚至死亡[4]。关于食用大豆后过敏致死的事件已有报道[5]。
目前,对食物过敏最有效最直接的治疗手段是避免食用含有过敏原的食物,因此大豆过敏原检测技术对大豆过敏患者的安全消费意义重大。食物过敏原检测方法既可以基于蛋白,也可以基于DNA[6-8]。前者包括电泳法[9]、色谱法、质谱法和免疫学方法,如酶联免疫吸附实验(ELISA)[10]、放射过敏原吸收抑制实验[11]、免疫印迹[12]和免疫扩散及各种试剂盒等;后者主要采用各种PCR方法,如实时荧光定量PCR、多重PCR等[13-15]。也有新型技术如生物传感器[16]、生物芯片技术[17]等方法。环介导等温扩增技术(loop mediated isothermal amplification,LAMP)是Notami等开发的一种简单快速、特异性强的体外恒温扩增方法[18]。该方法针对靶基因的6个区域设计4条特异的引物,利用链置换DNA聚合酶在恒温条件保温条件下完成核酸扩增反应,通过观察副产物焦磷酸镁沉淀的浊度或者显色反应即可判定结果。无需昂贵的仪器设备,具有耗时、操作简单的优势,更适合基层的推广应用。本研究采用LAMP实时浊度法对食品中过敏原大豆成分进行检测,为食品的风险评估、加工、管理及过敏原成分的标识提供可靠的技术保障。
1 材料与方法
1.1 材料与仪器
大豆、四季豆、羽扇豆、鹰嘴豆、荷兰豆、豌豆、扁豆、豇豆、蚕豆、红豆、绿豆、燕麦、荞麦、黑麦、小麦、大麦、花生、芝麻、鸡肉、鱼肉、牛肉、鹅肉、鸭肉、羊肉、猪肉、虾肉、蟹肉、扇贝、胡萝卜、芹菜、核桃 购于珠海超市或实验室自留样;食品样品 购于珠海超 市 ;DNA 提 取 试 剂 盒 Biosprint 15 DNA plant kit QIAGEN公司;Bst DNA polymerase large fragment New England Biolabs公 司 ;甜 菜 碱(Betaine) 10 × Thermol Buffer,Sigma公司;dNTPs 宝生物工程(大连)有限公司;LAMP引物 宝生物工程(大连)有限公司。
LA-320C型LAMP实时浊度仪 日本荣研化学株式会社;NanoDrop型紫外分光光度计 美国Thermo公司;PCR仪7500Fast型实时荧光定量 美国ABI公司。
1.2 实验方法
1.2.1 LAMP引物设计 60~65℃是双链DNA复性及延伸的中间温度,DNA在65℃左右处于动态平衡状态,任何一条引物与双链DNA的互补部位进行碱基互补配对延伸的时候,另一条链就会脱落变成单链。LAMP方法正是利用这一特点进行反应的。利用4条特异性引物依靠一种高活性链置换DNA聚合酶,使得链置换DNA的合成在不停的自我循环[19]。LAMP反应阶段,随着反应的进行,dNTP会释放出焦磷酸根离子,焦磷酸根离子遇到Mg2+会生成焦磷酸镁白色沉淀,而实时浊度仪每6s自动对每个反应管的浊度进行测定,可实时监控扩增反应中沉淀物的增加。根据LAMP引物设计的原则,在NCBI网站中查找Lectin基因相关序列,利用DNAMAN软件对查到的各序列进行比对,使用在线设计软件Primer Explorer version4和LAMP Designer软件设计特异引物,设计多套LAMP引物。利用实时浊度仪对反应体系中扩增产物的实时监控筛选出最佳引物。共6条分别为内引物FIP包含F1c(与Fl区域互补)和F2序列,内引物BIP包含B1c(与B1区域互补)和B2序列,外引物为F3和B3序列,本研究在内外引物的基础上引入环引物FLP和BLP。引入环引物后,当第一阶段的哑铃状茎环结构形成,环引物能与其结合并引导扩增。即引入环引物后,自主扩增增加了两个位点,加快扩增进程,大大缩短了反应时间。引物序列见表1。
1.2.2 样品DNA提取 将待测样品用洁净研钵或粉碎装置充分研磨混匀,食品样品的取样部位尽可能覆盖其各种原料成分。称取1g样品进行DNA提取,DNA提取步骤按试剂盒的说明书进行,所提取的DNA经紫外分光光度计检测浓度并稀释至100ng/μL,于-20℃保存备用。
1.2.3 LAMP扩增反应 反应总体积为25μL,包括10× Thermol Buffer 2.5μL、内引物FIP和BIP(40μmol/L)各1.0μL、外引物F3和B3(10mol/L)各0.5μL、FLP和BLP(20μmol/L)各 1.0μL、dNTPs(10mmol/L)4.0μL、甜 菜碱(5mol/L)5.0μL、硫 酸 镁(150mmol/L)1.0μL、Bst DNA聚合酶(8U/μL)1.0μL、模板DNA(约100ng/μL )2.0μL,用灭菌去离子水补齐到25.0μL,充分混匀。实时浊度仪63℃恒温反应1h,最后80℃灭活5min结束反应。
1.2.4 特异性实验 利用建立的LAMP实时浊度法,分别以大豆、四季豆、羽扇豆、鹰嘴豆、荷兰豆、豌豆、扁豆、豇豆、蚕豆、红豆、绿豆、燕麦、荞麦、黑麦、小麦、大麦、花生、芝麻、鸡肉、鱼肉、牛肉、鹅肉、鸭肉、羊肉、猪肉、虾肉、蟹肉、扇贝、胡萝卜、芹菜、核桃的DNA作为LAMP反应模板,以ddH2O为空白对照,进行LAMP反应,以评价该方法的特异性。
1.2.5 灵敏度实验 用研磨机将大豆和小麦磨成粉末状,并60℃烘干6h。用小麦粉配成大豆粉含量为10%、5%、1%、0.5% 、0.1% 、0.05% 和0.01%(W/W)的混合样品,以小麦粉为阴性对照,用于过敏原大豆成分的重量比灵敏度测试。
1.2.6 稳定性实验 利用建立的LAMP实时浊度法,对大豆含量为10%、1%、0.1%、0%(w/w)4个不同浓度的样品分别进行20次重复扩增,以评价该方法的稳定性。
1.3 数据处理
利用实时浊度仪的LA-320CE软件分析扩增反应,横坐标为扩增时间,纵坐标为浊度值,产生浊度曲线表明发生扩增反应,并筛选浊度出峰时间早,峰值较高的引物为反应引物。

表1 LAMP引物序列Table 1 LAMP primers sequence
2 结果与分析
2.1 LAMP引物筛选结果
用大豆DNA作为阳性模板进行引物的初步筛选,在所设计的多套引物中,选择发生了扩增反应,且出峰时间较早,峰高值较高的一套引物。该套引物出峰时间为45min左右,峰高为0.16(见图1)。对该套引物引入环引物进行优化,引入环引物后,出峰时间提前至22min左右(见图2)。
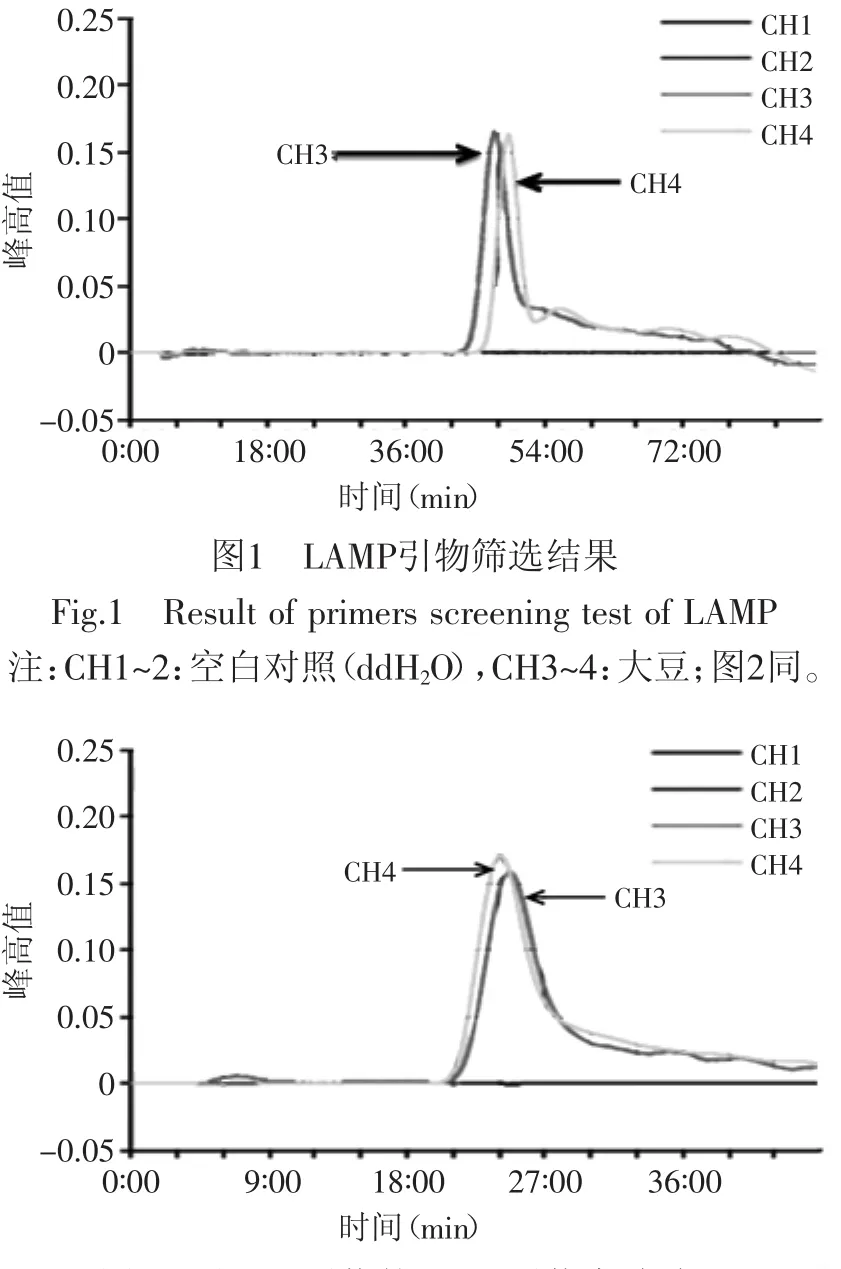
图2 引入环引物的LAMP引物实验结果Fig.2 Result of LAMP primers with ring
2.2 特异性实验结果
利用建立的LAMP实时浊度法,对31种成分进行检测。结果显示,除大豆出现了阳性扩增外,其余30种成分均未发生扩增。实验表明该LAMP引物具有特异性(见图3)。
2.3 灵敏度实验结果
利用建立的LAMP实时浊度法,对大豆含量为10%、5%、1%、0.5%、0.1%、0.05%、0.01%(w/w)的样品进行检测,含量为10%、5%、1%、0.5%、0.1%的样品均发生了扩增反应,含量为0.05%、0.01%及阴性对照小麦粉样品未发生扩增反应(见图4),实验表明,该方法检测大豆过敏原成分的灵敏度为0.1%(w/w)。
2.4 稳定性实验结果
利用建立的LAMP实时浊度法,对大豆含量为10%、1%、0.1%、0%(w/w)的4个样品分别进行20次重复实验,假阳性率和假阴性率为0%,表明本实验建立的LAMP实时浊度法对过敏原大豆成分的检测具有良好的稳定性。

图3 LAMP实时浊度法特异性实验结果Fig.3 Results of specificity test by real-time turbidimeterbased LAMP
2.5 实际样品检测
从超市收集大豆加工产品38份以及不含大豆成分的样品22份。用本实验建立的LAMP实时浊度法对这60个样品进行检测,并与荧光PCR法的结果进行比较,评价该方法的实际应用价值,实验结果见表3。实时荧光PCR法根据SN/T 1961.19-2013进行。

图4 LAMP实时浊度法灵敏度实验结果Fig.4 Results of sensitivity test by real-time turbidimeterbased LAMP

表2 实际样品检测Table 2 Test results of commercial samples
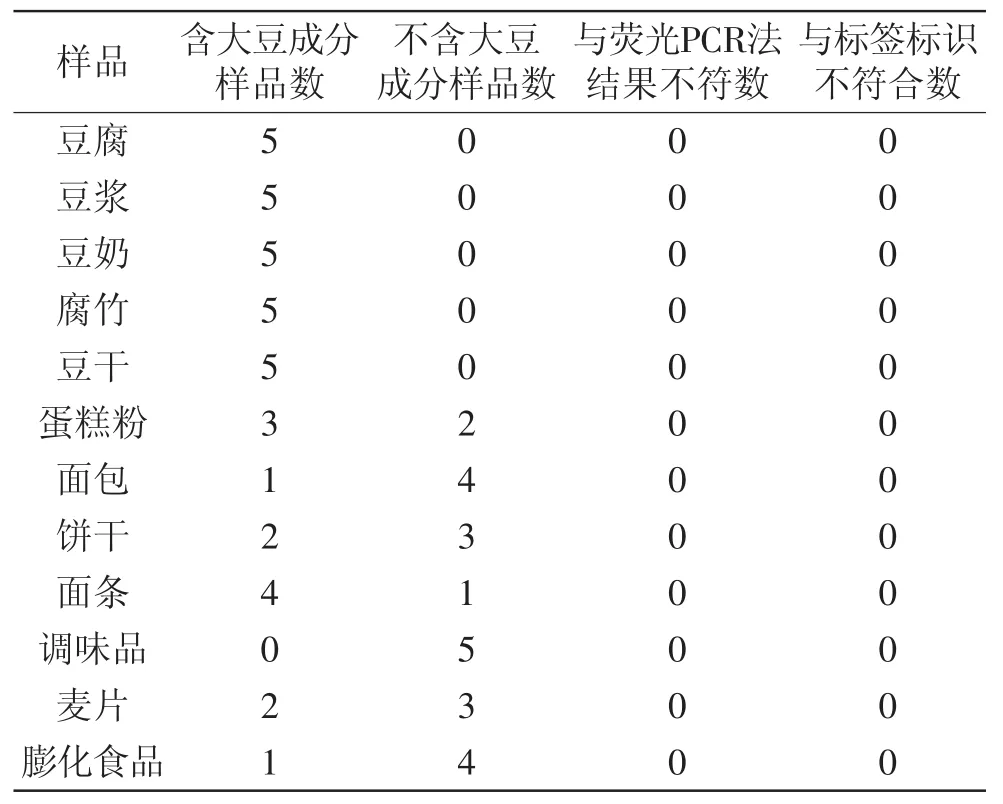
表3 实际样品检测Table 3 Test results of commercial samples
在实际样品检测中,荧光PCR法的Ct值及LAMP实时浊度法的峰值拐点时间与样品中过敏原大豆成分的含量成正比关系。上述样品的检测中,荧光PCR法的Ct值出现在50~70min,而LAMP实时浊度法的峰值拐点则出现在18~30min,LAMP实时浊度法的检测时间明显比荧光PCR法的检测时间短。并且在实际应用中,LAMP法仅需在简单的恒温设备中进行,以肉眼观察反应管中产生的白色沉淀判断结果,操作简便,成本低,更适合基层实验室甚至现场实验。
3 结论
本研究建立了食品中过敏原大豆成分的LAMP实时浊度检测方法,引入环引物的LAMP引物使扩增反应从1h内进一步缩短至30min内。该方法的灵敏度为0.1%(w/w)。对4个不同质量浓度的大豆样品分别进行20次重复实验,假阳性率及假阴性率为0%。对31种成分的测试中仅有大豆成分出现阳性扩增,其他成分均无出现扩增。对60个实际样品的检测结果与荧光PCR法的结果一致,并与预期相符,表明该方法具有良好的稳定性和特异性,适用于食品中过敏原大豆成分的快速检测。
[1]孟伟帅,关荣发,任骏恩,等.食品过敏原检测技术的研究[J]. 广东化工,2010,37(4):167-168.
[2]王文枝,温焕斌,靳淑敏,等.世界各国食品过敏原种类及标识情况概述[J]. 食品工业科技,2011,32(4):419-422.
[3]王蒙,张汆,贾小丽,等.食物中常见过敏原及其过敏特性[J]. 中国食物与营养,2008(11):62-64.
[4]方旭前,朱友林,邱丽娟.大豆过敏原与低过敏原种质创新[J]. 遗传,2006,28(8):1043-1050.
[5]Foucard T,Malmheden-Yman I.A study severe food reactions in Sweden is soy protein an underestimated cause of food anaphylaxis[J].Allergy,1999,53(3):251-265.
[6]POMS R E,KLEIN C L,ANKLAM E.Methods for allergen analysis in food:a review[J].Food Additions and Contaminants,2004,21(1):1-31.
[7]冯彦娟,袁娟丽,佟平,等.大豆过敏原检测方法研究进展[J]. 食品科学,2012,33(23):365-369.
[8]郑义成,华萍,杨安树,等.食物中过敏原检测技术研究进展[J]. 食品科学,2010,31(21):417-421.
[9]LOPEZ-TAPIA J,GARCIA-RISCO M R,MSNSO M A,et al. Detection of the presence of soya protein in milk powder by sodium dodecyl sulfate capillary electrophoresis[J].J Chromatogr A,1999,836(1):153-60.
[10]MA Xi, SUN Peng , HE Pengli, et al.Development of monoclonal antibodies and a competitive ELISA detection method for glycinin,an allergen in soybean[J].Food Chemistry,2010,121:546-551.
[11]PASCHKE A,ZUNKER K,WIGOTZKI M,et al.Determination of the IgE-binding activity of soy lecithin and refined and nonrefined soybean oils[J].Journal of Chromatography B,2001,756:249-254.
[12]IWABUCHI S,YAMAUCHI F.Determination of glycinin and β-conglycinin in soybean proteins by immunological methods [J].JAgric Food Chem,1987,35(2):200-205.
[13]SOARES S,MAFRA I,AMARAL J S,et al.A PCR assay to detect trace amounts of soybean in meat sausages[J].International Journal of Food Science and Technology,2010,45(12):2581-2588.
[14]TIAN Fang,WANG Xiumin,TENG Da,et al.Optimization of a multiplex PCR assay for detecting transgenic soybean components in feed products[J].Appl Biochem Biotechnol,2011,165:1225-1234.
[15]BAUER T,KIRSCHBAUM K,PANTER S,et al.Sensitivedetection of soy(Glycine max) by real-time polymerase chain reaction targeting the mitochondrial atpA gene[J].J AOAC Int,2011,94(6):1863-1873.
[16]WANG Wei,HAN Jianxun,WU Yajun,et al.Simultaneous detection of eight food allergens using optical thin-film biosensor chips[J].J Agric Food Chem,2011,59:6889-6894.
[17]KIM T E ,PARK S W ,CHO N Y ,et al.Quantitative measurement ofserum allergen-specific IgE on protein chip[J]. Exp Mol Med,2002,34(2):152-158.
[18]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research ,2000,28(12):e63.
[19]黄思佳,解庭波,严家新.环介导等温扩增反应的原理及应用[J]. 中国生物制学杂志,2011,24(12):1511-1513.
Development of a real-time turbidimeter-based LAMP method for detection of allergen soybean in food
KUANG Xiao-shan,CHENG Xiao-wei,YOU Shu-zhu,WANG Xiao-yu,LIU Li-deng,FENG Jia-wang*
(The Inspection Technical Center of Zhuhai Entry-Exit Inspection and Quarantine Bureau,Zhuhai 519015,China)
According to the endogenous gene of allergen soybean Lectin , six specific LAMP primers were designed.A loop-mediated isothermal amplification(LAMP) method for detecting allergen soybean in food was established.Real-time monitoring of the LAMP reaction was achieved by a turbidimeter.Specificity ,sensitivity,stability and repeatability of this method were tested.The results showed that the method could specifically detect the soybean in food,and the detection sensitivity of the method was 0.1% (w/w).With the soybean sample of 10%,1%,0.1%,0%(w/w) concentration as templates,stability and repeatability testing was conducted,false negative rate was 0%.The results showed that the LAMP method is suitable for specifically detecting allergen soybean in food.
loop-mediated isothermal amplification(LAMP);real-time turbidimeter;allergen;soybean;detection
Q78
A
1002-0306(2014)22-0065-05
10.13386/j.issn1002-0306.2014.22.005
2014-02-10
邝筱珊(1982-),女,硕士研究生,工程师,研究方向:食品安全检测。
* 通讯作者:冯家望(1965-),男,硕士研究生,研究员,研究方向:食品安全检测。
国家质检总局科技计划项目(2011IK255)。

