温室甜樱桃‘早大果’光合作用与生理生态因子的关系
王顺才,呼丽萍,2,王晨冰
(1 天水师范学院 生命科学与化学学院,甘肃 天水741000;2 甘肃省大樱桃工程技术研究中心,甘肃 天水741000;3 甘肃省农业科学院 林果花卉研究所,甘肃 兰州730070)
樱桃为蔷薇科(Rosaceae)李属(PrunusL.)樱桃亚属(CerasusDuss)落叶果树[1],其果实具有很高的营养价值和保健功能[2-3]。我国当前种植的主要是欧洲甜樱桃(P.aviumL.)和中国樱桃(P.pseudocerasusLindl.)。欧洲甜樱桃在我国也叫甜樱桃或大樱桃,是近年来种植面积发展最快的果树之一。光合作用是甜樱桃生长和产量形成的基础,因此有关樱桃光合生理方面的研究受到了国内外学者越来越多的关注[4-9]。国内的相关研究多集中在露地樱桃光合特征参数的日变化规律方面,而对设施栽培条件下各种生理生态因子对樱桃光合作用的影响及其相互关系的研究鲜有报道。
‘早大果’(Крупноплодная)为山东省果树研究所于1997年从乌克兰引入的甜樱桃品种,2007年通过山东省审定,现为国内许多地区的主栽早熟优良品种之一。本试验以5年生‘早大果’为研究对象,在温室栽培条件下,研究了‘早大果’果实成熟期叶片光合参数的日变化规律、光合作用净光合速率与生理生态因子的关系及净光合速率对光照强度、环境CO2浓度和大气温度的响应特性,以期为发挥甜樱桃光合生产潜力及温室甜樱桃规范化种植提供理论依据。
1 材料与方法
1.1 试验设计
试验在甘肃天水市生产园区进行。日光温室长60 m、跨度7.5 m、顶高4.2 m;棚膜为聚氯乙烯抗老化无滴塑料薄膜,透光率为65%左右,采用草苫覆盖保温。试材为5年生甜樱桃品种‘早大果’,砧木为‘Gisela 6’;株行距1.0 m×2.0 m,行向为南北向;树形纺锤形,树体健壮,开花结果正常。选3株长势一致的植株,在每树冠中层朝南面随机选取新梢的第9-10片功能叶(自下而上)测定相关指标。
1.2 测定指标及方法
1.2.1 相关生理生态因子 试验于2011-04-12和04-13(甜樱桃果实成熟期)连续2个晴天进行。从08:00-18:00每隔1 h测量1次,每叶测定5次,光强、温度和CO2浓度以外界条件为准。用LI-6400便携式光合测定仪(Licor Inc.,Lincoln,USA)测定光合有效辐射(PAR)、叶温(Tl)、气温(Ta)、空气相对湿度(RH)、空气CO2浓度(Ca)等生态因子,以及叶片的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)等生理因子。气孔限制值(Ls)和叶片水分利用效率(WUE,mmol/mol)的计算公式为:Ls=1-Ci/Ca,WUE=Pn/Tr。
1.2.2 光响应曲线(Pn-PAR) 对所选的同一片功能叶进行光响应曲线测定。气室CO2浓度设置为400 μmol/mol,叶温25 ℃,空气相对湿度60%。利用LI-6400-02B人工光源调节光强,设定叶室中PAR分别为1 800,1 500,1 200,1 000,800,600,500,400,300,200,150,100,80,50,20和0 μmol/(m2·s),每个光强下稳定3~5 min后测定,重复3次。光响应曲线的拟合方程使用Farquhar等[10]提出的非直角双曲线模型:
式中:Q为初始量子效率,Pmax为最大净光合速率,K为曲角(0 1.2.3 CO2响应曲线(Pn-Ca) 用LI-6400液化CO2钢瓶提供不同体积分数的CO2,控制参比室中CO2浓度为50,80,100,150,200,400,600,800,1 000,1 200,1 500和1 800 μmol/mol。设定叶温25 ℃、空气相对湿度60%,叶室中PAR为860 μmol/(m2·s)。根据Pn-Ca曲线回归方程求叶片光合作用的CO2补偿点(CO2compensation point,CCP)和CO2饱和点(CO2saturating point,CSP)。 1.2.4 光合-温度响应曲线(Pn-Tl) 光合-温度响应曲线的测定于晴天上午(08:00-11:00)进行。设置PAR为860 μmol/(m2·s),CO2浓度为400 μmol/mol,空气相对湿度60%,按温度梯度分别在15,20,25,30和35 ℃测定Pn。由Pn-Tl曲线回归方程求叶片光合作用的最适温度。 试验数据采用SPSS 16.0软件进行回归相关分析,用SigmaPlot 10.0软件进行图形绘制。 由图1-a可以看出,一天中温室内PAR呈单峰型变化,午前迅速上升,到13:00增幅减缓,14:00达最高峰,峰值为820.0 μmol/(m2·s),随后逐渐下降,至18:00降至189.1 μmol/(m2·s)。 图 1 温室内生态因子(a、b)及甜樱桃叶片光合生理因子(c、d、e)的日变化 温室内Ca日变化呈先降低后升高的变化趋势(图1-a)。早晨08:00Ca值最高(536.8 μmol/mol),之后迅速下降,11:00降至最低(349.4 μmol/mol),随后缓慢回升,至18:00升至391.5 μmol/mol,但仍远低于早晨的水平。 强烈的光照是引起气温、空气相对湿度等环境条件变化的根本原因。如图1-b所示,温室内RH在08:00-10:00随着气温的升高而略有升高,10:00由于通风换气,RH开始迅速下降,到14:00降至最低值(21.7%),以后随着光照和气温的下降又逐渐上升,至18:00升至30.0%。 温室内Ta的日变化与PAR的变化趋势一致,为单峰型曲线(图1-b)。早晨Ta缓慢升高,最高温(38.5 ℃)在14:00出现,然后随着PAR的下降而逐渐下降,至18:00降至30.7 ℃。从全天来看,Ta在24.9~38.5 ℃变化,其中午后13:00-16:00Ta较高,保持在35.4~38.5 ℃。 温室甜樱桃果实成熟期叶片Pn的日变化呈微弱的双峰曲线(图1-c)。随着PAR的逐渐增强,Pn快速增加,于10:00出现了较高的光合值(15.79 μmol/(m2·s));随后Pn继续缓慢上升,至11:00达最高峰值(18.16 μmol/(m2·s));此后Pn迅速下降,于15:00出现低谷值(6.45 μmol/(m2·s));16:00-17:00Pn略有回升,又出现微弱的峰值(7.07 μmol/(m2·s)),之后迅速下降。从Pn日进程曲线看,甜樱桃叶片存在光合“午休”现象,但不明显。 从图1-c可以看出,‘早大果’叶片Tr的日变化也呈双峰曲线。早晨逐渐增加,11:00达到第1个峰值(5.9 mmol/(m2·s));随后降低,12:00-13:00为低谷;以后迅速增加,15:00出现第2个峰值(5.8 mmol/(m2·s))。14:00-16:00是一天中光强和气温最高的时段,此时叶片保持较高的Tr值,可防止叶温进一步提高,从而有效保护叶片的光合机构,这是‘早大果’樱桃树对环境的一种适应机制。 从图1-d可以看出,‘早大果’叶片Gs的日变化呈双峰曲线。10:00出现第1个高峰(0.30 mol/(m2·s)),随后开始下降,至12:00-15:00出现一个低谷波动期,随后逐渐回升,17:00出现第2个次高峰(0.18 mol/(m2·s))。 气孔限制值(Ls)反映气孔对光合作用的影响程度。由图1-d可知,‘早大果’叶片Ls日变化呈先升后降的变化趋势。Ls的日变幅在0.12~0.60。上午Ls持续增加,12:00达到最大值,随后逐渐下降。这表明午间叶片气孔的限制效应较明显。 ‘早大果’叶片Ci日变化与Ca日变化趋势相似,都呈现先降后升的中午较低型变化趋势(图1-e)。08:00Ci值最大,随后逐渐降低,到12:00最低,然后逐渐增加。Ci一天中的变化幅度为142.7~478.9 μmol/(m2·s),而Ca日变化的幅度在349.4~536.8 μmol/mol。 由图1-e可知,‘早大果’叶片WUE的日变化规律呈双峰曲线,与Gs的日变化趋势相似。WUE的日间变化幅度为1.2~3.8 mmol/mol。08:00-10:00 逐渐上升,随后缓慢下降,在14:00-16:00达到低谷,此后开始回升,在17:00出现第2个小高峰,其后迅速下降。 以RH、PAR、Ta、Tl和Ca5种生态因子及Gs、Tr、WUE、Ci4种生理因子为自变量,以Pn为因变量进行相关分析,结果见表1。 表 1 温室甜樱桃叶片净光合速率(Pn)与生理生态因子的相关系数 由表1可知,5种生态因子与Pn的简单相关系数大小依次为RH>PAR>Ta>Tl>Ca,其中Pn与PAR和RH呈正相关,与Ca、Ta及Tl呈负相关。这说明PAR和RH是Pn的主要生态贡献因子,Ca、Ta和Tl则是限制因子。同理,Pn与4种生理因子的相关系数大小依次为Gs>Tr>WUE>Ci,其中,Pn与Gs、Tr和WUE呈正相关,与Ci呈负相关。这说明Gs、Tr和WUE是Pn的主要生理贡献因子,Ci则是限制因子。这表明温室栽培甜樱桃品种‘早大果’叶片的Pn受内部生理因子和外部环境因子的共同影响,但它们的影响作用及大小有所不同。显著性检验结果表明,Pn与Gs呈极显著正相关(r=0.771,P<0.01),与其他各光合参数间无显著相关性。 为进一步探寻生理生态因子对Pn的影响程度,应用多元线性回归分析方法,以生态因子PAR、RH、Ta、Ca、Tl为自变量,与因变量Pn进行多元回归分析,选取对Pn影响较大的生态因子(RH、PAR),建立Pn的最优化多元线性回归方程:Pn=35.050+0.009PAR+0.303RH-0.077Ca(复相关系数R=0.977,F=20.757,显著水平P=0.002)。显著性检验结果表明,Pn与PAR(P=0.044)、RH(P=0.003)和Ca(P=0.002)之间存在显著性相关(P<0.05),表明影响Pn日进程的主要生态因子是PAR、RH和Ca。同理,以生理因子Tr、Gs、Ci、WUE与Pn进行多元回归分析,建立Pn与生理因子的最优线性回归方程:Pn=-2.543+52.412Gs(R=0.943,F=11.946,P=0.005)。显著性检验结果显示,Pn与Gs(P=0.002)间存在显著性相关(P<0.05),表明影响Pn日进程的主要生理因子是Gs。 综上分析可知,Gs是影响净光合速率的主要生理因子,PAR和RH是影响净光合速率的主要生态促进因子,Ca则为主要生态抑制因子。 回归分析结果(图2)表明,温室栽培条件下,樱桃品种‘早大果’叶片Pn与其生理因子Tr、Gs和WUE间存在二次曲线关系,而与Ci呈极显著线性负相关关系(P<0.01)。 图 2 温室甜樱桃叶片Pn-Tr(a)、Pn-Gs(b)、Pn-Ci(c)和Pn-WUE(d)的响应曲线 Farquhar模型拟合结果显示,Pn与PAR间存在极显著的二次响应曲线关系,模拟方程为:Pn={0.069PAR+24.537-[(0.069PAR+24.537)2-3.691PAR]1/2}÷1.09-1.456,(R2=1,P<0.01)(图3-a)。根据Pn-PAR二次曲线公式可以算出,‘早大果’叶片LCP约为7.0 μmol/(m2·s),LSP约为960.6 μmol/(m2·s)。LCP较低,表明温室栽培条件下,‘早大果’叶片利用弱光进行光合作用的能力较强,有利于植株的生长和光合物质的积累;LSP较高,表明‘早大果’利用光照的能力较强,在生产栽培中应选择光照充足的地方建园。 图 3 温室甜樱桃叶片Pn与PAR、Ca及Tl的响应曲线 非线性回归分析结果表明,Pn与Ca之间存在二次曲线关系,方程式为:Pn=-1.595 8×10-5Ca2+0.048 9Ca-2.174 8(R2=0.997 8)(图3-b)。根据此公式计算得知,CCP约为52.7 μmol/mol,CSP约为1 225.2 μmol/mol。表明温室栽培条件下,‘早大果’叶片有较低的CCP和较高的CSP,说明其对低CO2浓度和高CO2浓度的适应能力都较强,对CO2的利用能力较高。 光合作用是一个复杂的生理过程,叶片Pn的变化是植物本身遗传及叶龄等内在因素和光照、CO2浓度、温度、湿度等外在环境生态因子综合作用的结果。大多数研究报道称,在自然条件下,甜樱桃光合日变化呈典型的中午降低型双峰曲线,中午有光合“午休”现象发生[8,12]。温室条件下,甜樱桃光合日变化有单峰和双峰曲线2种[13]。本试验发现,温室甜樱桃叶片Pn日变化双峰曲线较为平缓,光合“午休”现象不明显。一般认为,发生光合“午休”的原因包括气孔限制和非气孔限制因素,即气孔的部分关闭和叶肉细胞光合活性下降2种情况[14-15]。判断气孔限制是否是光合速率下降的主要原因,可由Ci和Ls变化的方向判断[15]。 在本试验中,上午11:00之前温室甜樱桃Pn随PAR的升高而升高,11:00时Pn达到峰值,而此时的PAR值(626.8 μmol/(m2·s))未达最大(820.0 μmol/(m2·s)),说明此时PAR不是Pn的限制因子。中午12:00时光强和气温逐渐增高,空气湿度降低,Gs下降,Ci和Ca降低,Ls值升高,CO2供应成为光合作用的限制因子,致使Pn下降。显然,气孔限制因素是形成甜樱桃‘早大果’光合“午休”的主要原因。午后13:00-15:00,PAR达到一天中最大,Tl逐渐升高,RH值处于一天中的最低时期,Ci逐渐升高,Gs和Ls值降低,Pn也下降;14:00-15:00Tr较高,与Gs变化不一致,这是因为此时PAR最强,Ta较高而RH较低,导致饱和水汽压差较大,从而促进了叶片蒸腾作用并带走叶片过剩热量,避免高温灼伤叶片。这表明午后Pn的下降主要是由非气孔限制因素造成的,也说明叶片气孔并未完全关闭。 王志强等[16]研究发现,温室内油桃光合作用日变化规律与露地明显不同,温室内主要生态因子(PAR、RH、Ta)对油桃光合作用起着协同效应,增施CO2对油桃Pn的促进效应显著(P<0.05)。王金政等[17]对杏研究后发现,在设施环境条件下,低光照、低CO2浓度和高湿度是影响作物生长发育的主要因素。本试验通过相关性分析也发现,温室甜樱桃Pn受生理生态因子的共同影响,其中,生态因子PAR、RH和Ca对Pn的影响较大(P>0.05),生理因子Gs对Pn的影响显著(P<0.05)。Gs存在明显的“午休”现象,主要由气孔部分关闭引起,而中午气孔的部分关闭与RH和叶水势有关,对气孔的影响主要体现为Tr对气孔的反馈调节作用,说明Gs是影响温室甜樱桃光合“午休”的主导因子。环境因子(PAR、Ca、Ta和Tl)与甜樱桃叶片Tr有显著或极显著的相关性,但对Pn的影响不显著。说明蒸腾作用过程及其影响因素与光合作用不同。 生态因子不仅直接影响植物的光合作用,而且还通过影响植物的生理因子间接影响植物的光合作用。其中,光照和环境CO2浓度是影响植物生长发育及功能的2个关键因子。国内外学者常利用光合作用对光照和CO2浓度的响应模型来研究植物的光合生理特性[10,18-19]。本研究表明,甜樱桃‘早大果’叶片的LCP和LSP分别为7.0和960.6 μmol/(m2·s),比露地甜樱桃品种的LCP和LSP都要低[8,20],这可能与甜樱桃品种基因型的差异及其对温室内生态环境产生的适应性有关。国内大量研究表明,设施栽培条件下,矮樱桃[7](P.pseudocerasus)、油桃[16]和杏[21]等果树光合作用对光的适应范围缩小,叶片的LCP和LSP都降低,叶片对弱光的利用率提高,对强光的利用率降低。另有研究报道,由Farquhar模型估算出的LSP远小于实测值[18]。吴兰坤等[22]通过遮阳处理研究了不同光强对露地甜樱桃的影响,结果发现,1 100~1 500 μmol/(m2·s)以下弱光显著降低了甜樱桃的坐果率及果实品质,甜樱桃果实生长前期对弱光较敏感,后期弱光对其影响不大。另据报道,甜樱桃树体的叶果比对枝梢的营养生长及果实品质的影响达显著水平,而对叶片CO2交换速率的影响不显著[23]。从整个生长物候期来看,设施栽培条件下甜樱桃的物候期提前,植株根系活动提早,生长期加长,枝条生长量增大。因此,要提高温室甜樱桃的光合效能,应选择LCP和LSP较低的品种,合理整形修剪,防止树体“旺长”,在果实生长期尽量避免弱光的影响。 本研究中,温室条件下‘早大果’光合作用对CO2浓度的响应曲线可以用一元二次方程来定量描述,这与前人对露地甜樱桃[8]和温室油桃[24]的研究结果一致。大量研究表明,短期内升高CO2浓度,可以增加CO2对Rubisco酶结合位点的竞争能力,从而提高羧化速度,同时通过抑制光呼吸提高Pn,短期内CO2浓度增加与保卫细胞信号转导途径有关[25];而长期处于高CO2浓度下,植物Pn反而低于正常水平[26-27]。也有研究报道,冬小麦叶片对CO2浓度增高的适应不是气孔关闭的结果,而主要是Rubisco酶活性及其含量降低所致[28]。最近有研究报道,在高CO2浓度下,光合作用中CO2的同化作用受到RuBP再生速率的限制,而RuBP的再生能力由叶绿体电子传递链生成NADPH、ATP的能力与卡尔文循环中RuBP再生的酶类决定[29]。Kirschbaum[30]也指出,在5~35 ℃内,升高CO2浓度可以明显提高植物的Rubisco酶活性及RuBP含量,光合作用对CO2浓度升高的响应机理与Rubisco酶活性和RuBP再生速率被限制有关。 叶片是植物进行光合作用的主要器官,叶温对植物的光合能力具有重要的影响[31]。叶片的光合能力取决于光合生化反应和叶片的结构。叶温不仅影响光合系统中一些酶的活性,而且还决定气孔下腔的饱和水汽压,从而影响蒸腾及气孔导度[32]。据报道,在自然环境下,植物光合作用的最适叶温与适宜生长的白天平均温度相一致[33]。前人研究认为,大部分落叶果树的光合作用最适温度在20~30 ℃,大田甜樱桃‘红玛瑙’光合作用的最适温度为27.75 ℃[20],温室油桃的最适气温是25 ℃[24],这与本试验中温室甜樱桃的最适气温一致。C3植物光合速率的最适温度可能由RuBP羧化作用或RuBP再生作用的最适温度决定,或者由两者共同限制决定[34]。光合作用最适温度因物种不同而存在差异,这可能与它们长期适应自身的生长环境有关,高温下导致Pn降低的主要因子目前仍不清楚。 本试验结果表明,在一定范围内,Pn与Gs、Tr和WUE间存在二次曲线关系,与Ci存在极显著直线负相关关系,这与前人对温室油桃[24]的研究结果一致。从相关性分析结果可以看出,甜樱桃叶片Pn与Gs呈极显著正相关,这表明Pn受Gs的影响较大。从本质上看,Pn与Gs之间存在因果关系。目前,人们尚不清楚Gs是否为限制Pn的主导因素,最近有研究报道,在正常供水条件下,Gs是影响水稻叶片Pn的决定因素[35]。作为水分和CO2进出的门户,气孔行为是影响叶片光合作用的关键因子,但气孔行为的生理机制仍不清楚[36]。本试验对甜樱桃Pn与Gs、Tr及Ci间的关系进行了初步研究和分析,并未涉及其他各光合参数间的相互关系,这对深入探讨光合生理机制具有重要意义,有待于进一步研究。 综上所述,甜樱桃果实成熟期RH太大会降低透光率,不利于果实着色且易引起裂果,RH过低也会影响光合作用。晴天光照强烈,温室内气温上升较快,光合作用的温度较高,因而会消耗大量光合产物;晚间气温过低会影响果实大小。因此,温室栽培过程中,在甜樱桃果实成熟期应保证水分供应均衡,保持适宜的空气湿度,防止昼夜温差过大,适当补光以减少弱光的影响,从而提高光合速率,增加有机物积累;中午时分应采取降温和通风换气措施,尽量减轻光合“午休”发生程度,以提高叶片的光合利用效率。 [参考文献] [1] 李 明,黄贞光,韩礼星,等.樱桃亚属果树再生系统研究进展 [J].生物技术通报,2002(4):21-25. Li M,Huang Z G,Han L X,et al.Advances of research on regenerationinvitroinCerasusDuss [J].Biotechnology Information,2002(4):21-25.(in Chinese) [2] McCune L M,Kubota C,Stendell-Hollis N R,et al.Cherries and health:A review [J].Critical Reviews in Food Science and Nutrition,2010,51:1-12. [3] Kelley D S,Adkins Y,Reddy A,et al.Sweet bing cherries lower circulating concentrations of markers for chronic inflammatory diseases in healthy humans [J].The Journal of Nutrition,2013,143(3):340-344. [4] Whiting M D,Lang G A.Canopy architecture and cuvette flow patterns influence whole-canopy net CO2exchange and temperature in sweet cherry [J].HortScience,2001,36:691-698. [5] Beppu K,Suehara T,Kataoka I.High temperature and drought stress suppress the photosynthesis and carbohydrate accumulation in ‘Satohnishiki’ sweet cherry [J].Acta Horticulturae,2002,618:371-377. [6] Gruber B R,Kruger E L,McManus P S.Effects of cherry leaf spot on photosynthesis in tart cherry ‘Montmorency’ foliage [J].Phytopathology,2012,102(7):656-661. [7] 黄卫东,吴兰坤,战吉成.中国矮樱桃叶片生长和光合作用对弱光环境的适应性调节 [J].中国农业科学,2004,37(12):1981-1985. Huang W D,Wu L K,Zhan J C.Growth and photosynthesis adaptation of dwarf-type chinese cherry (PrunuspseudocerasusL.cv.Laiyang) leaves to weak light stress [J].Scientia Agricultura Sinica,2004,37(12):1981-1985.(in Chinese) [8] 杨江山,常永义,种培芳.3个樱桃品种光合特性比较研究 [J].园艺学报,2005,32(5):773-777. Yang J S,Chang Y Y,Chong P F.Comparative studies on photosynthetic characteristics of three sweet cherry cultivars [J].Acta Horticulturae Sinica,2005,32(5):773-777.(in Chinese) [9] 孟艳玲,魏海蓉,刘庆忠,等.盐处理下2种砧木对甜樱桃‘萨米脱’光合影响的比较 [J].中国农学通报,2011,27(19):199-204. Meng Y L,Wei H R,Liu Q Z,et al.Comparison on the effects of rootstocks on photosynthesis and chlorophyll fluorescence parameters of sweet cherry ‘Summit’ under salt stress [J].Chinese Agricultural Science Bulletin,2011,27(19):199-204.(in Chinese) [10] Farquhar G D,Caemmerer S,Berry J A.A biochemical model of photosynthetic CO2assimilation in leaves of C3species [J].Planta,1980,149:78-90. [11] Yamori W,Hikosaka K,Way D A.Temperature response of photosynthesis in C3,C4,and CAM plants:Temperature acclimation and temperature adaptation [J].Photosynthesis Research,2013:1-17.DOI:10.1007/s11120-013-9874-6. [12] 付 莹,卜现勇,张明清,等.不同砧木对‘红灯’甜樱桃光合速率日变化的影响 [J].山东农业大学学报:自然科学版,2009,40(1):17-20. Fu Y,Bu X Y,Zhang M Q,et al.Effects of different rootstocks on the diumal variation of the photosyntheticrate of ‘Hong Deng’ sweet cherry [J].Journal of Shandong Agricultural University:Natural Science Edition,2009,40(1):17-20.(in Chinese) [13] 孔 云,沈红香,程继鸿,等.温室塑料覆盖物的不同处理对樱桃叶片光合特性的影响 [J].北方园艺,2005(5):69-70. Kong Y,Shen H X,Cheng J H,et al.Effects of different cover treatments with plastic mulches on photosynthetic characters of cherry leaves in greenhouse [J].Northern Horticulture,2005(5):69-70.(in Chinese) [14] Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis [J].Annual Review of Plant Physiology,1982,33:317-345. [15] 许大全.光合作用气孔限制分析中的一些问题 [J].植物生理学通讯,1997,33(4):241-244. Xu D Q.Some problems in stomatal limitation analysis of photosynthesis [J].Plant Physiology Communications,1997,33(4):241-244.(in Chinese) [16] 王志强,何 方,牛 良,等.设施栽培油桃光合特性研究 [J].园艺学报,2000,27(4):245-250. Wang Z Q,He F,Niu L,et al.A comparative research on photosynthesis ofNectarinegrown inside and outside greenhouses [J].Acta Horticulturae Sinica,2000,27(4):245-250.(in Chinese) [17] 王金政,张安宁,单守明.3个设施或露地栽培常用杏品种光合特性的研究 [J].园艺学报,2005,32(6):980-984. Wang J Z,Zhang A N,Shan S M.Studies on photosynthetic characters of three apricot cultivars suitable for plastic greenhouse [J].Acta Horticulturae Sinica,2005,32(6):980-984.(in Chinese) [18] 叶子飘,于 强.光合作用光响应模型的比较 [J].植物生态学报,2008,32(6):1356-1361. Ye Z P,Yu Q.Comparison of new and several classical models of photosynthesis in response to irradiance [J].Journal of Plant Ecology,2008,32(6):1356-1361.(in Chinese) [19] Caemmerer S.Steady-state models of photosynthesis [J].Pla-nt,Cell & Environment,2013,DOI:10.1111/pce.12098. [20] 杨晓华,戴桂林,聂国伟,等.甜樱桃“红玛瑙”的光合特性研究 [J].山西农业大学学报:自然科学版,2009,29(5):423-426. Yang X H,Dai G L,Nie G W,et al.Studies on photosynthetic characteristics of sweet cherry ‘Hongmanao’ [J].Journal of Shanxi Agricultural University:Natural Science Edition,2009,29(5):423-426.(in Chinese) [21] 王 鸿,王发林,牛军强,等.日光温室内外金太阳杏光合特性的比较研究 [J].果树学报,2005,22(5):479-482. Wang H,Wang F L,Niu J Q,et al.Comparative study on photosynthesis of apricot cultivar Sungold grown in greenhouse and open field [J].Journal of Fruit Science,2005,22(5):479-482.(in Chinese) [22] 吴兰坤,黄卫东,战吉成.弱光对大樱桃坐果及果实品质的影响 [J].中国农业大学学报,2002,7(3):69-74. Wu L K,Huang W D,Zhan J C.Effects of low light intensity on sweet cherry fruit setting and quality [J].Journal of China Agricultural University,2002,7(3):69-74.(in Chinese) [23] Whiting M D,Lang G A.‘Bing’ sweet cherry on the dwarfing rootstock ‘Gisela 5’:Thinning affects fruit quality and vegetative growth but not net CO2exchange [J].Journal of the American Society for Horticultural Science,2004,129:407-415. [24] 王晨冰,李宽莹,陈佰鸿,等.温室油桃光合作用与生理生态因子的关系 [J].西北植物学报,2010,30(7):1435-1440. Wang C B,Li K Y,Chen B H,et al.Relationship between photosynthesis and physio-ecological factors of nectarine in greenhouse [J].Acta Botanica Boreali-Occidentalia Sinica,2010,30(7):1435-1440.(in Chinese) [25] Ainsworth E A,Rogers A.The response of photosynthesis and stomatal conductance to rising CO2:Mechanisms and environmental interactions [J].Plant,Cell & Environment,2007,30:258-270. [26] Centritto M,Magnani F,Lee H S J,et al.Interactive effects of elevated CO2and drought on cherry(Prunusavium) seedlings:Ⅱ.Photosynthetic capacity and water relations [J].New Phytologist,1999,141:141-153. [27] 张道允,许大全.植物光合作用对CO2浓度增高的适应机制 [J].植物生理与分子生物学学报,2007,33(6):463-470. Zhang D Y,Xu D Q.The mechanisms of plant photosynthetic acclimation to elevated CO2concentration [J].Journal of Plant Physiology and Molecular Biology,2007,33(6):463-470.(in Chinese) [28] 廖 轶,陈根云,张道允,等.冬小麦光合作用对开放式空气CO2浓度增高(FACE)的非气孔适应 [J].植物生理与分子生物学学报,2003,29(6):494-500. Liao Y,Chen G Y,Zhang D Y,et al.Non-stomatal acclimation of leaf photosynthesis to free-air CO2enrichment (FACE) in winter wheat [J].Journal of Plant Physiology and Molecular Biology,2003,29(6):494-500.(in Chinese) [29] Yamori W,Takahashi S,Makino A,et al.The roles of ATP synthase and the cytochromeb6/fcomplexes in limiting chloroplast electron transport and determining photosynthetic capacity [J].Plant Physiology,2011,155:956-962. [30] Kirschbaum M U F.Does enhanced photosynthesis enhance growth? lessons learned from CO2enrichment studies [J].Plant Physiology,2011,155:117-124. [31] Nagai T,Makino A.Differences between rice and wheat in temperature responses of photosynthesis and plant growth [J].Plant and Cell Physiology,2009,50:744-755. [32] 于 强,任保华,王天铎,等.C3植物光合作用日变化的模拟 [J].大气科学,1998,22(6):867-880. Yu Q,Ren B H,Wang T D,et al.A simulation of diuranal variations of photosynthesis of C3plant leaves [J].Scientia Atmospherica Sinica,1998,22(6):867-880.(in Chinese) [33] Carmo-Silva A E,Salvucci M E.The temperature response of CO2assimilation,photochemical activities and Rubisco activation inCamelinasativa,a potential bioenergy crop with limited capacity for acclimation to heat stress [J].Planta,2012,236(5):1433-1445. [34] Yamori W,Noguchi K,Hikosaka K,et al.Phenotypic plasticity in photosynthetic temperature acclimation among crop species with different cold tolerances [J].Plant Physiology,2010,152:388-399. [35] Kusumi K,Hirotsuka S,Kumamaru T,et al.Increased leaf ph-otosynthesis caused by elevated stomatal conductance in a rice mutant deficient in SLAC1,a guard cell anion channel protein [J].Journal of Experimental Botany,2012,63(15):5635-5644. [36] Lawson T,von Caemmerer S,Baroli I.Photosynthesis and stomatal behaviour [M].Berlin/Heidelberg:Springer,2011:265-304.1.3 数据分析
2 结果与分析
2.1 温室内相关生态因子的日变化
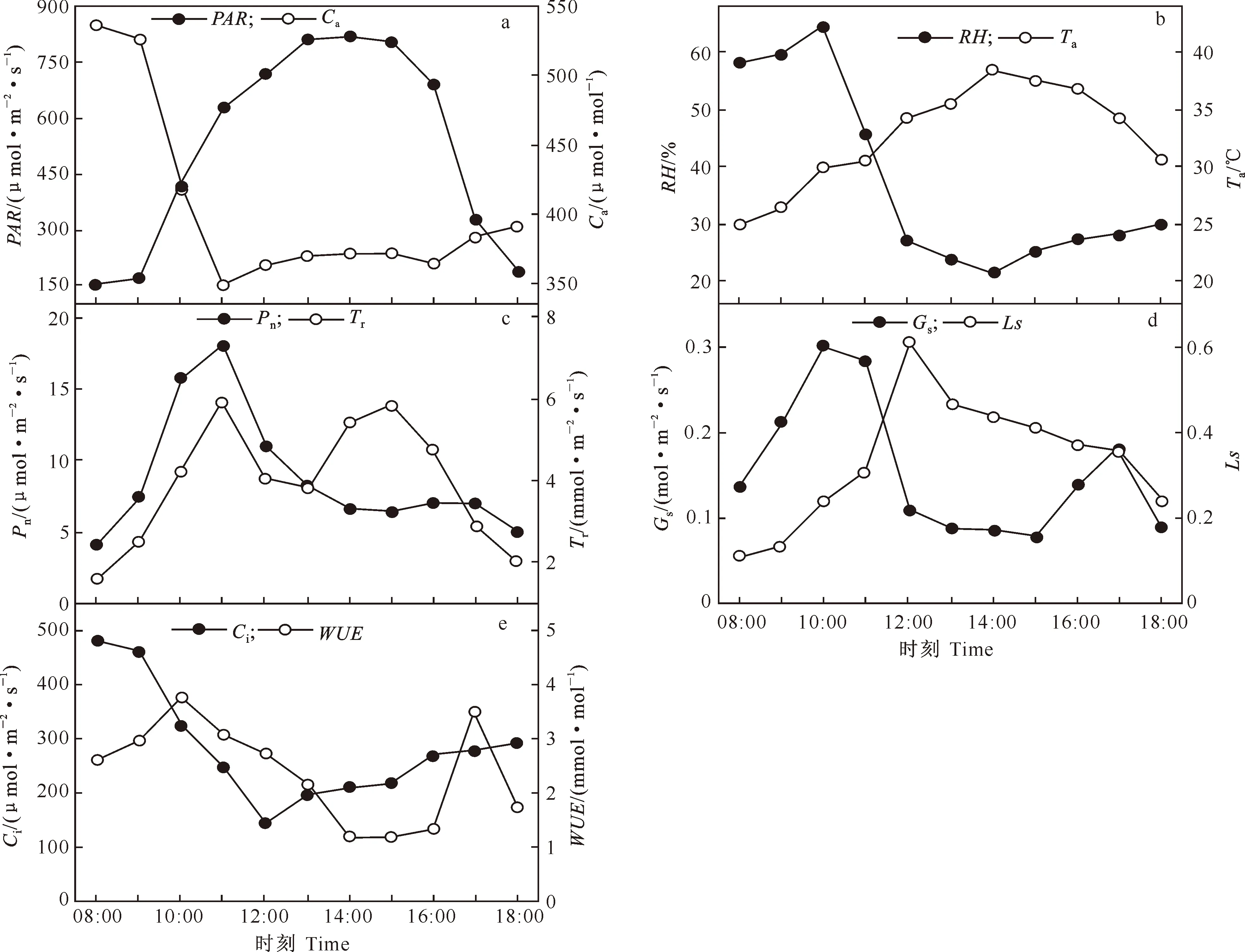
2.2 温室甜樱桃光合作用与相关生理因子的日变化
2.3 温室甜樱桃Pn与生理生态因子的相关分析
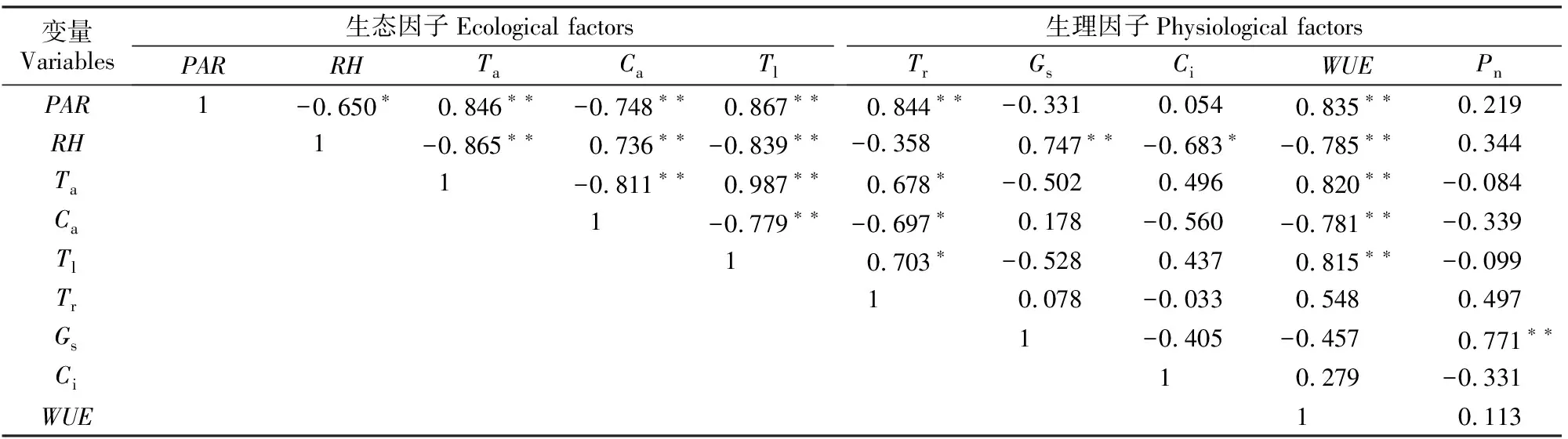
2.4 温室甜樱桃Pn与生理生态因子的关系

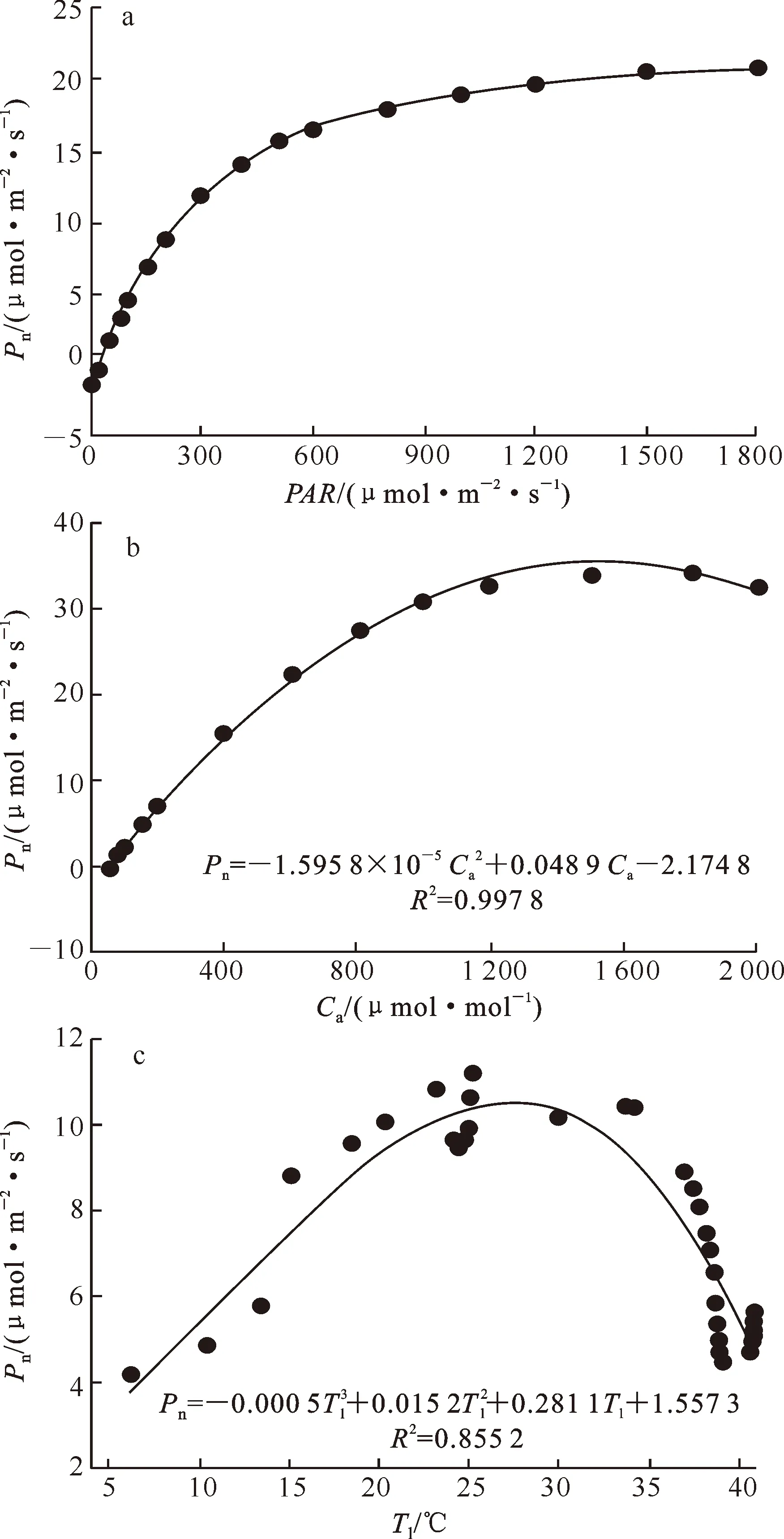

3 讨 论
3.1 温室甜樱桃Pn的日变化规律
3.2 温室甜樱桃Pn与生态因子的相关性
3.3 温室甜樱桃Pn与生理因子的相关性

