强化抽出处理液中表面活性剂和污染物的溶剂萃取分离
李璐璐,赵勇胜,王贺飞,苏燕,秦传玉
(吉林大学 地下水资源与环境教育部重点实验室,吉林 长春,130021)
随着我国经济和社会的迅猛发展,地下水有机污染日趋严重[1-2],高效修复治理技术的应用迫在眉睫[3-4]。在众多修复技术中,抽出处理技术应用较为广泛[5],但其在处理后期易出现“拖尾效应”[6],且在停止抽水后,反弹现象明显,表面活性剂强化修复技术因能克服上述缺陷得以逐渐发展和成熟[1,5,7-9]。然而,从地下抽出的强化修复处理液中含有大量的有机污染物和表面活性剂,如果不将二者有效分离,不仅会增加修复成本[10],而且不利于后续污水处理[11]:因此,将地下水强化抽出处理液中有机污染物和表面活性剂进行有效分离,并对表面活性剂进行回收利用非常必要[12]。分离有机污染物和表面活性剂的常用方法有气提法、渗透蒸发法、吸附法、泡沫分离法、反胶束萃取法和溶剂萃取法[13]。溶剂萃取法适用于包括易挥发和难挥发的各类有机污染物和表面活性剂的分离,技术成熟,方法稳定,且效果较好。Hasegawa 等[14]研究了溶剂萃取技术分离有机污染物和表面活性剂的可行性,结果表明该技术能将二者有效分离。Cheng 等[9]采用溶剂萃取法,选取不同等效烷烃碳数(EACN)的污染物和萃取剂进行实验,结果表明:为提高污染物的去除率,萃取剂的EACN 必需高于污染物的EACN,但由于其他限制条件(如黏度等),萃取剂的EACN 也不是越高越好。此外,其根据表面活性剂浓度、溶液含盐量等因素的影响,对污染物的分离去除进行拟合;Lee[15-16]采用逆流溶剂萃取法对表面活性剂Dowfax 8390 和甲苯、1,2,4-三氯苯的分离进行研究,结果表明:萃取剂类型、污染物种类、萃取剂流速以及萃取时间等因素均对污染物的去除率有明显影响,且污染物去除率达到98%所需要的时间为5 h;朱瑞佳等[10,17]研究溶剂萃取法去除模拟土壤淋洗液中的污染物DNAPLs 的可行性,分别探讨表面活性剂浓度、溶剂/水比例和无机盐等因素对萃取效果的影响,结果证实正己烷能够有效地分离氯苯和表面活性剂。上述研究对溶剂萃取效果的评价主要集中在萃取剂对污染物的萃取效果上,而关于表面活性剂在萃取剂中的损失及萃取剂在表面活性剂中的损失情况鲜见报道,亟待对此进行深入探讨。本实验以Tween 80 为表面活性剂,苯和硝基苯为目标污染物,正己烷、正癸烷和正十六烷为萃取剂,研究Tween 80 质量浓度、污染物和萃取剂性质对萃取效果的影响规律和机理,分别从污染物的分离去除率、表面活性剂在萃取剂中的损失率以及萃取剂在水相中的损失率等3 个方面来考虑污染物、表面活性剂和萃取剂的分离效果,以期为该技术的实际应用提供支持。
1 实验材料和方法
1.1 实验材料
实验中所用污染物、表面活性剂和萃取剂的性质[18]分别如表1~3 所示。
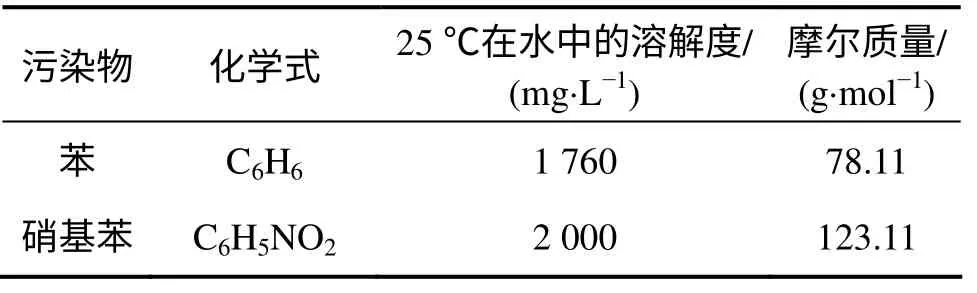
表1 污染物的基本性质[18]Table 1 Basic properties of pollutants
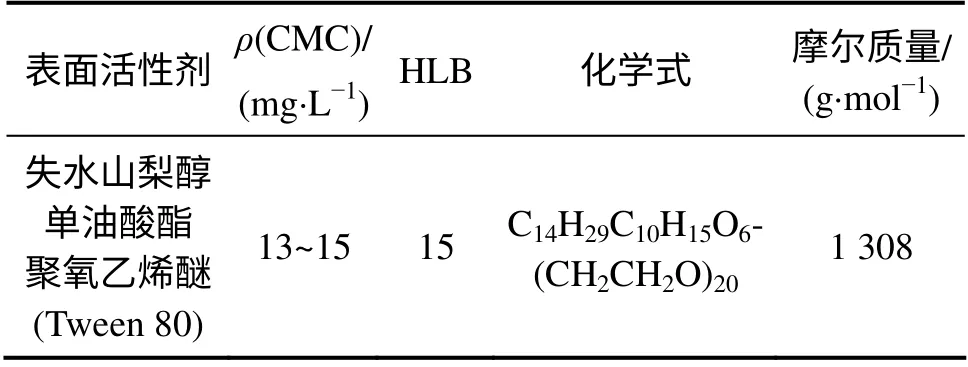
表2 表面活性剂的性质Table 2 Properties of surfactants
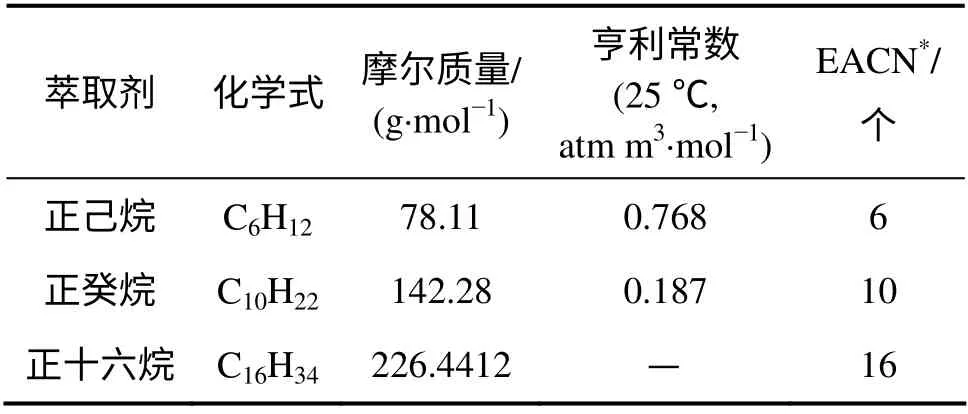
表3 萃取剂的性质[18]Table 3 Properties of solvents
1.2 实验方案
1.2.1 模拟强化修复处理液的制备
分别配置一定质量浓度梯度的Tween 80 溶液,滴加稍过量的苯,封口,放入25 ℃恒温振荡器中,振荡24 h,制备表面活性剂增溶污染物的混合液,备用。
1.2.2 Tween 80 质量浓度对分离效果影响实验
取50 mL 增溶混合液于100 mL 玻璃瓶内,加入5 mL 正己烷,封口,在温度为25 ℃、转速为120 r/min下振荡2 h,通过测试苯的去除率和Tween 80 在萃取剂中的损失率,得到Tween 80 质量浓度对分离效果的影响。
1.2.3 污染物性质对分离效果影响实验
分别考虑污染物种类和浓度对萃取分离效果的影响。固定Tween 80 的质量浓度,分别配置一定浓度梯度的苯和硝基苯溶液,实验过程同上,通过测试苯的去除率、Tween 80 在萃取剂中的损失率和正己烷在表面活性剂溶液中的损失率,得到污染物性质对分离效果的影响。
1.2.4 萃取剂EACN 对分离效果影响实验
考虑萃取剂EACN 对萃取分离效果的影响。固定Tweern 80 和苯的质量浓度,分别以正己烷、正癸烷和正十六烷为萃取剂,它们的EACN 分别为6,10 和16。实验过程同上,通过测试苯的去除率和Tween 80 在萃取剂中的损失率得到萃取剂EACN对分离效果的影响。
以上每组实验均设1 组空白,以消除污染物挥发等因素对测量结果的干扰。
1.3 测试方法
1.3.1 污染物的测试方法
本实验对下清液中苯和硝基苯的浓度进行检测。水样检测为从下清液取0.2 mL 样品,苯、硝基苯分别用20 mL CS2和CHCl3萃取,萃取时间为3 min,静置5 min,且静置后萃取相和萃余相之间并没有发生乳化,因此,萃取样品直接进入气相色谱仪分析。气相色谱仪为FID 检测器,HP-1 型毛细柱,柱长30 m,内径0.32 mm,膜厚0.32 µm。测试苯的色谱条件如下:气化室温度为200 ℃,柱初始温度为40 ℃,程序升温至50 ℃,升温速率为10 ℃/min,检测器温度为230 ℃,空气流量为400 mL/min,氢气流量为43 mL/min,载气(N2)流量为3 mL/min,分流比为5:1。测试硝基苯的色谱条件除气化室温度220 ℃,柱初始温度60 ℃,程序升温至105 ℃,升温速率为5 ℃/min,除检测器温度为220 ℃外,其余条件均与苯的测试条件相同。
1.3.2 表面活性剂的测试方法
Tween 80 测定方法参照文献[19]。
1.3.3 正己烷的测试方法
本实验对下清液中的正己烷浓度进行检测。水样检测为从下清液取0.01 mL 样品,加水稀释至40 mL顶空瓶内。为防止水样在测试过程中起泡而引起仪器不能正常使用,向每个样品中加入0.1 mL 异辛醇作为消泡剂,该样品进入安捷伦7890 气相色谱串级质谱仪分析。测试正己烷的色谱条件如下:初始温度为45 ℃,停留3 min;以20 ℃/min 的速度上升到180 ℃,停留3 min;以30 ℃/min 的速度上升到260 ℃,停留5 min。
2 实验结果与讨论
2.1 Tween 80 质量浓度对萃取效果的影响
图1 所示为Tween 80 质量浓度对萃取效果的影响关系曲线。
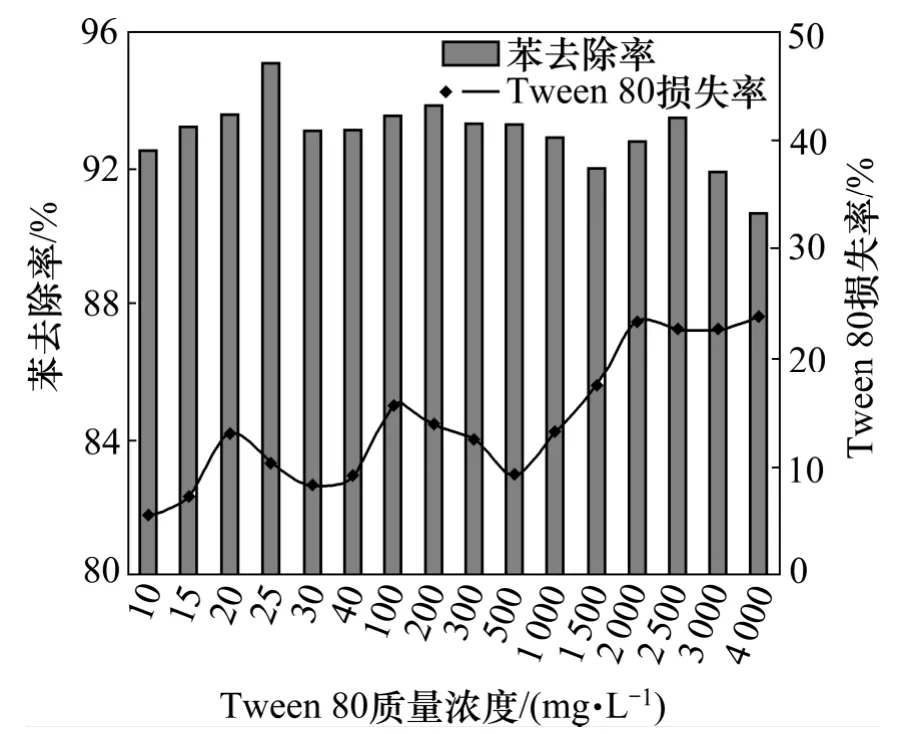
图1 Tween 80 浓度对萃取效果的影响Fig.1 Effect of Tween 80 mass concentrations on extraction effect
如图1 所示,随着Tween 80 质量浓度的增大,苯的去除率保持在90%~96%之间,并没有发生显著变化,这可能是因为Tween 80 的临界胶束浓度(CMC)较低。但在其质量浓度超过25 mg/L 后,苯的去除率基本呈下降趋势。这主要是由于Tween 80 质量浓度超过其CMC 后,胶束的存在降低了苯从水相进入到萃取相中的驱动力,从而降低了苯的去除率;而Tween 80损失率并没有随着Tween 80 质量浓度的增大呈现规律性的变化,但从理论上来讲,在萃取过程中,与Tween 80 胶束相比,萃取剂更容易接近Tween 80 单体的疏水基团,Tween 80 损失率主要取决于在增溶液中Tween 80 单体的数量。这一结果可能是由于实验中所用的Tween 80 质量浓度远远大于其CMC,因此,其在溶液中的存在形式可能不稳定。
2.2 污染物性质对萃取效果的影响
图2 和图3 所示分别为苯和硝基苯质量浓度对萃取效果的影响。
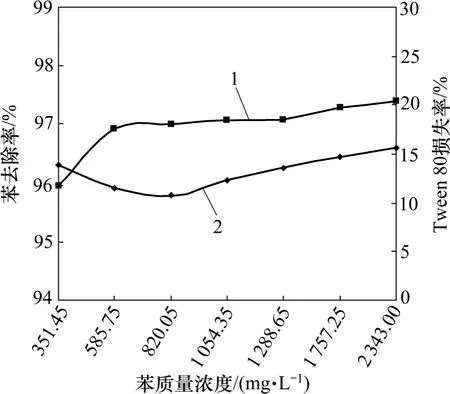
图2 苯浓度对萃取效果的影响Fig.2 Effect of benzene mass concentrations on extraction effect
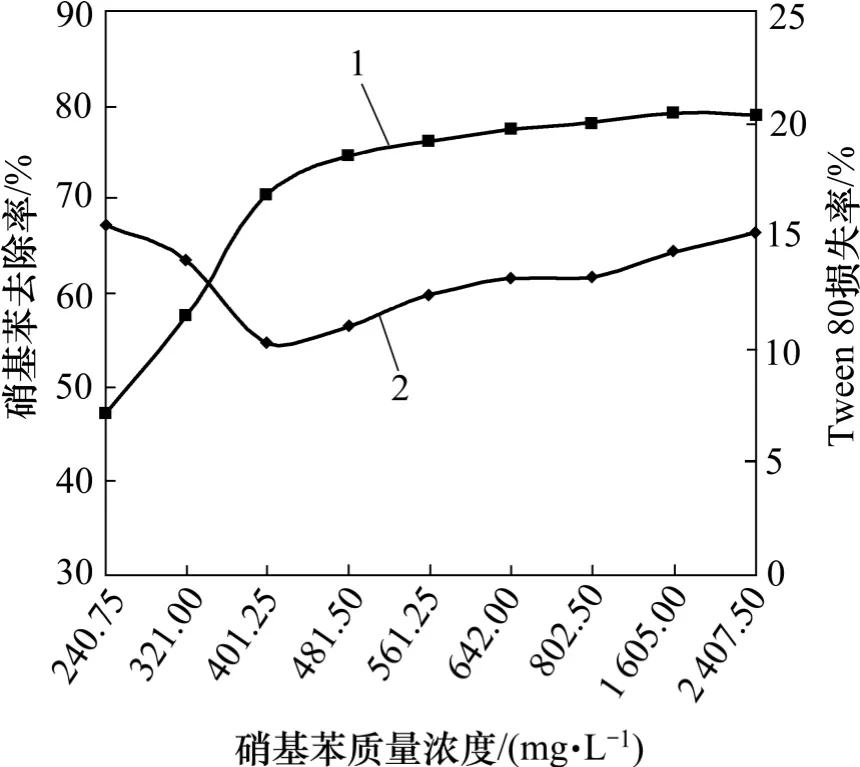
图3 硝基苯质量浓度对萃取效果的影响Fig.3 Effect of nitrobenzene mass concentrations on extraction effect
从图2 和图3 可见:随着苯和硝基苯质量浓度的升高,各自的分离去除率逐渐增大,但总体来讲,Tween 80 和苯的分离去除率较硝基苯的高,基本保持在95%以上。从分子结构上看,正己烷和苯为非极性基团,硝基苯为极性基团,从而苯比硝基苯更容易进入正己烷内。另外,在这2 个体系中,Tween 80 在正己烷中的损失率呈现先降低后升高的趋势,且Tween 80 损失率的迅速降低区间与苯去除率的显著增大区间相对应,原因可能是正己烷在萃取过程中,污染物和表面活性剂存在一定的竞争作用,当污染物被正己烷萃取的量增大时,抑制了表面活性剂向正己烷中的扩散。
苯和硝基苯质量浓度与正己烷损失率的关系如表4 所示。从表4 可见:随着污染物浓度的升高,正己烷在表面活性剂中的损失率并没有发生规律性的变化。但随着污染物种类的不同,正己烷损失率略有差异,总体来讲,在“苯+Tween 80+正己烷”的体系中,正己烷损失率较“硝基苯+Tween 80+正己烷”体系的高,这种现象与正己烷对污染物的萃取效果呈负相关,这表明污染物的萃取分离效果越好,萃取剂在表面活性剂溶液中的损失率相对越高。
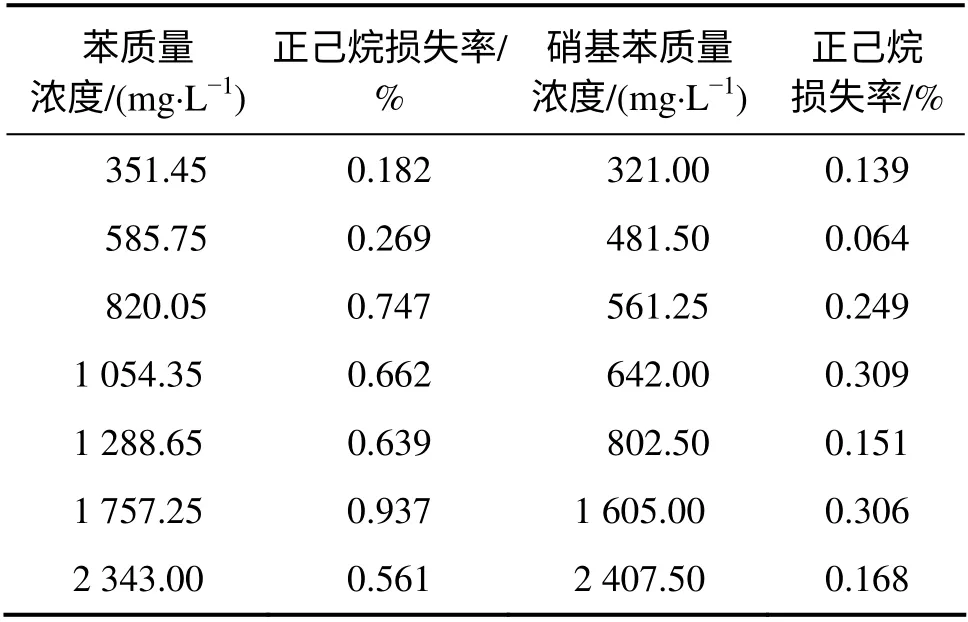
表4 苯和硝基苯质量浓度与正己烷损失率的关系Table4 Relationship between benzene and nitrobenzene mass concentrations and n-hexane loss
2.3 萃取剂EACN 对萃取效果的影响
图4 和图5 所示分别为萃取剂EACN 对萃取效果的影响。
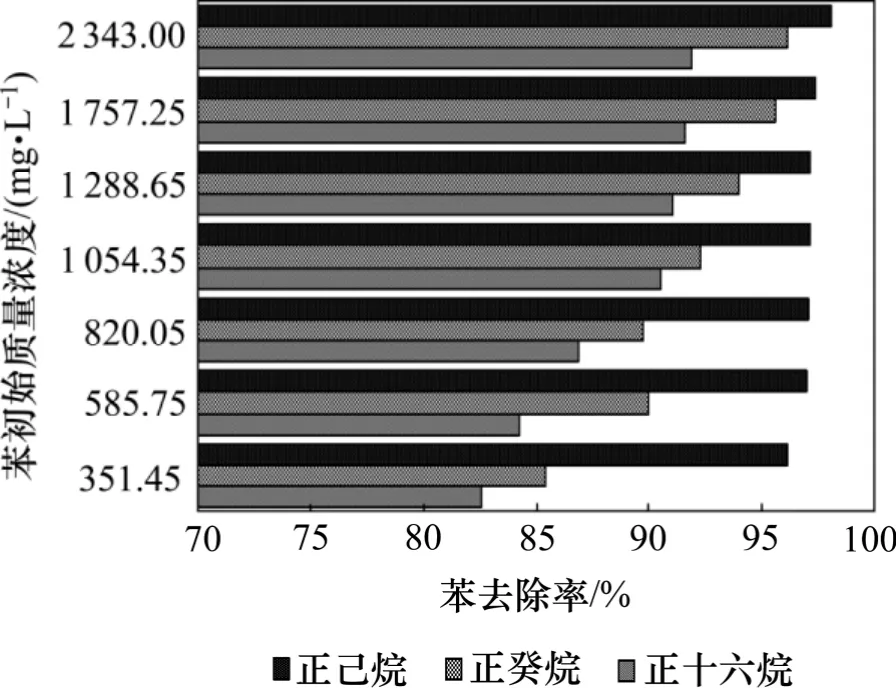
图4 不同萃取剂对苯去除率的影响Fig.4 Effects of different solvents on benzene removal
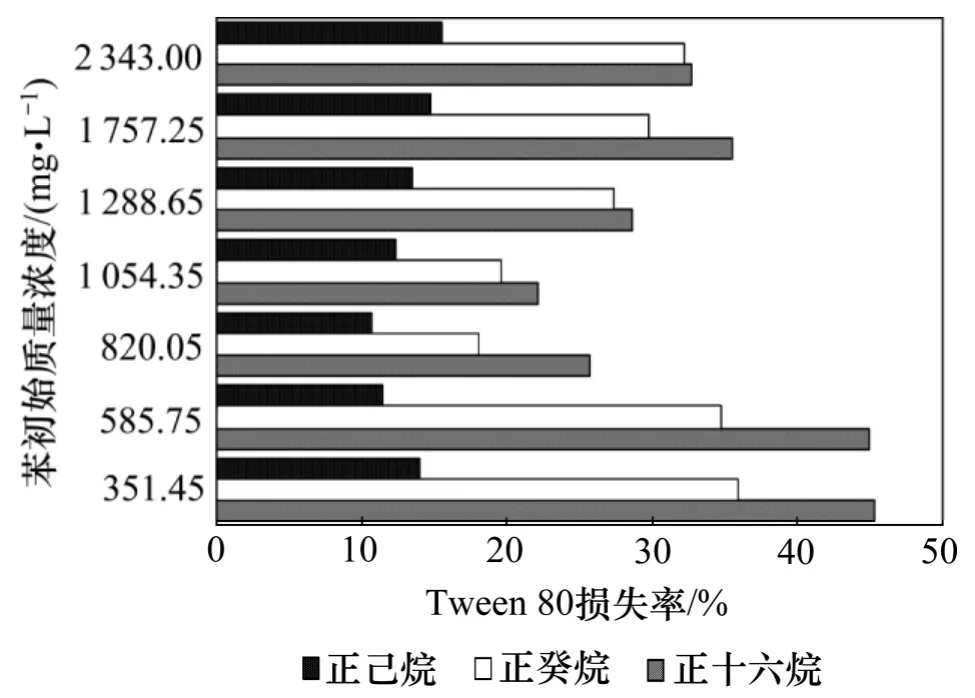
图5 不同萃取剂对Tween 80 损失率的影响Fig.5 Effects of different solvents on Tween 80 loss
从图4 可见:随着苯初始质量浓度的增大,不同萃取剂对苯和Tween 80 分离去除率均有所提高,但苯去除率增加的程度有所不同,呈现如下顺序由大至小:正己烷,正癸烷和正十六烷。正己烷对苯的分离去除率保持在95%以上,而正十六烷对苯的分离去除率从80%上升到90%,正癸烷则介于正己烷和正十六烷之间。这可能是因为污染物的去除率与污染物和萃取剂的EACN 有关,当油水两相的EACN 相近时,其界面张力相对较低[12]。苯的EACN 为0,正己烷、正癸烷和正十六烷的EACN 分别为6,10 和16。与正癸烷和正十六烷相比,正己烷的EACN 与苯的EACN 最接近,所以,在以正己烷为萃取剂的体系中,苯的去除率最高。另外,在这3 个体系中,随着苯初始质量浓度的升高,Tween 80 损失率先降低后升高,损失率从大至小顺序为:正十六烷,正癸烷和正己烷。这是因为表面活性剂的损失率与表面活性剂和萃取剂的疏水基团所含有的碳原子数有关,当二者碳原子数相接近时,有助于二者的结合,从而增大表面活性剂在萃取剂中的损失率。Tween 80 疏水基团至少有20 个碳原子,与正己烷(疏水基团含有6 个碳原子)及正癸烷(疏水基团含有10 个碳原子)相比,正十六烷(疏水基团含有16 个碳原子)更易与Tween 80 结合,所以,以正十六烷为萃取剂的体系中,Tween 80 损失率最大,而以正己烷为萃取剂的体系中,Tween 80 损失率最小。综上可知:正己烷在萃取分离苯和Tween 80 是较合适的萃取剂。
3 结论
(1) 正己烷对Tween 80 和苯的分离效果较好,且随着Tween 80 质量浓度的升高,苯的去除率没有显著变化,但在Tween 80 质量浓度超过25 mg/L 后,苯去除率逐渐降低;Tween 80 损失率没有随其质量浓度的增大呈现规律性的变化。
(2) 正己烷对苯与Tween 80 的分离效果较硝基苯好,且随着污染物质量浓度的升高,污染物的分离去除率增大,Tween 80 的损失率先减少后增大。
(3) 萃取剂EACN 对苯和Tween 80 分离去除率的影响较大,随着苯质量浓度的增大,苯的去除率均有所升高,但升高的程度有所不同,呈现如下顺序(从大至小):正己烷,正癸烷和正十六烷,而Tween 80 损失率从大至小顺序为:正十六烷,正癸烷和正己烷。
[1] 李隋, 赵勇胜, 徐巍, 等. 吐温80 对硝基苯的增溶作用和无机电解质作用机理研究[J]. 环境科学, 2008, 29(4): 920-924.LI Sui, ZHAO Yongsheng, XU Wei, et al. Solubilization of nitrobenzene in micellar solutions of Tween 80 and inorganic salts[J]. Environmental Science, 2008, 29(4): 920-924.
[2] Kungsanant S, Kitiyanan B, Rirksomboon T, et al. Recovery of nonionic surfactant from VOC-contaminated coacervate phase solutions by co-current vacuum stripping: Effect of surfactant concentration temperature, and solute type[J]. Separation and Purification Technology, 2009, 66(3): 510-516.
[3] Kungsanant S, Kitiyanan B, Rirksomboon T, et al. Toluene removal from nonionic surfactant coacervate phase solutions by vacuum stripping[J]. Separation and Purification Technology,2008, 63(2): 370-378.
[4] Kim H, Baek K, Lee J, et al. Comparison of separation methods of heavy metal from surfactant micellar solutions for the recovery of surfactant[J]. Desalination, 2006, 191: 186-192.
[5] Cheng H, Sabatini D A. Separation of organic compounds from surfactant solutions: A review[J]. Separation Science and Technology, 2007, 42(3): 453-475.
[6] 尹智娟. 亚甲蓝分光光度法测定水中阴离子表面活性剂的探讨[J]. 环境科学导刊, 2007, 26(6): 89-90.YIN Zhijuan. Reaearch on deterring anionic surface active agent in water by methylene blue spectrophotometric method[J].Environmental Science Survey, 2007, 26(6): 89-90.
[7] 李隋. 表面活性剂强化抽取处理修复DNAPL 污染含水层的实验研究[D]. 长春: 吉林大学环境与资源学院, 2008: 12-14.LI Sui. Reaearch on surfactant enhanced pimp and treat remediation of a DNAPL contaminated aquifer[D]. Changchun:Jilin University. College of Environment and Resources, 2008:12-14.
[8] 钟金魁, 赵保卫, 朱琨, 等. 表面活性剂对菲的增溶动力学及质量增溶比与亲水亲油平衡值的关系[J]. 环境化学, 2011,30(10): 1737-1742.JIN Zhongkui, ZHAO Baowei, ZHU Kun, et al. Solubilization kinetics of phenanthrene by surfactants and relation between weight solubilization ratio and hydrophile-lipophile balance[J].Environmental Chemistry, 2011, 30(10): 1737-1742.
[9] Cheng H, Sabatini D A. Reverse-micellar extraction for micellar-solubilized contaminant and surfactant removal[J].Separation and Purification Technology, 2001, 24: 437-449.
[10] 朱瑞佳, 赵保卫, 吴咏琪, 等. 溶剂萃取去除模拟土壤淋洗液中DNAPLs[J]. 兰州交通大学学报, 2008, 27(3): 51-54.ZHU Ruijia, ZHAO Baowei, WU Yongqi, et al. Removal of DNAPLs from simulated soil flushing by solvent extraction[J].Journal of Lanzhou Jiaotong University, 2008, 27(3): 51-54.
[11] Rujirawanich V, Chuyingsakultip N, Triroj M, et al. Recovery of surfactant from an aqueous solution using continuous multistage foam fractionation:influence of design parameters[J]. Chemical Engineering and Processing, 2012, 52(2): 41-46.
[12] 朱宪, 王洪钟, 陆巍然. 分子的拓扑与表面活性剂的EACN值[J]. 环境科学学报, 1999, 19(4): 384-389.ZHU Xian, WANG Hongzhong, LU Weiran. Molecular topology and EACN values of surfactants[J]. Journal of Environmental Science, 1999, 19(4): 384-389.
[13] 王晓燕, 郑建中, 翟建平. SEAR 技术修复土壤和地下水中NAPL 污染的研究进展[J]. 环境污染治理技术与设备, 2006,7(10): 3-4.WANG Xiaoyan, ZHENG Jianzhong, ZHAI Jianping. Advances in surfactant enhanced aquifer remediation of NAPLcontaminated soil and groundwater systems[J]. Techniques and Equipment for Environmental Pollution Control, 2006, 7(10):3-4.
[14] Hasegawa M A, Sabatini D A, Harwell J H. Liquid-liquid extraction for surfactant-contaminant separation and surfactant reuse[J]. Journal of Environmental Engineering, 1997, 123(7):691-697.
[15] Lee D H. Experimental investigation of the removal of hydrophobic organic compounds from two lowa soils using food grade surfactants and recovery of used surfactants[D]. Ames,Lowa: Lowa State University, 1999: 101-116.
[16] Lee D H, Robert D C, Kim D J. Surfactant recycling by solvent extraction in surfactant-aided remediation[J]. Separation and Purification Technology, 2002, 27(1): 77-82.
[17] 朱瑞佳, 赵保卫, 吴咏琪, 等. 正己烷萃取去除模拟阴-非混和表面活性剂土壤淋洗液中的DNAPLs[J]. 环境化学, 2008,27(6): 791-794.ZHU Ruijia, ZHAO Baowei, WU Yongqi, et al. Removal of DNAPLs from simulated mixed anionic-nonionic surfactant soil flushing by n-hexane solvent extraction[J]. Environmental Chemistry, 2008, 27(6): 791-794.
[18] John H. Groundwater chemicals desk reference[M]. Boca Raton:CRC Press LLC, 2000: 572-638.
[19] 杨育杰, 张新申, 俞凌云. 表面活性剂测定研究进展[J]. 西部皮革, 2012, 32(1): 16-19.YANG Yujie, ZHANG Xinshen, YU Lingyun. Progress in research on the determination of surfactants[J]. Westleather,2012, 32(1): 16-19.

