CoOχ-TiO2催化臭氧氧化草酸的研究
张 静,杨忆新,马 军,汤 黎(.四川大学建筑与环境学院,四川 成都 60065;.东北大学秦皇岛分校环境科学与工程系,河北 秦皇岛 066004;.哈尔滨工业大学市政环境工程学院,黑龙江 哈尔滨 50090)
CoOχ-TiO2催化臭氧氧化草酸的研究
张 静1,杨忆新2,马 军3*,汤 黎3(1.四川大学建筑与环境学院,四川 成都 610065;2.东北大学秦皇岛分校环境科学与工程系,河北 秦皇岛 066004;3.哈尔滨工业大学市政环境工程学院,黑龙江 哈尔滨 150090)
采用溶胶凝胶的方法制备CoOx-TiO2催化剂,对臭氧流量、催化剂投量、反应温度、草酸初始浓度、pH值等影响草酸去除率的因素进行了研究,并探讨了催化机理.实验结果表明,溶液初始pH值对草酸的去除率有显著的影响,溶液初始pH值为3时,草酸具有去95.7%的最高去除率.催化氧化过程中草酸被彻底矿化为CO2和H2O.通过叔丁醇实验和电子顺磁共振波谱仪(ESR)证明,在催化过程中有羟基自由基的生成,但羟基自由基并不是主要的氧化剂.草酸可能首先在催化剂表面发生吸附或者络合,然后被羟基自由基或者臭氧分子直接氧化.
TiO2;草酸;臭氧;羟基自由基
臭氧在水处理中除作为消毒剂外,作为氧化剂去除水中难降解有机污染物也具有良好的效果.目前对于金属催化臭氧的研究大多集中在过渡金属上,如 Fe2O3[1-2]、MnO2[3-5]、ZnO[6]、Co3O4[7]、TiO2[8-10]等金属氧化物及负载型的金属氧化物.这些催化剂能一定程度上提高臭氧的氧化效果,如负载型的CoO/ZrO2[11]、Ru/Al2O3[12]、MnOχ/ZrO2[13]、MnOχ/Al2O3[14]、Fe3+/A l2O3[15]催化O3氧化均能大幅地提高臭氧的氧化效果.
根据已有的文献报道,负载型的金属氧化物具有较好的催化效果.周云瑞等[16]发现铈 Ce的掺杂对Ru/Al2O3催化臭氧氧化有明显提高.但大多催化剂并不是简单的 2种金属的叠加,不同的制备方法,不同的金属组合具有不同的催化效果.Choi等[17]的研究发现Fe3+、V3+、Cr3+、Ni2+、 Zn2+、Re5+等过渡金属元素掺杂在一定程度上均提高了TiO2的光活性,但Li+、Mg2+、Al3+、Ga3+等主族金属元素的掺杂反而降低了TiO2的光活性.张彭义等[18]研究发现浸渍法制得的单组分和双组分铁、镍氧化物没有明显的催化活性,沉淀法制得的铁、镍双组分催化剂具有明显的催化活性,不同的铁、镍比的催化剂催化活性差别很大,催化活性与活性组分的比例和制备方法有很大关系,在适宜的掺杂比例和制备条件下制备的双金属氧化物能够有效提高单一金属氧化物催化臭氧的效果.
目前关于过渡金属掺杂改性在臭氧催化方面的报道相对较少,关于TiO2掺杂改性的研究较多集中于在光催化方面的应用.本文采用钴离子掺杂TiO2制备催化剂,考察催化臭氧去除草酸的效果和性能,并对去除草酸的反应机理进行探讨.
1 实验材料与方法
1.1 实验材料
钛酸丁酯(天津市化学试剂厂,分析纯),无水乙醇(哈尔滨化学化工试剂厂,分析纯),盐酸(天津大学化学试剂厂,分析纯),硫代硫酸钠(天津大学化学试剂厂,分析纯),草酸(分析纯,天津市天大化学试剂厂),叔丁醇(分析纯,天津市博迪化工有限公司)DMPO(分析纯,美国西格玛公司),氯化钴(上海山浦化工有限公司,分析纯),高氯酸(北京化工厂,分析纯),氢氧化钠(哈尔滨新达化工厂,分析纯).实验中所用溶液均采用M illi-Q(18.2MΩ·cm)超纯水配置.
1.2 实验方法
CoOχ-TiO2催化剂采用溶胶凝胶法,通过马弗炉一定的高温煅烧制备.臭氧采用一次性投加.臭氧投加完成后同时向溶液中加入目标物和催化剂,加入瞬间反应计时开始,分别在反应进行0,5,10,20,30min时取样.所取水样立即加入10m L试管中(预置0.5m L浓度0.025mol/L硫代硫酸钠溶液).待测水样经玻璃纤维滤膜(watman公司)过滤后,进入waters液相色谱进行分析测定.草酸的液相测定条件为:Atlantis dC18(5µm×250mm× 4.6mm)色谱柱,柱温恒定 30℃,流动相为体积比20/80的乙腈/磷酸缓冲溶液,流速 1m L/min,在210nm处紫外检测器单波长检测.
2 结果与讨论
2.1 催化剂的活性
由图1可知,反应进行20m in后,CoOχ-TiO2的催化臭氧氧化去除草酸的效果为 42.0%,远远大于而钴氧化物和纯二氧化钛混合催化臭氧氧化去除草酸的效果.
为考察反应体系中草酸在粉末催化剂表面的吸附情况,实验结果如图2所示.以氧气代替臭氧通入反应体系,其余实验条件保持与图 1的实验条件一致进行催化剂的吸附试验.在通入氧气20min后,TiO2和CoOχ-TiO2对于草酸的吸附率分别为 0.2%和 1.2%,可见草酸在催化剂的表面吸附量很小,或者可能是由于反应体系中的草酸的浓度过高,导致较小的吸附量表现不明显.由图2可见,随着反应时间的进行,纯 TiO2和 CoOχ-TiO2对于草酸的吸附均较小,草酸的去除主要是由于催化氧化.
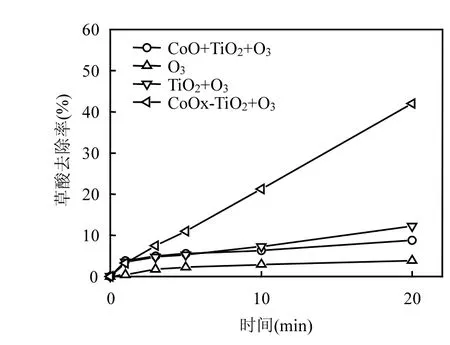
图1 不同催化剂催化臭氧氧化去除草酸的降解效能Fig.1 Degradation efficiencies of oxalic acid during ozonation w ith different catalyts
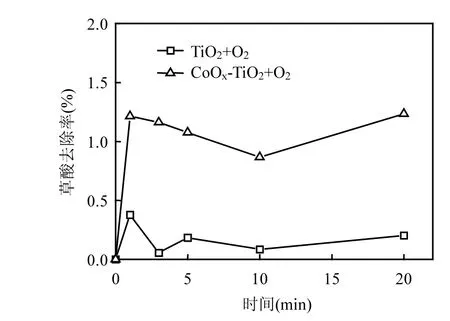
图2 催化剂吸附草酸的去除率Fig.2 Degradation of oxalic acid by adsorption w ithcatalysts
2.2 臭氧条件对催化效果的影响
实验结果如图3所示.在反应20min时,臭氧流量分别为13mg/min,19mg/min,29mg/min的试验条件下,草酸的去除率分别为70.1%、80.1%、94.9%.可见,随着臭氧流量的提高,草酸的去除率也随之提高,两者成正相关.随着反应的进行,当达到30m in的反应时间时,不同臭氧流量条件下的草酸均已基本去除.
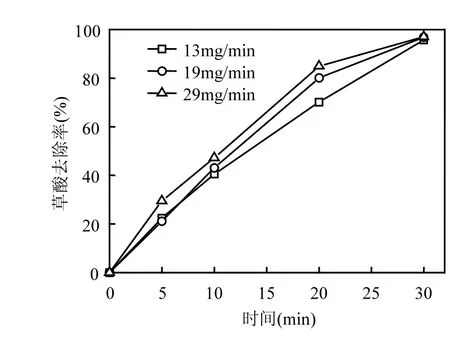
图3 不同臭氧流量条件下CoOχ-TiO2催化臭氧氧化降解草酸的去除率Fig.3 Removal efficiency of oxalic acid at different O3doses during catalytic ozonation w ith CoOχ-TiO2
2.3 不同催化剂投量对催化效果的影响
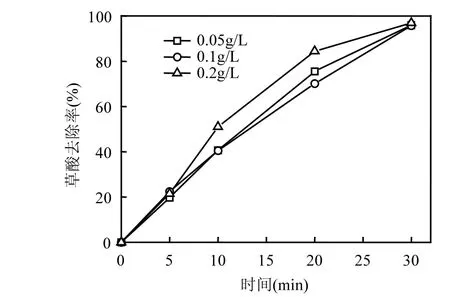
图4 不同催化剂投量下CoOχ-TiO2催化臭氧氧化降解草酸的去除率Fig.4 Removal efficiency of oxalic acid at different catalyst doses during catalytic ozonation w ith CoOχ-TiO2
实验结果如图 4所示,在草酸初始浓度1mmol/L、臭氧流量13mg/m in、水温20℃的反应条件下,进行反应至30m in时,不同投量条件下的催化反应中草酸都已基本去除.在反应 20m in,催化剂投量为0.05g和0.1g时,草酸的去除率分别为75.5%和70.1%,0.2g催化剂投量时草酸去除率为84.4%.当催化剂的投量从0.05g上升到0.2g时,草酸的去除率上升了 8.9%;从0.1g投量上升到0.2g投量时,草酸去除率上升了14.3%.催化剂的投量并不与草酸的去除率成线性正相关.催化剂投量的加大,可能增加羟基自由基的生成提高草酸的去除率,同时也可能增加羟基自由基之间自身淬灭的几率.此外,催化剂投量的加大,可能增加催化剂在水溶液中的团聚,反而减少了表面的有效活性点位.
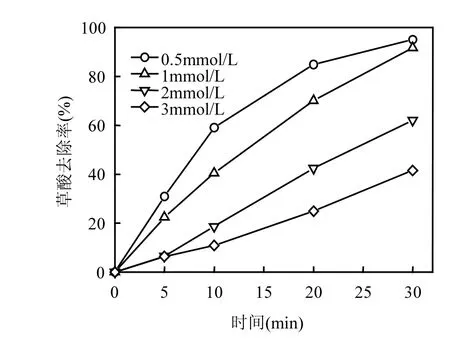
图5 不同草酸初始浓度条件下CoOχ-TiO2催化臭氧氧化降解草酸的去除率Fig.5 Removal efficiency of oxalic acid at different initial oxalic acid concentrations during catalytic ozonation w ith CoOχ-TiO2
2.4 不同草酸初始浓度对催化效果的影响如图 5所示,当草酸初始浓度为 1mmol/L, 2mmol/L,3mmol/L时,草酸的去除率几乎与时间成线性关系.当草酸的初始浓度为0.05mmol/L时,
在 20m in时草酸的去除率为 84.9%,高于
1mmol/L,2mmol/L,3mmol/L时草酸初始浓度条件下的去除率.当反应进行至30min时,草酸初始浓度为0.5mmol/L和1mmol/L反应条件下的草酸去除率相似. CoOχ-TiO2催化臭氧氧化去除草酸的去除率与草酸初始浓度成负相关,随着草酸初始浓度的增加,草酸去除率也随之减少.
2.5 反应温度对催化效果的影响
在反应进行至30m in时, 10℃的草酸去除率为76.5%,远低于20,30,40℃的去除率(图6),说明反应温度过低不利于反应的进行.20,30,40℃水体温度下进行的催化臭氧氧化实验的草酸去除率在 30min时相差并不大,40℃反应条件下的草酸去除率略高于 20,30℃反应条件下的去除率,水体温度与草酸的去除率不成正相关.随着体系温度的升高,臭氧的分解加快生成羟基自由基的速度也加快,可能提高目标物的去除率也可能使得羟基自由基相互淬灭的可能性加大,同时温度的提高使得臭氧的气液传质受到影响.
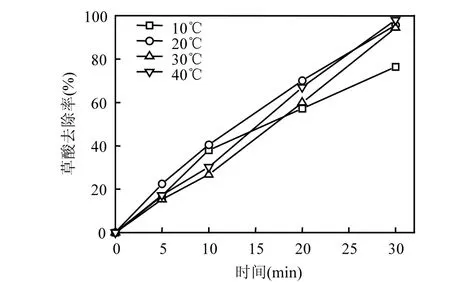
图6 不同反应温度下CoOχ-TiO2催化臭氧氧化降解草酸的去除率Fig.6 Removal efficiency of oxalic acid at different temperatures during catalytic ozonation w ith CoOχ-TiO2
2.6 pH值对催化效果的影响
在不加入缓冲溶液的条件下,采用HClO4和NaOH调节溶液的初始 pH值为 1~6,进行CoOχ-TiO2催化臭氧氧化草酸的实验,结果见图7.由图7可见,当溶液初始pH值分别为1、2、3、4、5、6时,反应进行30m in后的草酸去除率分别为44.7%、74.0%、95.7%、55%、31.8%%、22.6%.溶液初始 pH值对草酸的去除率有显著的影响,当初始pH值为3时,具有最好的草酸去除效果.
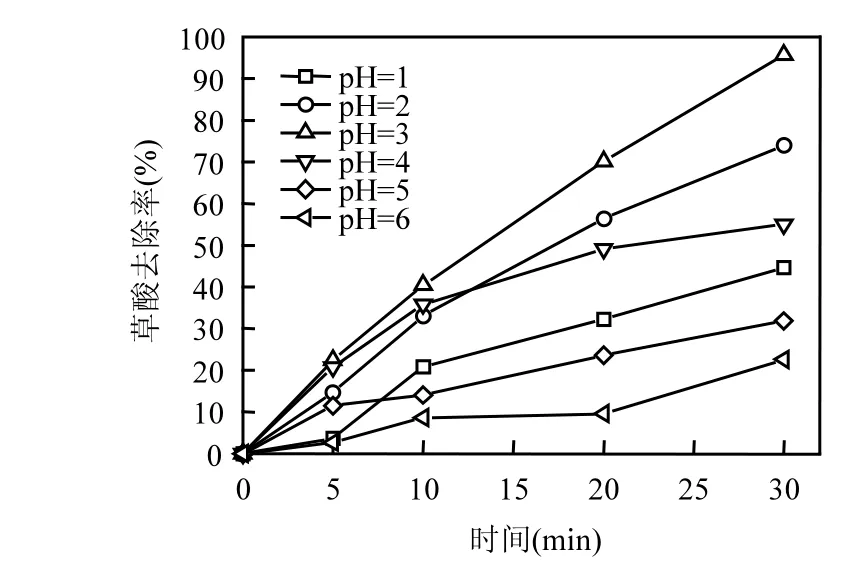
图7 不同初始pH值下CoOχ-TiO2催化臭氧氧化降解草酸的去除率Fig.7 Removal efficiency of oxalic acid at different initialpH values during catalytic ozonation w ith CoOχ-TiO2
由于溶液 pH值的不同,草酸在溶液中有H2C2O4、H2C2O4-和C2O42-3种不同的存在形式.作为二元酸,草酸的pKa1和pKa2分别为1.23和4.19[19].当pH值小于1.23时,草酸主要以H2C2O4的分子形式存在,基本不以离子形态存在;当溶液pH值为1.23~4.19时,草酸以HCO、HCO-
224224
和 C2O42-3种形式共存,并且随着 pH值的升高,离子形式草酸的存在比例也随之增加;当 pH值大于 4.19时,草酸主要以 C2O42-的形式存在. CoOχ-TiO2的表面等电点为 7.1,当溶液的初始pH 值为 1~6时,此时溶液的 pH 值低于CoOχ-TiO2的 pHpzc,CoOχ-TiO2催化剂的表面带正电荷.当溶液的初始pH值为1时,此时的草酸的主要存在形式为H2C2O4分子, CoOχ-TiO2表面带正电荷,此时两者间主要是非静电作用力决定.当溶液初始pH分别为2、3、4时,此时的草酸以H2C2O4、H2C2O4-和 C2O42-3 种形式共存, CoOχ-TiO2在这个 pH值范围内表面带正电荷,CoOχ-TiO2与草酸之间主要是电荷的静电力作用,此时草酸的去除率高于溶液初始pH值为1时的去除率,说明静电作用力的吸附作用大于非静电力的吸附.由于 pH值越高草酸所带负电荷越多,而随着 pH值的升高催化剂表面所带正电荷也随之减少,并不是溶液的 pH值越高,草酸和催化剂间的静电作用力越大,因此存在一个最佳的pH值使得草酸在催化剂表面有着最大的吸附量.由图7可知,当溶液初始pH值为3时草酸的去除率最高,可见当溶液pH值为3时,CoOχ-TiO2与草酸之间的作用力最大,草酸在催化剂表面的吸附量最多.当溶液初始pH值为5和6时,草酸主要以 C2O42-形式存在,CoOχ-TiO2表面带正电荷,两者之间主要作用力为静电力,由于 pH值升高使得 CoOχ-TiO2表面正电荷减少,不利于草酸在CoOχ-TiO2表面的吸附,导致草酸去除率降低.
综上分析,CoOχ-TiO2催化臭氧氧化草酸的反应过程中,草酸在CoOχ-TiO2表面的吸附或者络合是反应的关键步骤,草酸可能在催化剂表面吸附或者络合后进一步被臭氧和羟基自由基氧化.
2.7 臭氧催化氧化分解草酸过程中TOC的变化
由图8可见,草酸的去除率与TOC的去除率基本一致,草酸降解过程中没有中间产物生成,完全矿化为水和二氧化碳.
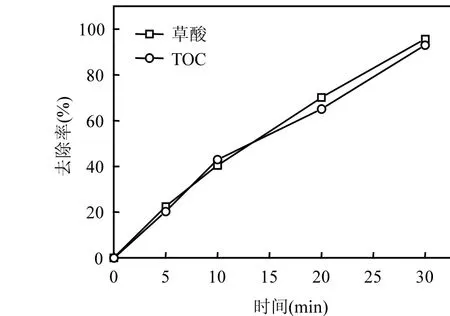
图8 草酸催化臭氧氧化过程中TOC的变化Fig.8 Variation of TOC during catalytic ozonation of oxalic acid
2.8 催化过程中主要氧化物种
2.8.1 臭氧氧化过程中自由基抑制剂对草酸降解效果的影响 推测在 CoOχ-TiO2催化臭氧分解去除草酸的反应过程中,羟基自由基可能为此反应过程的主要氧化剂,此反应可能为羟基自由基主导的反应.为考察CoOχ-TiO2催化臭氧分解草酸的过程中羟基自由基是否为主要的氧化剂,加入过量的自由基抑制剂叔丁醇进行试验,试验结果如图9所示.由图9可见,叔丁醇的加入明显抑制了CoOχ-TiO2催化臭氧氧化草酸的去除效果,使得草酸的去除率显著降低,间接证明此反应过程生成了羟基自由基并且作为氧化剂参与了草酸的氧化反应.但是过量的叔丁醇的加入并没有能完全抑制草酸的去除,说明在CoOχ-TiO2催化臭氧氧化草酸的反应过程中,羟基自由基并不是唯一的氧化剂.
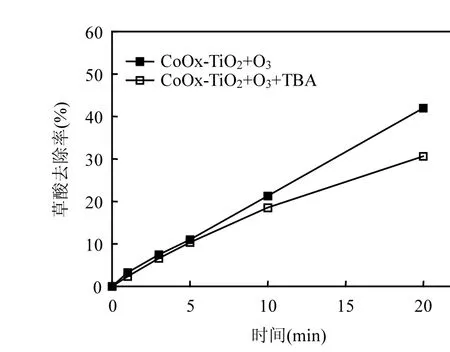
图9 叔丁醇对催化臭氧化草酸效果的影响Fig.9 Effect of TBA on removal efficiency of oxalic acid during catalytic ozonation
2.8.2 羟基自由基的鉴定 为进一步证明CoOχ-TiO2催化臭氧的过程中有羟基自由基的生成,加入DMPO与羟基自由基生成便于检测的DMPO-OH,采用电子顺磁共振波谱仪(ESR)进行测定.测定条件为:中心场强 3512G,扫描宽度300G,微波频率9.869GHz,功率2.176mW,倍增器放大倍数 1.42×104,扫描 5次的加权平均值作为最终记录结果,所得图谱如图10所示.由图10可见,在 CoOχ-TiO2催化臭氧裂解的过程中加入DMPO后测得的谱图为DMPO-OH的四重分裂峰,证明所检测到的为加成产物DMPO-OH.
综合图7、图9的实验分析,CoOχ-TiO2能够催化臭氧裂解生成高活性的羟基自由基,在催化臭氧草酸的反应中,羟基自由基作为氧化剂之一参与了反应,但此反应并不是羟基自由基为主导的氧化反应.草酸的去除可能与催化剂的表面性质有较大关系,除羟基自由基外臭氧可能也直接参与了氧化草酸的反应.

图10 CoOχ-TiO2催化臭氧氧化过程中的ESR谱Fig.10 ESR spectra of catalytic ozonation in the presence of CoOχ-TiO2
3 结论
3.1 CoOχ-TiO2具有良好的催化臭氧去除草酸的效果,反应进行30min后,基本能达到100%的去除率.臭氧投量,催化剂投量,草酸初始浓度,反应温度对草酸的降解具有较明显的影响.
3.2 溶液pH值显著影响草酸的降解. pH值为3附近是最有利于草酸去除的 pH值条件.草酸可能首先在催化剂表面发生吸附或者络合,然后被羟基自由基或者臭氧分子直接氧化.
3.3 CoOχ-TiO2催化臭氧彻底矿化草酸为二氧化碳和水. CoOχ-TiO2催化臭氧生成了羟基自由基,但羟基自由基并不是草酸降解的主要氧化剂.
[1] Jung Haeryong, Park Hosik, Kim Jun, et al. Preparation of biotic and abiotic iron oxide nanoparticles (IOnPs) and their properties and applications in heterogeneous catalytic oxidation [J]. Environmental Science and Technology, 2007,41(13):4741-4747.
[2] Jung Haeryong, Kim Jung-Woo, Choi Heechul, et al. Synthesis of nanosized biogenic magnetite and comparison of its catalytic activity in ozonation [J]. Applied Catalysis B: Environmenta, 2008,83(3/4):208-213.
[3] Andreozzi R, Insola A, Caprio V, et al. The use of manganese dioxide as a heterogeneous catalyst for oxalic acid ozonation in aqueous solution [J]. Applied Catalysis A: General, 1996,138(1):75-81.
[4] Andreozzi R, Caprio V, Insola A, et al. The ozonation of pyruvic acid in aqueous solutions catalyzed by suspended and dissolved manganese [J]. Water Research, 1998,32(5):1492-1496.
[5] Tong Shao-ping, Liu Wei-ping, Leng Wen-hua, et al. Charcteristics of MnO2catalytic ozonation of sulfosalicylic acid and propionic acid in water [J]. Chemosphere, 2003,50(10):1359-1364.
[6] 赵大鹏,徐贞贞,王洪蕾. ZnO/O3工艺降解水中微量有机物的研究 [J]. 供水技术, 2008,2(4):20-23.
[7] Alvarez P M, Beltran F J, Pocostales J P, et al. Preparation and structural characterization of Co/A l2O3catalysts for the ozonation of pyruvic acid [J]. Applied Catalysis B: Environmental, 2007, 72(3/4):322-330.
[8] Volk C, Roche P, Joret J C, et al. Comparison of the effect of ozone, ozone-hydrogen peroxide system and catalytic ozone on the biodegradable organic matter of a fulvic acid solution [J]. Water Research, 1997,31(3):650-656.
[9] Fernando J Beltrán, Francisco J Rivas, Ramón Montero-de- Espinosa. Catalytic ozonation of oxalic acid in an aqueous TiO2slurry reactor [J]. Applied Catalysis B: Environmental, 2002, 39(3):221-231.
[10] Fernando J Beltrán, Francisco J Rivas, Ramón Montero-de-Espinosa. A TiO2/Al2O3catalyst to improve the ozonation of oxalic acid in water [J]. Applied Catalysis B: Environmental, 2004,47(2):101-109.
[11] Hu Chun, Xing Shengtao, Qu Jiuhui, et al. Catalytic ozonation of herbicide 2,4-D over cobalt oxide supported on mesoporous zirconia [J]. Journal of Physical Chemistry C, 2008,112(15): 5978-5983.
[12] Zhou Yunrui, Zhu Wanpeng, Liu Fudong, et al. Catalytic activity of Ru/A l2O3for ozonation of dimethyl phthalate in aqueous solution [J]. Chemosphere. 2007,66(1):145-150.
[13] Xing Shengtao, Hu Chun, Qu Jiuhui, et al. Characterization and reactivity of MnOx supported on mesoporous zirconia for herbicide 2,4-D mineralization w ith ozone [J]. Environmental Science and Technology, 2008,42(9):3363-3368.
[14] 王美艳,朱天乐,樊 星.低浓度苯系物在室温下的 MnOx/A l2O3催化O3氧化 [J]. 中国环境科学, 2009,29(8):806-810.
[15] Yang Li, Hu Chun, Nie Yulun, el al. Catalytic ozonation of selected pharmaceuticals over mesoporous alum ina-supported manganese oxide [J]. Environmental Science and Technology, 2009,43(7):2525-2529.
[16] 周云瑞,祝万鹏,陈 迅.铈掺杂 Ru/Al2O3催化臭氧氧化降解邻苯二甲酸二甲酯 [J]. 中国环境科学, 2006,26(4):445-448.
[17] Choi W, Term in A, Hoffmann. The role of metal ion dopants in quantum-sized TiO2: correlation between photoreactivity and charge carrier recombination dynamics [J]. Journal of Physical Chem istry, 1994,98(51):13669-13679.
[18] 张彭义,祝万鹏,吕 斌.Ni、Fe氧化物对吐氏酸废水催化臭氧化研究 [J]. 上海环境科学, 1996(15):25-27.
[19] 黄君礼.水分析化学 [M]. 北京:中国建筑工业出版社, 2008: 489-499.
Performance investigation of catalytic ozonation of oxalate by CoOχ-TiO2.
ZHANG Jing1, YANG Yi-xin2, MA Jun3*,
TANG Li3(1.College of Architecture and Environment, Sichuan University, Chengdu 610065, China;2.Department of Environmental Science and Engineering, Northeastern University at Qinhuangdao, Qinhuangdao 066004, China;3.School of Municipal and Environmental Engineering, Harbin Institute of Technology, Harbin 150090, China). China Environmental Science, 2014,34(6):1457~1462
CoOχ-TiO2was prepared by sol-gel method. The effects of ozone flow, catalyst dosage, reaction temperature, initial concentration of oxalate and pH value on the removal rate of oxalate were discussed. The catalytic mechanism was also investigated. The catalytic ozonation was remarkable affected by pH value. The best removal rate of oxalate reached to 95.7% was found when pH value was 3. Oxalate was absolutely mineralized into CO2and H2O in catalytic ozonation. Through TBA experiment and ESR, hydroxyl radicals which generated in catalytic process weren’t the main oxidant. Oxalic acid may first be adsorbed or chelated on the surface of catalyst, and then oxidized by hydroxyl radicals or ozone molecules directly.
TiO2;oxalate;ozone;hydroxy radical
X703.1
A
1000-6923(2014)06-1457-06
张 静(1981-),女,四川汉源人,讲师,博士,主要从事水深度处理相关研究.发表论文10余篇.
2013-09-18
国家自然科学基金(51008052);教育部博士点新教师基金(20100042120018)
* 责任作者, 教授, majun@hit.edu.cn

