ATR-FTIR检测毕赤酵母发酵中甘油和甲醇浓度*
吴胜,杭海峰,郭美锦,储炬,庄英萍,张嗣良
(华东理工大学生物反应器工程国家重点实验室,上海,200237)
甲醇营养型毕赤酵母已经成为生产外源蛋白最常用的生产菌种之一,培养基的改进及发酵条件的优化显著提高了工业化生产通量[1-3]。毕赤酵母发酵主要采用无机盐培养基,在甘油批培养阶段,以甘油为碳源菌体快速生长,获得合适的菌体密度之后,需要监测甘油是否全部耗尽[4],发酵液中残余的甘油将会影响外源蛋白的启动表达效率[5]。进入诱导阶段后碳源转换为甲醇,此时甲醇既充当唯一的碳源又是诱导剂[6],培养过程中甲醇不会被完全利用而累积,为了防止甲醇在发酵液中的过量累积抑制细胞生长,动态监测发酵液中的甲醇浓度成为必要[7-9]。
红外光谱(4 000~400 cm-1)能够提供几乎所有物质的结构信息,特别是在1 800~800 cm-1,这一波段称为指纹图谱区,对应分子和官能团的指纹振动,既能对已知物定量分析,也能鉴定可能存在的未知物[10]。通过使用衰减全反射(Attenuated Total Reflection,ATR)技术,有效地解决了在发酵液中强烈的水吸收和MIR穿透能力较弱的问题[11-14]。生物过程中所包含的物质是十分复杂的,采集的红外光谱通常包含了诸多信息,选取合适的化学计量学方法能够在复杂的光谱图中提取有效信息,建立预测模型[15-16]。傅里叶红外光谱法(Fourier Transform Infrared Spectroscopy,FIIR)的快速、通用、稳定、无破坏性和化学计量学方法的发展,使得红外光谱法结合衰减全反射技术已经在生物过程监测中有了诸多应用[17-21]。
本研究中,应用ATR-FTIR结合偏最小二乘法(Partial Least Squares,PLS)建立了甘油、甲醇浓度的预测模型,该方法快速、无破坏性、样品无需处理。模型成功在5 L发酵罐中监测甘油和甲醇的浓度变化,并通过分析比生长速率和比生产速率,比较了两种甲醇浓度调控的方法。
1 材料和方法
1.1 材料
1.1.1 菌株
表达重组人溶菌酶的 Mut+型的毕赤酵母SMD1168,由本实验室提供。
1.1.2 培养基
种子培养基(L):蛋白胨20 g,酵母粉10 g,葡萄糖 10 g。
5 L罐培养基(L):甘油40 g,85%磷酸6.7 mL,CaSO40.93 g,K2SO418.2 g,MgSO4·7H2O 14.9 g,KOH 4.13 g,PTM1 4.5 mL。
甘油补料培养基:50%(W/V)甘油(含12 mL/L PTM1)。
甲醇补料培养基:含有12 mL/L PTM1的甲醇。
1.2 实验方法
1.2.1 种子培养
平板上挑取单菌落到种子培养基中,30℃,220 r/min,培养20 ~25 h。
1.2.2 5 L 罐发酵
本实验采用5 L搅拌式反应器(上海国强生化工程装备有限公司)进行批培养发酵,工作体积为3 L,起始搅拌、通气量和温度分别为300 r/min、1 vvm和30℃,发酵过程中用28%氨水控制发酵液pH至5.5,接种量为10%,培养过程中调节搅拌转速和通气量控制溶氧。
1.2.3 分析方法
菌体浓度及细胞干重:菌液稀释后于波长600 nm处以去离子水为对照进行比色测定,OD600=OD读数×稀释倍数。10 mL发酵液,10 000 r/min离心10 min,去上清液,水洗2次,80℃烘干至恒重,光密度值与细胞干重呈线性。
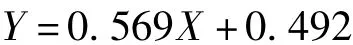
式中:X,OD600值;Y,细胞干重(DCW)。
甘油含量:通过甘油试剂盒(北京普利莱基因技术有限公司)测定。
甲醇含量:通过GC-1120气相色谱仪(上海舜宇恒平仪器有限公司)测定。检测条件:N2流量为15 mL/min,H2和空气的流量分别为30 mL/min和300 mL/min,毛细管色谱柱温度为180℃,气化室氢火焰温度为100℃,氢火焰温度为180℃,进样量为1 μL。
溶菌酶活性测定:制备溶壁微球菌悬浮液,450 nm波长下吸光值在0.7~0.8。取100 μL发酵液的上清液迅速加入微球菌悬浮液中反应1 min,观察读数值的下降并计算斜率:

FTIR:红外光谱图由带有ATR附件的NicoLet-6700型傅里叶红外光谱仪(美国赛默飞世尔科技有限公司)采集,维持恒定的环境温度和湿度,分辨率2 cm-1,扫描次数64次,波数范围4 000~400 cm-1,每1个样品扫描3次。采集的光谱由自带光谱处理软件OMNIC5.1进行处理,PLS模型建立由Unscrambler 10.2软件完成。
2 结果和分析
2.1 毕赤酵母发酵表达溶菌酶概述
图1为本研究中一批毕赤酵母发酵甘油、甲醇浓度变化图。分为3个阶段:第1阶段为甘油批培养阶段,经过一段时间的迟滞期后进入对数期,甘油开始快速消耗,菌体量快速增加,第24 h左右初始甘油耗尽。第2阶段为甘油补料批培养阶段,维持DO>30%,限制性补加甘油,获得合适的菌体浓度后,停止甘油流加。经过1~2 h的饥饿,甘油全部耗尽之后,进入甲醇诱导外源蛋白表达阶段,这一阶段维持DO大于20%。诱导前48 h溶菌酶酶活稳定增长,诱导进入到48 h之后酶活有一个跃升,72 h之后比生产速率下降,到培养结束时酶活为47 200 u/mL。
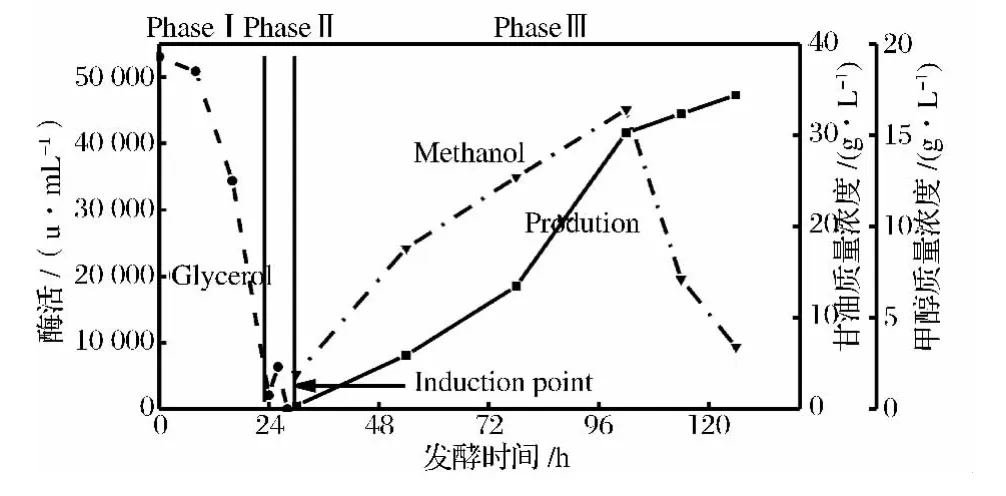
图1 毕赤酵母批培养中甘油、甲醇和产物变化Fig.1 Product,glycerol and methanol concentrations versus time during the course of a fed batch process
2.2 PLS定量模型的建立
培养采用无机盐培养基,成分明确,生长阶段甘油作为碳源,诱导阶段以甲醇为碳源。为了对发酵液红外光谱有定性认识以及确定菌体、培养基中无机盐成分是否对红外光谱图有影响,分别采集不含碳源的培养基溶液(Med)和甘油批培养阶段、甲醇诱导阶段发酵液的红外光谱图。

图2 培养开始和过程中的发酵液光谱图Fig.2 Spectra of(A)fermentation medium at the beginning and in the process with glycerol(B)fermentation medium at the beginning and in the process with methanol
图2中的光谱图基本重合,在1 150~1 000 cm-1波数内出现变化,鉴于两者的差别只有碳源的不同,说明此处代表碳源对光谱的影响。培养基中无机离子增减变化可以用渗透压强度来表示,测定培养过程中发酵液的渗透压,图3中在培养初期渗透压有一个小幅的下降,从开始时的1 355 mOsm/L下降到1 210 mOsm/L后基本维持恒定,说明培养过程中无机离子强度没有发生较大的变化,从另一个角度说明无机盐对红外谱图的影响可以忽略不计。所以后续光谱采集中均采用无甘油和甲醇的培养基(Med)作为背景。
1 800~800 cm-1波数内的红外光谱吸收对于组分定量有十分重要的意义。以Med为背景,采集20、10、5、1 g/L的甘油红外吸收谱图,如图4A所示,在1 115.8~994 cm-1区间处有甘油的C—O键对称与反对称的伸缩振动吸收峰,分别在1 098,1 046,992 cm-1处有3个明显的峰,且随浓度升高峰面积增加,而在1 480~1 130 cm-1区间虽然光谱有不同,但是并没有与浓度成一定关系。以Med为背景,采20、10、5、1 g/L的甲醇红外吸收谱,图 4B中甲醇在1 018 cm-1处有一单峰,且峰形较好,吸光度与甲醇浓度呈现出一定线性关系。
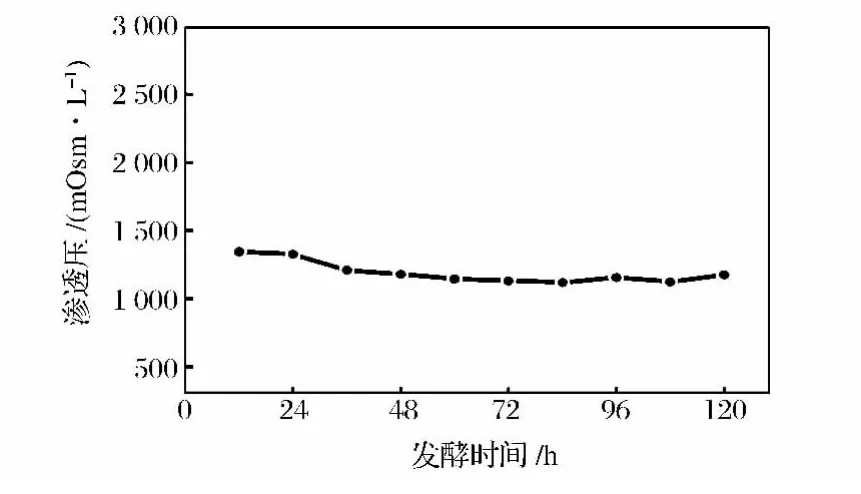
图3 培养过程中的渗透压Fig.3 Alteration of osmotic pressure during the process

图4 甘油和甲醇的红外特征吸收峰Fig.4 Absorption peak of IR spectrum of glycerol and methanol
甘油初始浓度较大,采用培养开始时无甘油的培养基作为背景,选取甘油红外谱图中1 140~950 cm-1的波数范围,在0.5~50 g/L配置了28个不同浓度水平的甘油-培养基溶液,其中17个作为建模集,11个作为验证集;由于甲醇初始浓度较小,诱导时间较长,为了校正背景变化对对谱图的干扰,采集诱导开始时和结束后继续培养直至DO回升至满度时的2个背景,视此时甲醇浓度为零,分别为B1和B2,以B=(B1+B2)/2作为背景,选取1 075-930 cm-1的波数范围,在0.1~30 g/L配置26个不同浓度水平的甲醇-培养基溶液,其中14个作为建模集,12个作为验证集。以2 cm-1为输入值点,构成输入变量,输入到UnscrambLer10.2中。光谱的预处理,通常有平滑、均值化、基线校正,多元散射校正,导数等。本研究中分别以原始光谱、基线校正及一阶导数进行光谱预处理,分别建立PLS模型,结果如表1所示。模型的质量通常校正标准误差(SEC)和验证标准误差(SEV)来评价,模型的预测能力由预测标准误差(SEP)来评价。

表1 甘油和甲醇FTIR模型Table 1 FTIR models of glycerol and methanol
从表1可以看出,采用未经处理的原始光谱得到的甘油定量模型的 SEC为0.171 g/L,SEV为0.532 g/L,均小于另外2种光谱预处理方法。采用未经处理的原始光谱得到的甲醇定量模型的SEC为0.129 g/L,SEV为0.248 g/L,同样均小于另外2种光谱预处理方法。原因可能是由于模型需要预测的甘油和甲醇成分单一,特征吸收峰明显,基线校正及一阶导数对光谱进行处理反而去掉了光谱定量的关键信息,所以本研究中甘油和甲醇的定量模型均采用原始光谱图。
图5为模型计算值与对照方法测得值的相关图,可以看出低浓度和高浓度甘油和甲醇的模型值和对照测量值均紧密贴近性能线,表明模型质量较好。
图5 甘油和甲醇相关线性图Fig.5 Correlation plot of calibration and validation sets for(A)glycerol and(B)methanol
2.3 5 L发酵罐FTIR调控
5 L搅拌式生物反应器中进行批发酵,每隔1 h采集1次发酵液的红外光谱图。设定的甘油初始浓度分别为65、55和45 g/L,图6A中采用FTIR测得的甘油浓度和试剂盒测得的浓度有很好的相关性,预测标准误差(SEP)为1.09 g/L。虽然起始的甘油浓度不相同,但均在12 h左右进入对数期生长,甘油浓度迅速下降,甘油耗尽后,限制性补加甘油,发酵液中的甘油浓度有小幅的上升,在补料结束后,甘油再次耗尽,最终菌体干重分别达到 204.5,168.4 和 146.7 g/L。甲醇诱导阶段,需要将甲醇浓度控制在0.5% ~2%,诱导92 h,图6B中,采用FTIR预测的甲醇浓度和气相色谱测得的浓度有良好的相关性,预测标准误差(SEP)为0.86 g/L。诱导开始后,发酵液中的甲醇开始累积,至40 h左右,发酵液中甲醇浓度接近20 g/L,采用FTIR调控下,降低甲醇的补加速率,甲醇浓度开始下降,在56 h下降到11.09 g/L,增加甲醇的补加速率,浓度上升,在69 h再次降低补加速率,直到培养结束。由于Mut+菌株有相对较大的甲醇耐受性,即使在没有氧限制的情况下,甲醇也能累积。维持DO>20%控制甲醇流加(DO-stat),诱导开始后,发酵液中的甲醇浓度不断累积,至培养结束时甲醇浓度达到34.55 g/L,可知采用FTIR调控的甲醇浓度要优于DO-stat调控。两个模型的SEP均大于SEC和SEV,可能是由于发酵过程中产生的副产物分泌到发酵液当中,干扰了预测的精度。
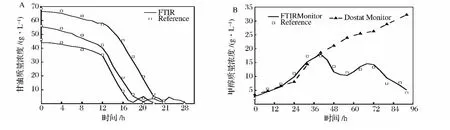
图6 5L发酵罐中FTIR监测甘油和甲醇浓度Fig.6 Monitor the concentration of glycerol and methanol by FTIR
诱导结束后,继续培养24h,目的是通过短时间内不断改变甲醇的补加速度,验证模型能够迅速响应浓度变化。由图7可知,模型预测的甲醇浓度随着甲醇补加速度的改变有相应的变化趋势,说明模型能对补加速度的改变快速做出反应。Cervera[22]总结了在生物过程中采用红外光谱法的预测精度为0.2~3 g/L,Crowley[7]的研究中,甘油和甲醇定量模型的预测精度分别为2.04和0.24 g/L,本文的研究结果与之类似,模型能够在毕赤酵母发酵过程中得到有效的应用。
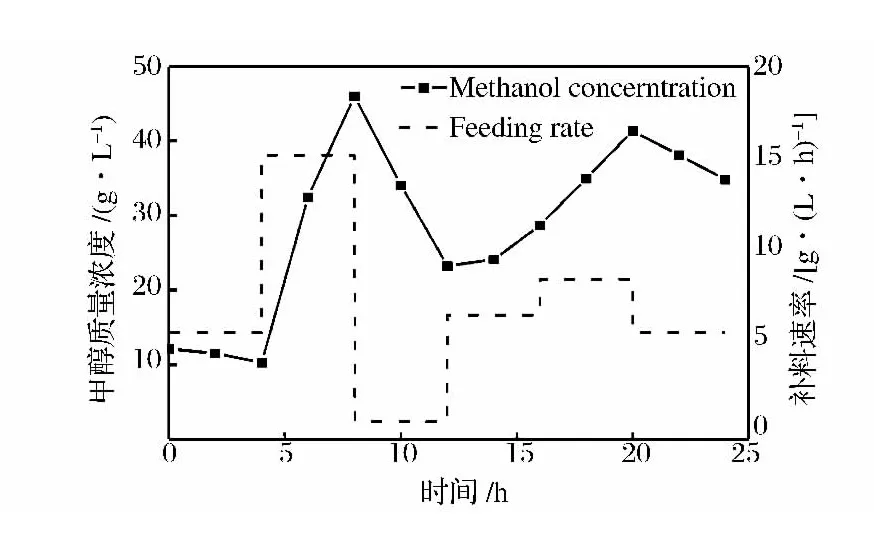
图7 甲醇模型对甲醇补加速率的响应Fig.7 Response to different methanol feeding rate of methanol model
2.4 生长和生产能力的影响
比较FTIR调控和DO-Stat调控甲醇浓度下的比生长速率(μ)和比生产速率(Qp),结果如图8所示。随着诱导时间延长,菌体的比生长速率均呈下降趋势,这既是甲醇的抑制作用,也是转而表达溶菌酶产物的需要。
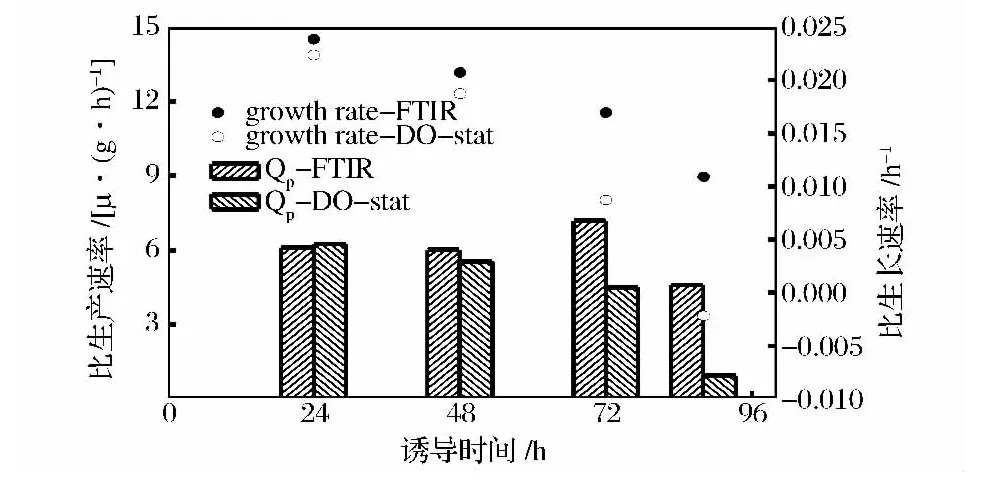
图8 FTIR和DO调控下的比生长速率和比生产速率Fig.8 Specific growth rate and production rate monitored by FTIR and DO respectively
图8中,FTIR调控下比生长速率从诱导开始的0.024 h-1下降到结束时的 0.011 h-1,下降 54.1%,而在DO-Stat调控下,不断升高的甲醇浓度对菌体生长抑制作用更加明显,比生长速率从诱导开始的0.022 h-1下降到结束时的 -0.002 18 h-1。有报道比生产速率和发酵液中甲醇的浓度存在一定的关系[6],本研究中,DO-Stat调控下诱导48 h时发酵液中甲醇浓度为2.1%,FTIR调控约为1.3%,而2种方法下比生产速率区别不大,说明在2%以内的甲醇浓度对外源蛋白的生产影响不大,而当甲醇浓度超过2%以后,比生产速率出现明显的分化,72 h时DO-stat调控的比生产速率比FTIR调控下降37.8%,92 h时下降79.2%。图9中,虽然在48h时,DO-Stat调控甲醇浓度大于2%,但是还不至于抑制菌体代谢,2种调控下的菌体摄氧率(OUR)相似,而在50 h以后,OUR出现分化,FTIR调控下,OUR不断升高,而DO调控下,甲醇浓度不断升高,菌体呼吸被抑制,OUR呈下降趋势。
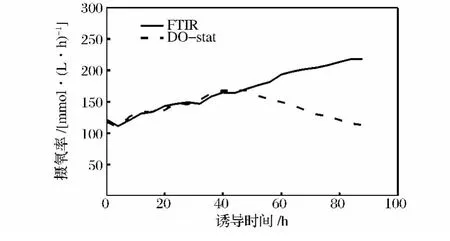
图9 FTIR和DO调控下的OURFig.9 OUR monitored by FTIR and DO respectively
3 总结
本文通过ATR-FTIR监测毕赤酵母发酵过程中底物浓度的变化情况。甘油和甲醇的红外光谱有明显的特征吸收峰。以培养开始时的无甘油培养基(Med)为背景,配置一系列甘油标准溶液,通过PLS建模获得甘油预测模型,SEC和SEV分别为0.171和0.532 g/L。以诱导开始和结束后溶氧反弹至满度时的发酵液背景[B=(B1+B2)/2]为背景,配置一系列甲醇标准溶液,通过PLS建模获得甲醇预测模型,SEC和SEV分别为0.129和0.248 g/L。5 L发酵罐中利用建立的模型预测发酵液中的甘油和甲醇的浓度,SEP分别为1.09和0.86 g/L。比较了诱导阶段分别采用FTIR调控和DO-stat调控发酵液甲醇的浓度,FTIR调控将甲醇浓度控制小于2%,比生长速率和比生产速率均高于DO-stat调控,对于其他毕赤酵母发酵表达外源蛋白具有借鉴意义。当甲醇浓度大于2%以后,菌体生长和外源蛋白生产均受到明显的抑制。
本研究采用ATR-FTIR能够快速准确对发酵过程中甘油和甲醇浓度做出预测,成功应用于毕赤酵母的发酵调控,有效指导人溶菌酶的生产。但是该方法也存在一定不足,如定量模型的建立需要较多的样品数,取样频繁造成发酵液体积的减少等。随着在位ATR探头的出现,在生产应用中能够做到实时在线测量,这将符合实际过程中的情况,FTIR技术将会在生物过程监测领域中得到广泛的应用。
[1] Curvers S,Linnemann J,Klauser T,et al.Recombinant protein production with Pichia pastoris in continuous fermentation-kinetic analysis of growth and product formation[J].Engineering in Life Sciences,2002,2(8):229-235.
[2] Macauley-Patrick S,Fazenda M L,McNeil B,et al.Heterologous protein production using the Pichia pastoris Expression System[J].Yeast,2005,22(4):249-270.
[3] Cregg J M,Cereghino J L,Shi J,et al.Recombinant protein expression in Pichia pastoris[J].Molecular Biotechnology,2000,16(1):23-52.
[4] Gao M J,Zheng Z Y,Wu J R,et al.Improvement of specific growth rate of Pichia pastoris for effective porcine interferon-α production with an on-Line model-based glycerol feeding strategy[J].Applied Microbiology and Biotechnology,2012,93(4):1 437-1 445.
[5] Daly R,Hearn M T W.Expression of heterologous proteins in Pichia pastoris:a useful experimental tool in protein engineering and production[J].Journal of Molecular Recognition,2005,18(2):119-138.
[6] Zhang W,Bevins M A,PLantz B A,et al.Modeling Pichia pastoris growth on methanol and optimizing the production of a recombinant protein,the heavy-chain fragment C of botulinum neurotoxin,serotype A[J].Papers in Biotechnology,2000:18.
[7] Crowley J,McCarthy B,Nunn N S,et al.Monitoring a recombinant Pichia pastoris fed batch process using Fourier transform mid-infrared spectroscopy(FT-MIRS)[J].Biotechnology Letters,2000,22(24):1 907-1 912.
[8] Roychoudhury P,Harvey L M,McNeil B.The potential of mid infrared spectroscopy(MIRS)for real time bioprocess monitoring[J].Analytica Chimica Acta,2006,571(2):159-166.
[9] Landgrebe D,Haake C,Höpfner T,et al.On-Line infrared spectroscopy for bioprocess monitoring[J].Applied Microbiology and Biotechnology,2010,88(1):11-22.
[10] 李润卿.有机结构波谱学[M].天津:天津大学出版社,2002:145-151.
[11] Schenk J,Marison I W,von Stockar U.A simple method to monitor and control methanol feeding of Pichia pastoris fermentations using mid-IR spectroscopy[J].Journal of Biotechnology,2007,128(2):344-353.
[12] Dahlbacka J,Weegar J,von Weymarn N,et al.On-Line measurement of the substrate concentrations in Pichia pastoris fermentations using FT-IR/ATR[J].Biotechnology Letters,2012,34(6):1 009-1 017.
[13] Dahlbacka J,Kiviharju K,Eerikäinen T,et al.Monitoring of Streptomyces peucetius cultivations using FTIR/ATR spectroscopy and quantitative models based on Library type data[J].Biotechnology Letters,2013:35(3):337-343.
[14] Cozzolino D,Curtin C.The use of attenuated total reflectance as tool to monitor the time course of fermentation in wild ferments[J].Food Control,2012,26(2):241-246.
[15] Rathore A S,Bhushan N,Hadpe S.Chemometrics applications in biotech processes:a review[J].Biotechnology Progress,2011,27(2):307-315.
[16] Wold S,Sjöström M,Eriksson L.PLS-regression:a basic tool of chemometrics[J].Chemometrics and Intelligent Laboratory Systems,2001,58(2):109-130.
[17] Pistorius A,Degrip W J,Egorova-Zachernyuk T A.Monitoring ofbiomasscomposition from microbiological sources by means of FT ‐ IR spectroscopy[J].Biotechnology and Bioengineering,2009,103(1):123-129.
[18] Muller J,Neumann M,Scholl P,et al.Online monitoring of biotransformations in high viscous multiphase systems by means of FT-IR and chemometrics[J].Analytical Chemistry,2010,82(14):6 008-6 014.
[19] Roychoudhury P,Harvey L M,McNeil B.At-Line monitoring of ammonium,glucose,methyl oleate and biomass in a complex antibiotic fermentation process using attenuated total reflectance-mid-infrared(ATR-MIR)spectroscopy[J].Analytica Chimica Acta,2006,561(1):218-224.
[20] Kornmann H,Valentinotti S,Duboc P,et al.Monitoring and control of Gluconacetobacter xylinus fed-batch cultures using in situ mid-IR spectroscopy[J].Journal of Biotechnology,2004,113(1):231-245.
[21] Kansiz M,Billman-Jacobe H,McNaughton D.Quantitative determination of the biodegradable polymer poly(βhydroxybutyrate)in a recombinant Escherichia coli strain by use of mid-infrared spectroscopy and multivariative statistics[J].Applied and Environmental Microbiology,2000,66(8):3 415-3 420.
[22] Cervera A E,Petersen N,Lantz A E,et al.Application of near-infrared spectroscopy for monitoring and control of cell culture and fermentation[J].Biotechnology Progress,2009,25(6):1 561-1 581.

