大黄素对增生性瘢痕成纤维细胞的作用*
刘漪沦,邓峰美,刘卫华,罗永慧,赵宁宁,刘海荣,刘月明,王航宇
(1.成都医学院第一附属医院烧伤整形外科,成都 610500;2.成都医学院病理学与病理生理学教研室,成都 610500;3.成都医学院第一附属医院科研实验中心,成都 610500;4.石河子大学药学院,石河子 832002;5.教育部新疆特种植物药资源重点实验室,石河子 832002)
·皮肤性病药物专栏·
大黄素对增生性瘢痕成纤维细胞的作用*
刘漪沦1,邓峰美2,刘卫华3,罗永慧1,赵宁宁1,刘海荣3,刘月明1,王航宇4,5
(1.成都医学院第一附属医院烧伤整形外科,成都 610500;2.成都医学院病理学与病理生理学教研室,成都 610500;3.成都医学院第一附属医院科研实验中心,成都 610500;4.石河子大学药学院,石河子 832002;5.教育部新疆特种植物药资源重点实验室,石河子 832002)
目的 探讨大黄素对增生性瘢痕成纤维细胞(HSFs)的作用及其机制。方法分别以终浓度为0,20,40, 80μmol·L-1的大黄素处理HSFs,以MTS法检测细胞活力,以Annexin V、碘化丙啶双染法行流式细胞仪检测,以Western blot法检测细胞外信号调节激酶1/2(ERK1/2)及其磷酸化蛋白、B淋巴细胞瘤-2(Bcl-2)、髓样细胞白血病-1(Mcl-1)、受体相互作用蛋白激酶1(RIP1)的表达。结果大黄素对HSFs的增殖活力有抑制作用,且呈剂量依赖性;HSFs在终浓度为40,80μmol·L-1大黄素作用48 h后死亡率分别为28.6%,68.0%(P<0.01),以泛caspase抑制药Z-VAD-FMK预处理能够部分降低大黄素所致细胞死亡率(P<0.05);大黄素能够抑制ERK磷酸化、Mcl-1和RIP1的表达。结论大黄素能够抑制HSFs的增殖活力、诱导细胞死亡,其机制可能与其抑制ERK1/2磷酸化及Mcl-1、RIP1蛋白表达有关。
大黄素;瘢痕,增生性;成纤维细胞;细胞死亡
增生性瘢痕是创伤后组织过度修复的表现,瘢痕发生的机制至今不明确。临床上治疗有效的药物主要有糖皮质激素、抗肿瘤药等,但疗效欠佳。从中草药中筛选出疗效确切、副作用小的抑制增生性瘢痕成纤维细胞增殖的有效药物,具有较大的临床应用价值。中药治疗增生性瘢痕有悠久的历史。多种中药成分能够在体内或体外模型中抑制瘢痕成纤维细胞的增殖及分泌功能,但多数软坚散结中药的药效成分不明确[1-2]。大黄素(emodin)是多种植物根茎中含有的天然蒽醌衍生物,具有酪氨酸激酶抑制的作用,在一些肿瘤细胞中能够抑制胞外信号调节激酶(extracellular signal regulated kinase,ERK)磷酸化,抑制肿瘤细胞增殖,诱导凋亡[3-4]。研究发现大黄素对增生性瘢痕成纤维细胞(hypertrophic scar fibroblasts,HSFs)的增殖具有一定抑制作用[5],但机制尚不明确。因此笔者在本实验中探讨大黄素对HSFs的作用及其机制。
1 材料与方法
1.1 材料 达尔伯克改良伊格尔培养液(Dulbecco's modified Eagle's medium,DMEM)、胎牛血清、胰蛋白酶、二甲亚砜(dimethylsulfoxide,DMSO)、Ⅰ型胶原酶、G418购自美国Gibco公司(批号依次为1255136, 1551835,1374941,1243389,1387741,1444515),中性蛋白酶DispaseⅡ购自Roche公司(批号: 04942078001),大黄素购自Sigma公司(批号:E7881,质量分数>98%),Z-VAD-FMK(Z-VAD)购自Promega公司(批号:G7231),Annexin V-FITC、碘化丙啶(propidium iodide,PI)凋亡检测试剂盒购自美国BD公司(批号:556547),细胞外信号调节激酶1/2 (extracellular signal-regulated kinase1/2,ERK1/2)及其磷酸化蛋白p-ERK1/2、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)的单克隆抗体购自Cell Signaling公司(批号:9107,4370,2876),髓样细胞白血病-1 (myeloid cell leukemia-1,Mcl-1)单克隆抗体购自Abcam公司(批号:ab32087),受体相互作用蛋白激酶1(receptor-interacting protein1,RIP1)多克隆抗体购自Santa Cruz公司(批号:sc-7881)。化学发光成像分析系统为日本FUJIFILM公司FUJIFILM LAS-4000,流式细胞仪为美国BD公司AccuriTMC6系统。
1.2 增生性瘢痕成纤维细胞分离培养与实验分组 经医院伦理道德与科研委员会批准,患者知情同意后选取深Ⅱ度烧伤后增生性瘢痕患者5例,均为汉族,其中男3例,女2例,年龄23~55岁,均无结缔组织疾病及心、肺、肝、肾脏等慢性疾病,未使用过类固醇激素类药物、抗肿瘤药物,未接受过放疗,伤后3~8个月在我院行瘢痕切除与修复术。瘢痕处于增生期,外观发红充血、质硬、高于皮面>1 cm,表面无破溃,瘢痕局限于皮损区,局部瘙痒。标本取自颈、胸、手部的增生性瘢痕组织,经病理学确诊。以0.1 mol·L-1磷酸盐缓冲液(phosphate buffered solution,PBS)将标本洗涤干净,将组织块修剪为0.5 cm×0.5 cm×0.5 cm大小,浸泡于0.25%DispaseⅡ中,置于37℃恒温摇床2 h;然后将组织块转入培养皿中,用0.1 mol·L-1PBS洗涤3次,小心剥去表皮,反复洗涤真皮,再用眼科剪将其充分剪碎,约1 mm3大小,接种于培养瓶内,在二氧化碳(CO2)孵箱中培养4~5 h,使其较牢固地粘附于瓶壁,随后加入含10%FBS的DMEM液,继续培养,每3 d进行1次换液,待原代细胞生长成单层融合后,按1∶2或1∶3的比例分瓶传代。实验时应用第4~6代细胞。根据培养液中加入大黄素的终浓度,设0μmol·L-1(对照组)、20μmol·L-1组、40μmol·L-1组和80μmol·L-1组,同时在进行流式检测时,设立泛caspase抑制药Z-VAD-FMK预处理组,在加入不同浓度大黄素之前1 h加入终浓度为20μmol·L-1的ZVAD-FMK。
1.3 检测指标
1.3.1 细胞活力检测 将对数生长期的HSFs以每孔5 000个接种于96孔板,24 h后按上述分组进行换液加药处理,48 h后每孔加入MTS溶液20μL,继续培养4 h后在酶标仪上测定490 nm吸光度值,并计算相对细胞活力值(样品吸光度值/对照吸光度值× 100%)。
1.3.2 细胞死亡检测 采用流式细胞仪,以Annexin V、PI双染法对细胞进行检测。选择对数生长期的细胞,以1×105个·mL-1接种于24孔板,每组设复孔3个,24 h后换液,加入药物处理,48 h后胰酶消化获取细胞,移入流式管中,1 500 r·min-1(r=15 cm)离心5 min,弃上清液,预冷PBS每管1 mL洗涤2次,结合缓冲液每管1 mL洗涤1次,每次均1 500 r·min-1(r= 15 cm)离心5 min,结合缓冲液100μL重悬细胞,依次加入Annexin V、PI各5μL,震荡混匀,静置15min后加入400μL结合缓冲液,1 h内完成流式检测。
1.3.3 Western blot法检测细胞蛋白的表达 各组细胞分别以4×105个接种于6孔板,24 h后胰酶消化,收集细胞于离心管中,预冷PBS洗2次,弃上清液,加入细胞裂解液,冰上孵育30 min,期间震荡3次, 13 000 r·min-1(r=8 cm)离心30 min,取上清液进行蛋白定量,每样本取30μg总蛋白量在分离胶浓度为10%的条件下进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)117 V 90~110 min,转膜50 V 90 min,转印后的PVDF膜以5%脱脂牛奶封闭液室温封闭2 h,一抗4℃孵育过夜,含聚山梨酯-20的Tris盐缓冲液(tris buffered saline with tween-20,TBST)洗膜3次,每次20 min,二抗孵育2 h,TBST洗膜3次,每次20 min,化学发光反应液孵育4 min,透明薄膜密封,以FUJIFILM LAS-4000成像系统进行曝光及定量检测。
1.4 统计学方法 应用SPSS16.0版统计软件进行分析,计量数据以均数±标准差(±s)表示,多组间均数比较采用单因素方差分析,组间两两比较采用q检验,P<0.05为差异有统计学意义。
2 结果
2.1 大黄素对HSFs细胞活力的影响 在终浓度为0 (对照组),20,40及80μmol·L-1大黄素作用下,HSFs相对细胞活力呈现逐渐下降趋势,其中,大黄素40,80 μmol·L-1组细胞活力下降较为显著,分别下降达45.2%,79.0%(P<0.05)。见图1。

图1 大黄素对增生性瘢痕成纤维细胞活力的影响Fig.1 Effect of emodin on cell viability of HSFs
2.2 大黄素对HSFs细胞死亡的诱导作用 流式细胞仪Annexin V、PI双染检测的结果显示,HSFs在终浓度为40,80μmol·L-1大黄素48 h作用下死亡率分别为28.6%,68.0%,高于对照组(P<0.01),而20μmol·L-1大黄素对HSFs的影响与对照组相比差异无统计学意义。20μmol·L-1Z-VAD-FMK对HSFs的影响同对照组相比,差异无统计学意义;Z-VAD-FMK预处理能够部分降低大黄素(40,80μmol·L-1组)所致的死亡率(P<0.05)。流式细胞点阵图显示,大黄素40,80μmol·L-1组细胞的死亡,小部分为AnnexinV阳性,提示为早期凋亡;大部分为Annexin V、PI双阳性,一般认为其存在晚期凋亡或坏死等模式。见图2。
2.3 大黄素对HSFs ERK1/2磷酸化的作用 Western blot检测结果显示,在终浓度为0,20,40, 80μmol·L-1大黄素作用下,ERK1/2的表达无变化, p-ERK1/2的表达出现递减,蛋白水平依次下降达80.0%(P<0.01)。见图3。
2.4 大黄素对HSFs Bcl-2、Mcl-1及RIP1的影响 Bcl-2的表达在不同浓度大黄素作用下没有显示出明显的变化趋势,而Mcl-1的表达在大黄素(20,40, 80μmol·L-1组)作用下明显减弱,下降均超过50.0% (P<0.01),但没有出现线性的趋势。RIP1的表达随着大黄素浓度的增加而逐渐减少,其中,80μmol·L-1组下降超过60.0%(P<0.01)。见图4。
3 讨论

图2 Z-VAD-FM K部分抑制大黄素诱导的增生性瘢痕成纤维细胞死亡A.流式细胞仪点阵图,M即mol·L-1;B.细胞死亡率分析;与大黄素0μmol·L-1组比较,*1P<0.01;与相应无Z-VAD-FMK组比较,*2P<0.05Fig.2 Partial inhibition of Z-VAD-FMK on emodin-induced cell death of HSFsA.representative flow cytometry dot plots,M(mol·L-1);B.summary data demonstrating analysis of cell death following a 48 h exposure to the indicated drugs;compared with emodin 0μmol·L-1group,*1P<0.01;compared with non-Z-VAD-FMK group respectively,*2P<0.05
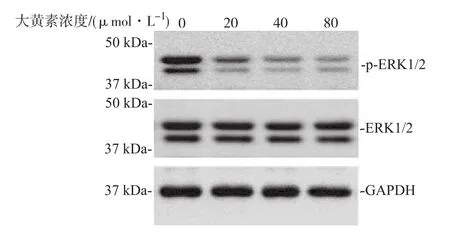
图3 大黄素对增生性瘢痕成纤维细胞ERK1/2磷酸化的影响Fig.3 Effect of emodin on ERK 1/2 phosphorylation of HSFs

图4 大黄素对增生性瘢痕成纤维细胞Bcl-2、M cl-1与RIP1表达的影响Fig.4 Effect of em odin on the expression of Bcl-2,M cl-1 and RIP1 of HSFs
大黄素(1,3,8-三羟基-6-甲基)是大黄、虎杖、何首乌、望江南、砂仁及百合等多种中药中存在的有效成分,分子式为C15H10O5,相对分子质量为270.24。在增生性瘢痕的研究方面,夏珊等[5]发现大黄素能够阻滞人增生性瘢痕成纤维细胞的细胞周期、抑制细胞增殖,并且促进细胞凋亡,其改变细胞增殖/凋亡的机制可能与细胞内钙离子(Ca2+)超载有关。作为一种酪氨酸激酶抑制药,大黄素已被发现能够抑制ERK1/2磷酸化而发挥抑制多种肿瘤细胞增殖活力的作用,那么其对HSFs是否也存在相应的抑制作用呢?ERK1/2磷酸化,主要通过Ras/Raf/MEK/ERK这一通路来进行,而后者是细胞维持活力、保持增殖稳态的重要环节[6]。若抑制此通路,可抑制细胞生长,最终导致细胞死亡;而过度激活此通路,则可刺激细胞增殖、转化甚至癌变。本研究表明,大黄素对增生性瘢痕成纤维细胞ERK1/2磷酸化具有抑制作用,且呈剂量依赖性;另外,与夏珊等[5]研究一致,笔者发现大黄素对HSFs的活力抑制亦存在剂量依赖性。表明大黄素对HSFs的抑制可能与其抑制ERK1/2磷酸化水平有关。
大黄素在化学结构上和多柔比星、柔红霉素等抗癌药物一样,同属于蒽醌类化合物,对某些肿瘤细胞系如肺癌细胞、肝癌细胞等,具有一定的诱导凋亡的作用[7-9],结合上述大黄素在抑制ERK1/2磷酸化方面的作用,笔者认为大黄素对细胞死亡的诱导是一个复杂的多种机制并存的体系。细胞的程序性死亡是目前人们较为关注的方向,包括凋亡、程序性坏死等。本研究一方面通过PI、Annexin V双染法初步判断细胞早期凋亡或坏死的情况,同时应用泛caspase抑制药-Z-VADFMK,一种凋亡抑制剂[10],进一步分析细胞死亡的形式;另一方面,笔者选择Bcl-2、Mcl-1这两个常见的抗凋亡蛋白以及RIP1这一与细胞程序性坏死相关的蛋白进行检测,初步探讨大黄素诱导HSFs死亡过程可能的机制。结果表明,大黄素所致的死亡细胞中,小部分呈Annexin V阳性,提示其早期凋亡,而大部分为PI、Annexin V双阳性,认为存在晚期凋亡或坏死等可能[11-13]。而Z-VAD-FMK对大黄素组细胞进行预处理,在40和80μmol·L-1组,均部分阻断细胞的死亡。这两方面证据提示大黄素导致的细胞死亡不仅仅只有细胞凋亡,还包含其他死亡模式。
Bcl-2与Mcl-1是Bcl-2家族的成员,具有抗凋亡的作用[14-15]。在本实验中,大黄素对增生性瘢痕成纤维细胞Mcl-1的表达起到抑制作用,而对Bcl-2的表达并没有表现出有意义的调控作用,提示大黄素对增生性瘢痕成纤维细胞的凋亡诱导可能与Mcl-1的调控有关。在本实验中大黄素对增生性瘢痕成纤维细胞Mcl-1表达的抑制无剂量依赖的关系,可能是由于大黄素作用浓度的范围或者是其他因素造成,需要进一步证实。
RIP1是一类丝氨酸/苏氨酸蛋白激酶,在细胞存活及细胞程序性坏死等信号传导中起重要作用,研究发现,RIP1是决定细胞生死的重要节点[16]。在本实验中,增生性瘢痕成纤维细胞RIP1的表达,在大黄素的作用下表现出剂量依赖性的抑制,提示大黄素对增生性瘢痕成纤维细胞的死亡诱导作用与RIP1的改变具有一定关联,这对今后研究大黄素的作用具有很大的启发。另外,p-ERK1/2与RIP1的变化呈现相同的剂量依赖性趋势,它们之间存在什么样的调控关系值得进一步研究。
[1] TANG B,ZHU B,LIANG Y,et al.Asiaticoside suppresses collagen expression and TGF-β/Smad signaling through inducing Smad7 and inhibiting TGF-βRI and TGF-βRII in keloid fibroblasts[J].Arch Dermatol Res,2011,303(8): 563-572.
[2] WU J G,WEI Y J,RAN X,et al.Inhibitory effects of essential oil from rhizomes of Ligusticumchuangxiongon hypertrophic scarring in the rabbit ear model[J].Pharm Biol,2011,49(7):764-769.
[3] SRINIVASG,BABYKUTTY S,SATHIADEVAN P P,et al. Molecular mechanism of emodin action:transition from laxative ingredient to an antitumor agent[J].Med Res Rev, 2007,27(5):591-608.
[4] ZHOU X,SONG B,JIN L,et al.Isolation and inhibitory activity against ERK phosphorylation of hydroxyanthraquinones from rhubarb[J].Bioorg Med Chem Lett, 2006,16(3):563-568.
[5] 夏珊,李世荣,刘剑毅,等.大黄素对人增生性瘢痕成纤维细胞的增殖抑制及细胞内游离Ca2+的作用[J].第三军医大学学报,2007,29(20):1982-1984.
[6] MCCUBREY JA,STEELMAN L S,CHAPPELLW H,et al. Ras/Raf/MEK/ERK and PI3K/PTEN/Akt/mTOR cascade inhibitors:how mutations can result in therapy resistance and how to overcome resistance[J].Oncotarget,2012,3 (10):1068-1111.
[7] 丁艳,黄志华.大黄素的抗肿瘤作用研究进展[J].时珍国医国药,2008,19(5):1272-1273.
[8] LEE H Z.Effects and mechanisms of emodin on cell death in human lung squamous cell carcinoma[J].Br J Pharmacol,2001,134(1):11-20.
[9] MA Y S,WENG SW,LIN M W,et al.Antitumor effects of emodin on LS1034 human colon cancer cellsin vitroandin vivo:roles of apoptotic cell death and LS1034 tumor xenograftsmodel[J].Food Chem Toxicol,2012,50(5): 1271-1278.
[10] EKERT PG,SILKE J,VAUX D L.Caspase inhibitors[J]. Cell Death Differ,1999,6(11):1081-1086.
[11] GALLUZZI L,MAIURIM C,VITALE I,et al.Cell death modalities:classification and pathophysiological implications[J].Cell Death Differ,2007,14(7):1237-1243.
[12] KROEMER G,GALLUZZI L,VANDENABEELE P,et al. Classification of cell death:recommendations of the Nomenclature Committee on Cell Death 2009[J].Cell Death Differ,2009,16(1):3-11.
[13] GALLUZZI L,VITALE I,ABRAMS JM,et al.Molecular definitions of cell death subroutines:recommendations of the Nomenclature Committee on Cell Death 2012[J].Cell Death Differ,2012,19(1):107-120.
[14] MARSDEN V S,O'CONNOR L,O'REILLY L A,et al. Apoptosis initiated by Bcl-2-regulated caspase activation independently of the cytochrome c/Apaf-1/caspase-9 apoptosome[J].Nature,2002,419(6907):634-637.
[15] YAO H,MIS,GONGW,et al.Anti-apoptosis proteins Mcl-1 and Bcl-xL have different p53-binding profiles[J]. Biochemistry,2013,52(37):6324-6334.
[16] DECLERCQW,VANDEN BERGHE T,VANDENABEELE P.RIP kinases at the crossroads of cell death and survival [J].Cell,2009,138(2):229-232.
DOI 10.3870/yydb.2014.12.007
Effect of Emodin on Hypertrophic Scar Fibroblasts
LIU Yi-lun1,DENG Feng-mei2,LIUWei-hua3,LUO Yong-hui1,ZHAO Ning-ning1,LIU Hai-rong3,LIU Yueming1,WANG Hang-yu4,5
(1.Department of Burns and Plastic Surgery,the First Affiliated Hospital of Chengdu Medical College,Chengdu 610500,China;2.Department of Pathology,Chengdu Medical College,Chengdu 610500,China;3.Experiment Research Center,the First Affiliated Hospital of Chengdu Medical College, Chengdu 610500,China;4.School ofPharmacy,Shihezi University,Shihezi 832002,China;5.Key Laboratory of Phytomedicine Resources&Modernization of TCM,Shihezi 832002,China)
Objective To investigate the effect of emodin on hypertrophic scar fibroblasts(HSFs)and explore the underlyingmechanism.MethodsHSFs were treated by emodin at final concentrations of 0,20,40,and 80μmol·L-1, respectively,in the culturalmedia.Forty-eight hours later,the cells were subjected to MTS assay and flow cytometry assay with annexin V and propidium iodide as dyeing indicators.Whole cell lysates from the cells of every group were subjected to Western blotting tomeasure the protein expression levels of ERK1/2,Bcl-2,Mcl-1 and RIP1.ResultsThe cell viability of HSFs was inhibited by emodin in a dose dependentmanner.Themortality rate of HSFs treated with emodin for48 h at the concentrations of 40 and 80μmol·L-1were 28.6%and 68.0%,respectively,which was significantly higher than that of the control group(P<0.01).Pretreatmentwith Z-VAD-FMK could partially reduce the mortality caused by emodin(P<0.05).Phosphorylation of ERK1/2 and the expression of RIP1 and Mcl-1 were inhibited by emodin.ConclusionDown regulation of ERK1/2,RIP1 and Mcl-1 by emodin may account for the inhibited proliferation and increased cell death of HSFs.
Emodin;Scar,hypertrophic;Fibroblast;Cell death
R285.6;R619.6
A
1004-0781(2014)12-1566-05
2014-06-23
2014-08-13
*国家自然科学基金资助面上项目( 30672175);四川省卫生厅科研项目(100103);成都医学院第一附属医院烧伤外科学四川省医学重点学科专项科研基金资助项目(SSZDXK-001)
刘漪沦(1972-),男,安徽霍邱人,副主任医师,副教授,硕士,研究方向:瘢痕防治与组织再生。电话:(0) 18227672279,E-mail:thirdforce@163.com。
王航宇(1968-),男,新疆石河子人,副教授,硕士,研究方向:中药和天然药物研究。电话:(0)18909932852, E-mail:18909932852@189.cn。

