海参内脏组成成分结构、功能及其应用研究进展
张永勤,常海燕
(青岛科技大学化工学院,山东青岛266042)
海参作为珍贵的海珍品之一,迄今已发现海参体内含有多种生理活性成分,具有极高的食疗价值。并且由于海参肉质柔软,营养丰富,是典型的低脂肪、高蛋白、重铁质、低胆固醇的食物,明代以后,海参收入本草,列为补益药[1]。因此,在我国一向被视为佐膳佳肴和营养滋补食品,被列为“八珍之一”。近年来由于海参的药用价值及食用价值的日益显现,消费者对海参的需求与日俱增,且从国内波及至海外沿海各国,目前世界范围内供普遍捕捞或养殖的海参品种已达66种,2008年世界干海参产量已达2万t以上,70多个国家投入到海参产业[2],海参产量增势迅猛。
然而,在产业化的进程中,海参内脏往往作为海参加工的废弃物,造成极大的资源浪费和环境污染。同时,国内外科研机构运用相关技术对海参内脏的生理与生化、海参内脏中营养物质、活性物质的分离鉴定以及生物医学作用等进行了不断深入的研究,发现海参内脏中含有海参粘多糖、海参皂苷、活性肽、各种活性酶类等多种物质,具有抗肿瘤、抗氧化、降血脂等作用的生物活性。本文将对海参内脏的结构及其活性成分的最新研究进展进行论述,为海参内脏进行新药及功能性食品的深度开发提供依据。
1 海参内脏的结构
海参内脏包括消化道、生殖腺、呼吸树、居维氏管、水肺、波里氏囊、水环管、触手以及筛板等,如图1所示。海参的消化道,即海参肠壁,是海参内脏的重要组成部分,按照位置的差异以及形状的不同,海参肠壁可被分为三段:前、中、后。前部有较大囊结构的咽、食管和胃以及前降肠,颜色最深;中部为前升肠,颜色逐渐变浅,而且变细,内壁常形成环形褶皱;后部为后降肠和排泄腔,肠壁明显变薄,颜色最浅,内壁成高而窄的褶皱,是海参主要的消化和吸收的场所[4]。海参肠壁从组织学上可以划分为体腔上皮层、外部结缔组织层、肌肉层、内部结缔组织层和靠近体腔的内层。此外,海参在受到强烈刺激或者处于不良环境,如:遇到敌害、水质污染、过度拥挤等,会通过强烈收缩身体将内脏包括消化道、生殖腺、呼吸树、以及居维氏管甚至是全部内脏由肛门排到体外,然后启动内脏再生机制[5]。
2 海参内脏的组成成分
2.1 海参多糖
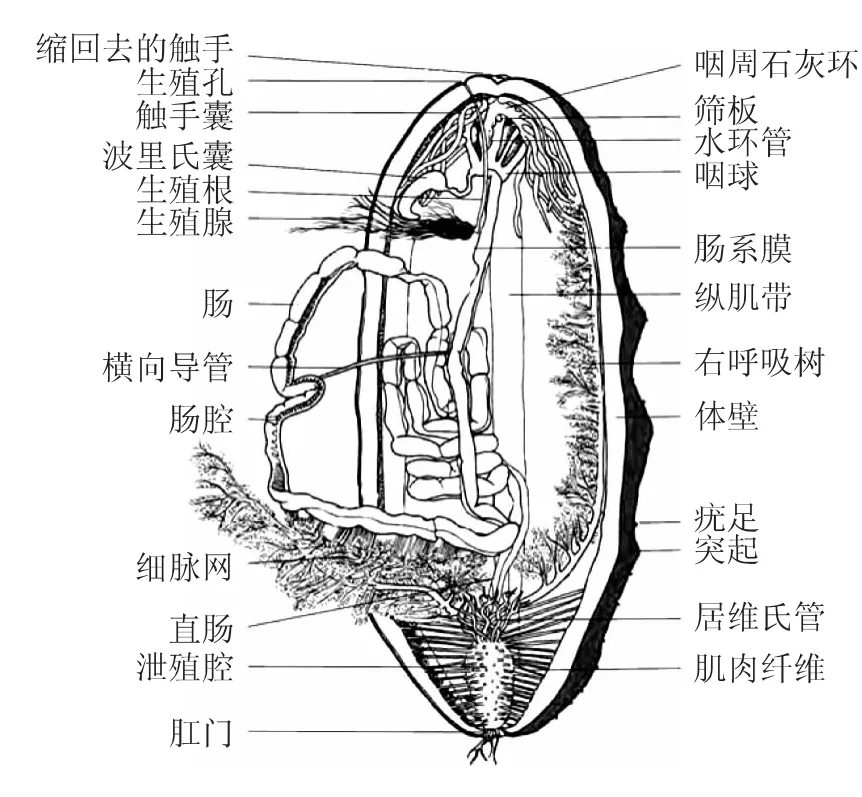
图1 海参结构简图[3]Fig.1 Schematic structure of sea cucumber[3]
海参多糖主要存在于肠壁、呼吸树[6]、卵细胞以及精细胞[7]。其中肠壁多糖主要由氨基糖醛酸、氨基半乳糖和岩藻糖组成,并含有少量的氨基葡萄糖,半乳糖,以及微量的甘露糖和阿拉伯糖。岩藻糖存在α和β两种构型,以α-岩藻糖硫酸酯残基、β-岩藻糖硫酸酯残基形式存在,为一种酸性粘多糖[8-10]。
海参多糖具有多种药理学作用,如抗氧化:在测定消化道中多糖及酯化多糖清除羟自由基和超氧阴离子自由基能力时发现,肠壁多糖表现出了一定的抗氧化能力,并有一定的浓度依赖性,其清除羟自由基能力以及超氧阴离子自由基的能力大于体壁多糖[11];抗肿瘤:仿刺参肠多糖对H22肿瘤具有剂量依赖性的抑制作用,且高剂量组(400mg/kg/d)肿瘤抑制效果最好。高剂量组能显著地提高荷瘤小鼠和空白组小鼠中白介素的含量,同时也能提升荷瘤小鼠的肿瘤坏死因子的含量[12];降血脂:对喂养了五周肠壁多糖的小鼠眼球取血,测定其血清中甘油三酯、低密度脂蛋白胆固醇、总的胆固醇、高密度脂蛋白胆固醇的含量,结果表明高中低剂量均能很显著的降低高脂血症小鼠的甘油三酯、低密度脂蛋白胆固醇、总胆固醇的水平,提高动脉硬化指数以及高密度脂蛋白胆固醇值,显示海参消化道多糖具有降血脂作用[13]。
2.2 海参皂苷
海参皂苷,又称海参素,是海参的主要次生代谢产物,肠壁中皂苷含量约为其湿重的1.03%,呼吸树的含量为1.65%,均明显高于体壁皂苷(0.37%)[6],肠壁皂苷是由苷元和糖链通过β-糖苷键结合而成的,苷元常为四环三萜和五环三萜,其糖部分一般含有木糖、葡萄糖、奎诺糖、3-O-甲基葡萄糖和3-O-甲基木糖[14]。并且在某些糖链的特定位置上还含有硫酸基团[13]。刺参的居维氏管中所含有的皂苷有26种同分异构体,结构已确定的有16种[15],如图2所示,其主要骨架为A、B,并且每一种都有两种取代基R1和R2,其中,R1存在的形式有两种H或OH,R2存在的形式有四种。此外在黑海参、玉足海参、菲律宾刺参、棘辐肛参、Bohadschia subrubra中又分别发现了4、6、8、10、19 种皂苷的同分异构体,且这些皂苷均具有溶血能力[16]。海参皂苷作为海参防御外界不良环境所产生的代谢产物,从某种程度上也间接地保护了它自身的寄生生物[17]。
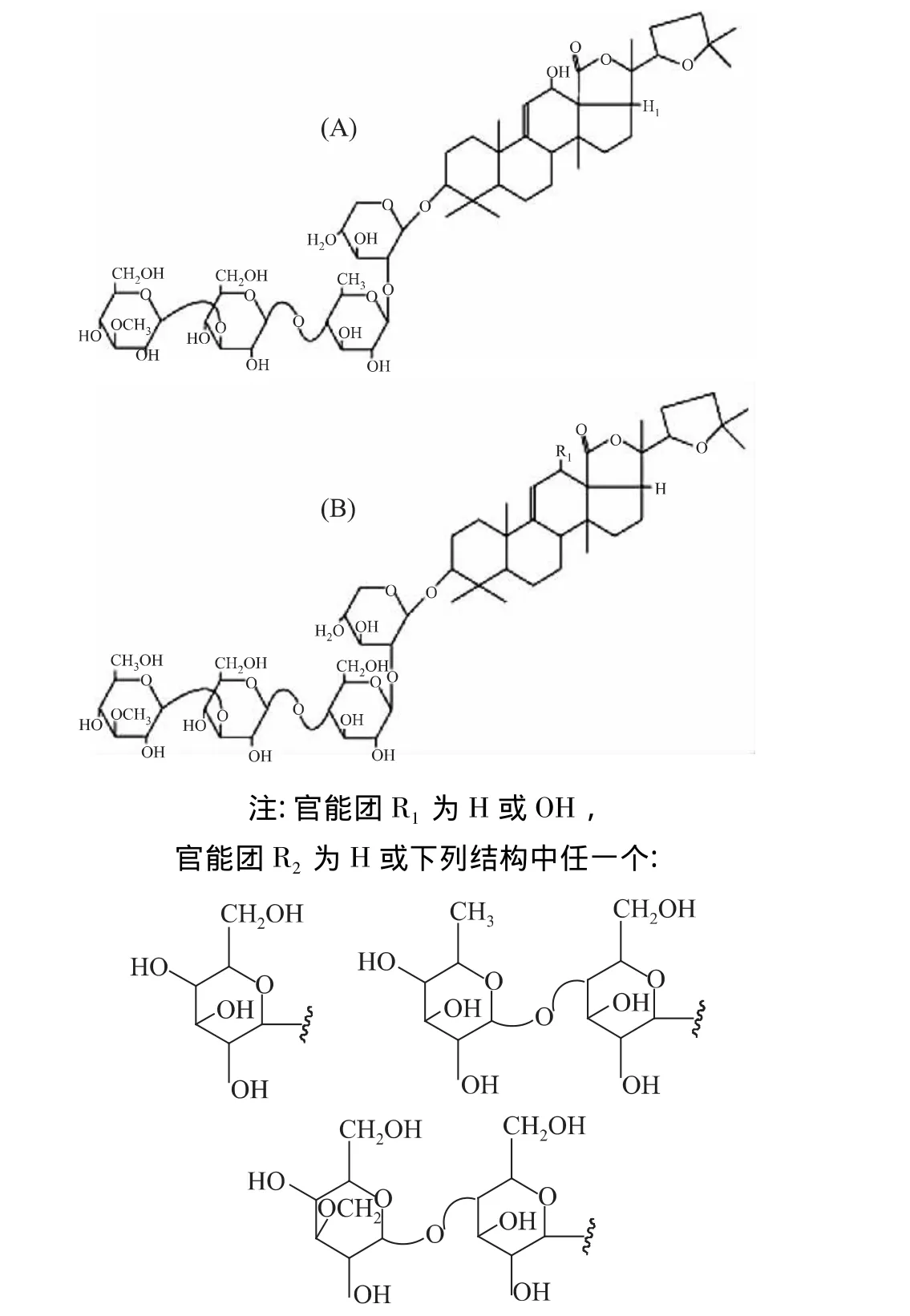
图2 居维氏管中16种同分异构体的结构式Fig.2 Molecular structures of saponins detected in the Cuvierian tubules extracts of Holothuria forskali
2.3 蛋白质及氨基酸
蛋白质是海参内脏的重要组成部分[6-7]。其各部位所含有的氨基酸种类比较齐全,其中,游离氨基酸中亮氨酸的含量较高[18];结合氨基酸中谷氨酸的含量较高[6]。必需氨基酸的含量约占总含量的17%,赖氨酸作为第一限制性氨基酸在8种必需氨基酸中含量最高,且高于体壁。此外,海参肠壁中还含有体壁没有的牛磺酸,其含量高于牡蛎肉、马氏珠母贝肉中牛磺酸的含量[19],牛磺酸是一种带有磺酸基的特殊的条件必需氨基酸,它以游离状态富含于兴奋组织(神经、肌肉)细胞内,对糖尿病病人的神经病变、胰岛素抵抗及心血管并发症具有显著防治作用[6]。
海参肠壁是海参用于消化吸收食物的重要器官,含有多种消化酶类[20],如多糖水解酶类(β-1,3-葡聚糖酶[21]、纤维素酶、淀粉酶[22]、壳聚糖酶[23]、麦芽糖酶、蔗糖酶[24],溶菌酶[25])、蛋白酶类(组织蛋白酶 B[26]、组 织 蛋 白 酶 L[27]、胃 蛋 白 酶、胰 蛋 白酶[28])、碱性磷酸酶[29]和催化生物体内神经传导的乙酰胆碱酯酶[30]等。
2.4 脂肪及脂肪酸
海参肠壁、呼吸树中的脂肪含量分别为湿重的11.36%、8.94%。肠壁中含有14种脂肪酸,不饱和脂肪酸占了70%,明显高于体壁中不饱和脂肪酸的含量(54.2%)[6],更高于多不饱和脂肪酸含量较高的南极磷虾(47.98%)、黄鳍河豚(37.91%)、三文鱼、栉孔扇贝等[31]。其中,肠壁中的二十碳五烯酸(EPA,24.4%)以及二十二碳五烯酸(DPA,5.6%)等均高于海参体壁的含量(EPA,9.4%;DPA,1.7%)。然而,在海参肠壁和呼吸树中并未检测到DHA的存在[6]。
2.5 酚与黄酮类
海参肠壁、呼吸树、性腺的提取液均具有较高的抗氧化活性,以肠壁提取液为最高,可达800μmol TE/g。其活性虽比不过葡萄籽和葡萄皮,但高于一般的蔬菜、水果以及其它药草或烹调用植物。其活性成分与性腺中的酚类化合物显著相关,与上述各部位中的黄酮类物质呈明显相关[32]。尽管酚类化合物在海参内脏中的含量并不高,但在抗氧化活性中所占的比重不容小觑。
2.6 微量元素
海参内脏中含有较为丰富的无机元素,如必需微量元素铁、硒、锌、钒等,其含量普遍高于海胆、鱼翅、鲍鱼等海洋水产食品原料。由于海参生活习性的特殊性,Hg、Cu、As、Pb等有害元素的含量要稍低于贝类,其中,钒在内脏中的含量可以达到18.48mg/kg,约为体壁的五倍,钒在糖代谢以及降低三酰甘油和胆固醇等方面发挥着重要的作用,从而推测其在海参脂质代谢以及糖代谢方面有一定的调节作用[33]。肠壁中As的含量为12mg/kg,比性腺高出三倍,且基本上以无毒状态存在于海参中[34]。
2.7 菌类
存在于海参呼吸树中的棒状杆菌(Corynebacterium sp.),对于胶原蛋白有一定的分解能力,且耐高温,是一种优势腐败菌;而存在于海参消化道中的有毒威克斯菌(Weeksella virose Holmes),是一种致病菌,能引起肺内部感染,且能降解酪蛋白,从而对海参有一定溶解能力[35],该类致病菌的存在使海参的食用安全性受到威胁并会对海参的保鲜产生影响,通过抑制此类致病菌的生长来保证海参食用的安全性以及提高海参的保质期具有重要意义。
3 海参内脏的综合利用
海参内脏作为海参加工处理过程中的废弃物,含有多种活性成分。如若将其中的有效成分提取利用,势必会提高海参加工的附加值,增加企业的利润,既具有经济价值又具有环保意义。此外,虽然迄今为止并没有发现有关海参内脏食用安全性方面的研究报道,但是世界范围内仍有许多国家的居民世世代代以海参内脏为原料来制作各种风味的美食。
3.1 肠壁活性多肽
海参肠壁中粗蛋白的含量占干基的70.9%,是开发活性多肽的良好资源,并且从中获取活性多肽的途径有两种,肠壁自溶:由海参肠壁自溶得到活性多肽的最佳条件是pH 4.43,温度为48.3℃,所获得的寡肽分子的分子量主要分布在3ku(87.7%)以下,具有一定的Fe2+螯合作用[36],能够抑制生物大分子过氧化,清除体内自由基,具有一定的抗氧化作用。研究显示,海参多肽的抗氧化性优于Vc,且与氨基酸的组成密切相关,如富含 Val、Met、His、Ala 和 Leu 的肽普遍具有较高的抗氧化活性[37];外源酶模拟肠壁自溶:该法得到的多肽,除抗氧化活性之外,还具有一定的抗肿瘤作用,实验证明,胃蛋白酶降解肠壁得到的所有分子量的多肽及胃蛋白酶-胰酶混合物降解肠壁得到的小于3ku的多肽对HT-29肿瘤的抑制率达22%~30.5%,IC50为5.25(胃蛋白酶降解所有分子的多肽)到5.86mg/mL(胃蛋白酶-胰酶降解小于3ku的多肽);胃蛋白酶-胰酶混合物降解得到大于3ku的多肽对 HT-29肿瘤抑制率为 87.5%,IC50为1.45mg/mL[38]。
3.2 性腺及其低分子多肽
新西兰、夏威夷、萨摩亚、库克等太平洋群岛的居民利用海参内脏的再生功能,定期采收海参内脏以取性腺制作美食或作为传统膳食的蛋白质成分[39]。被摘取性腺的海参会在 7~14d康复,41d后又会长出新的性腺,萨摩亚群岛每年夏天有六个月的采摘期,因此,当地居民大部分都以此为谋生手段。日本的Kuchiko也是以海参性腺为原料干制而成[40]。此外,还可将海参性腺进一步酶解为低分子多肽[41],并采用 Maillard 反应来改善其酶解风味[42]。
3.3 抗逆性酶类
海参肠壁中超碱性蛋白酶(最适pH为13.5)[43]和超碱性多糖水解酶等,在如此碱性环境中仍能保持较高活力和较高稳定性,具有重要的理论研究意义和应用价值。该类酶在超碱性条件下发挥催化作用,可避免微生物污染,因此,在工业应用领域具有较大潜力,如活性多肽、寡糖的制备等。
3.4 海参肠溶酱
在日本,著名的konowata就是由海参内脏发酵而来的,味道极其鲜美,为日本清酒的佐酒佳肴,在京都的筑地中心市场年销售量达8~10t。其制作方法为,将内脏清洗后,加其总重的10%~15%的盐,充分混合5h,沥干水分,放入桶中老化一周后即可食用[44]。
3.5 海参肠道益生菌
野生的刺参肠壁中已被筛选出16株抗菌株[45],其中14株抗革兰氏阳性菌,2株抗阴性菌,并且有2株既能抗阳性菌又能抗阴性菌,其中HS-A38菌株抗菌稳定且能力较强,它对大肠杆菌和副溶血弧菌等有较强的抑菌作用,且具有生长周期短,适应海洋环境等优点,具有开发益生菌制剂的潜力。
3.6 海参肠香精
将海参肠洗净后,高温软化,匀浆,加蛋白酶水解,去沉淀,得澄清的海参肠水解液。将该水解液与葡萄糖、谷氨酸钠等配料混合,进行高温Maillard反应,制得带有香味的海参肠香精,其营养价值高、口味鲜美,可用于食品调味料[46]。
4 展望
海参作为重要的海洋食物资源和药物资源早已用于养生、保健和治疗上。但是随着海参消费市场的日益扩大和海参加工产量的快速增加,对海参加工副产物——海参内脏的综合利用已迫在眉睫。海参内脏不仅是一种高蛋白、富含多不饱和脂肪酸和微量元素的营养滋补品,而且还含有抗氧化、抗肿瘤、抑菌、提高免疫力等多种活性成分。国内外对海参内脏的研究历程较短,因此研究开发空间较大。一方面可运用相关的高新技术对海参内脏进行新产品新工艺的开发,来获得更多海参内脏的衍生食品,如发酵类,腌制类及复合添加类等食品,以满足方便快捷、营养保健的市场需求;另一方面可进一步开发海参内脏中生物活性物质,对其进行分离纯化、结构解析、构效关系及相应的活性作用机理进行研究,并以其为新药先导化合物,进一步合成或半合成具有独特疗效的创新性药物等,实现其显著的社会经济效益。此外,虽然海参内脏的某些部位已作为某些国家的风味美食,但是,对其各部位进行相应的食品安全风险评估还是必要的。
[1]沈鸣.海参的化学成分和药理研究进展[J].中成药,2001,23(10):758-761.
[2]Purcell S W,Mercier A,Conand C,et al.Sea cucumber fisheries:global analysis of stocks,management measures and drivers of overfishing[J].Fish and Fisheries,2013,14:34-59.
[3]Purcell S W,Samyn Y,Conand C.Commercially important sea cucumbers of the world[M].Rome:Food and Agriculture Organization of the United Nations,2012:5.
[4]Zamora L N,Jeffs A G.Feeding,Selection,Digestion and Absorption of The Organic Matter from Mussel Waste by Juveniles of The Deposit-Feeding Sea Cucumber,Australostichopus Mollis[J].Aquaculture,2011,317(1-4):223-228.
[5]孙修勤,郑法新,张进兴.海参纲动物的吐脏再生[J].中国海洋大学学报,2005,35(5):719-724.
[6]袁文鹏,刘昌衡,王小军,等.仿刺参不同部位营养成分的分析及综合评价[J].食品工业科技,2010,31(5):348-350.
[7]张健,王茂剑,马晶晶,等.仿刺参生殖腺营养成分分析[J].食品科学,2013,34(14):232-236.
[8]苏秀榕,向怡卉,郑卫星,等.刺参消化道多糖的研究[C].2007年全国生化与生物技术药物学会年会,2007:11-28.
[9]林威威,张健,王茂剑,等.仿刺参肠道多糖的纯化及理化分析[J].食品科学,2011,32(17):118-122.
[10]陈涛,张健,王茂剑,等.木瓜蛋白酶提取仿刺参消化道多糖[J].食品科学,2010,31(20):226-229.
[11]陈涛.3种仿刺参多糖的提取纯化和抗氧化研究[D].上海:上海海洋大学,2010.
[12]王志远,李霞,王斌,等.仿刺参肠多糖对免疫功能的影响及抗肿瘤研究[J].农业生物技术学报,2012,20(5):560-567.
[13]蒋鑫,徐静,李妍妍,等.海参消化道多糖降血脂功能的研究[J].中国食品学报,2011,11(7):46-49.
[14]Kalinin V I,Silchenko A S,Avilov S A,et al.Sea Cucumbers Triterpene Glycosides,The Recent Progress in Structural Elucidation and Chemotaxonomy[J].Phytochemistry Reviews,2005,4:221-236.
[15]Dyck S V,Gerbaux P,Flammang P.Elucidation of molecular diversity and body distribution of saponins in the sea cucumber Holothuria forskali(Echinodermata)by mass spectrometry[J].Comparative Biochemistry and Physiology,Part B,2009,152(2):124-134.
[16]Dyck S V,Gerbaux P,Flammang P.Qualitative and Quantitative Saponin Contents in Five Sea Cucumbers from the Indian Ocean[J].Marine Drugs,2010,8:173-189.
[17]Caulier G,Flammang P,Gerbaux P.When a repellent becomes an attractant:harmful saponins are kairomones attracting the symbiotic Harlequin crab[J].Scientific reports 1,article number:34/doi:10.1038/srep 00034.
[18]Lee M H,Kim Y K,Moon H S,et al.Comparison on Proximate Composition and Nutritional Profile of Red and Black Sea Cucumbers(Apostichopus Japonicus)from Uleungdo(Island)and Dokdo(Island),Korea[J].Food Sci Biotechnol,2012,21(5):1285-1291.
[19]章超桦,吴红棉,洪鹏志,等.马氏珠母贝肉的营养成分及其游离氨基酸组成[J].水产学报,2000,24(2):180-184.
[20]Gao F,Yang H S,Xu Q,et al.Phenotypic Plasticity of Gut Structure and Function During Periods of Inactivity in Apostichopus Japonicus[J].ComparativeBiochemistryand Physiology Part B:Biochemistry and Molecular Biology,2008,150(3):255-262.
[21]Zhu B W,Zhao J G,Yang J F,et al.Purification and partial characterization of a novel β-1,3-glucanase from the gut of sea cucumber Stichopus japonicus[J].Process Biochemistry,2008,43(10):1102-1106.
[22]姜令绪,杨宁,李建,等.温度和pH对刺参消化酶活力的影响[J].海洋与湖沼,2007,38(5):476-480.
[23]Yao D R,Zhou M Q,Wu S J,et al.Depolymerization of chitosan by enzymes from the digestive tract of sea cucumber Stichopus japonicus[J].African Journal of Biotechnology,2012,11(2):423-428.
[24]John D F.The digestive system of the holothurian,Cucumaria elongata.II.Distribution of the digestive enzymes[J].The Biological Bulletin,1967,132:354-361.
[25]李英辉,丛丽娜,朱蓓薇.海参肠中溶菌酶的分离纯化及其酶学性质[J].大连工业大学学报,2008,27(3):193-196.
[26]于蕾,朱蓓薇,孙黎明,等.海参肠道组织蛋白酶B粗酶提取条件的优化[J].大连工业大学学报,2010,29(6):409-412.
[27]张毛毛,朱蓓薇,周大勇.海参肠组织蛋白酶 L的分离纯化及部分酶学性质研究[C].中国食品科学技术学会第八届年会暨第六届东西方食品业高层论坛,2011:11-2.
[28]Gao F,Yang H S,Xu Q,et al.Effect of water temperature on digestive enzyme activity and gutmass in sea cucumber Apostichopus japonicus(Selenka),with special reference to aestivation[J].Chinese Journal of Oceanology and Limnology,2009,27(4):714-722.
[29]程菁恒,朱蓓薇,吴海涛,等.海参肠碱性磷酸酶的提取及粗酶的特性研究[J].大连工业大学学报,2012,31(2):83-87.
[30]Wu H T,Li D M,Zhu B W,et al.Characterization of Acetylcholinesterase from The Gut of Sea Cucumber Stichopus Japonicus[J].Chemistry and Biochemistry,2013,79(2):303-311.
[31]楼乔明,王玉明,刘小芳,等.南极磷虾脂肪酸组成及多不饱和脂肪酸质谱特征分析[J].中国水产科学,2011,18(4):929-935.
[32]Mamelona J,Pelletier E,Girard- Lalancette K,et al.Quantification of Phenolic Contents and Antioxidant Capacity of Atlantic Sea Cucumber,Cucumaria Frondosa[J].Food Chemistry,2007,104(3):1040-1047.
[33]刘小芳,薛长湖,王玉明,等.乳山刺参体壁和内脏营养成分比较分析[J].水产学报,2011,35(4):587-593.
[34]Mamelona J,Saint- Louis R,Pelletier E.Nutritional Composition and Antioxidant Properties of Protein Hydrolysates Prepared from Echinoderm Byproducts[J].Food Science and Technology,2010,45(1):147-154.
[35]向怡卉,苏秀榕,董明敏,等.海参细菌的分离鉴定和生长特性研究[J].中国食品学报,2006,6(1):25-29.
[36]Zheng J,Wu H T,Zhu B W.Identification of antioxidative oligopeptides derived from autolysis hydrolysates of sea cucumber(Stichopus japonicus)guts[J].Eur Food Res Technol,2012,234:895-904.
[37]郑杰,吴海涛,朱蓓薇,等.海参肠自溶水解物抗氧化活性的研究[J].大连工业大学学报,2011,30(5):313-317.
[38]Perez-Vega J A,Olivera-Castillo L,Gomez-Ruiz J A,et al.Release ofMultifunctionalPeptides by Gastrointestinal Digestion of Sea Cucumber(Isostichopus Badionotus)[J].Journal of Functional Foods,2013,36(1):1-9.
[39]Drumm D J,Loneran N R.Reproductive Biology of Holothuria Leucospilota in The Cook Islands and The Implications of Traditional Fishing of Gonads on The Population[J].New Zealand Journal of Marine and Freshwater Research,2005,39(1):141-156.
[40]Ozer N P,Mol S,Varlik C.Effect of handling procedures on the chemical composition of sea cucumber[J].Turk J Fish Aquat Sci,2004,4:71-74.
[41]曹荣,刘淇,殷邦忠.响应面法优化海参性腺酶解工艺[J].食品科学,2012,33(2):29-33.
[42]李冬燕,王雨生,陈海华,等.海参性腺和海参肠酶解液风味改良研究[J].中国农学通报,2012,28(29):98-103.
[43]Fu X Y,Xue C H,Miao B C,et al.Characterization of Proteases from The Digestive Tract of Sea Cucumber(Stichopus Japonicus):High Alkaline Protease Activity[J].Aquaculture,2005,246(1-4):321-329.
[44]Kinch J,Purcell S,Uthick S,et al.Sea Cucumbers,A Global Review on Fishery and Trade[J].SPC Beche de Mer Information Bulletin,2008,28:1-6.
[45]李爱民,丛丽娜,侯英敏.海参肠道菌HS-A38的鉴定[J].大连工业大学学报,2011,30(1):10-12.
[46]袁文鹏,刘昌衡,唐聚德,等.一种海参肠香精的制造方法:中国,200810157342.9[P].2008-09-25.

