以锂矿为锂源循环制备正极材料LiFePO4
王 平,吴利苹,王梓丞
[成都天齐实业(集团)有限公司,四川成都610041]
自1994年Goodenough研究组发现磷酸金属锂、1997年A.K.Padhi首次报道橄榄石型LiFePO4具有脱锂嵌锂功能以来,LiFePO4以其安全性能和高温性能好、无毒、循环寿命长等优点,成为储能电池、混合动力车和纯电动车电池的理想正极材料之一[1-4]。LiFePO4电池已应用于 Bolloré Bluecar、日产 Leaf、雪佛兰Volt、比亚迪E6、Fisker Karma等电动车及电动工具、移动基站等领域。为了使LiFePO4电动车普及,储能电池广泛应用,降低LiFePO4电池的生产成本是目前需要解决的问题之一。而正极材料LiFePO4占磷酸亚铁锂电池生产成本的30%~40%,因此降低LiFePO4的生产成本显得尤为重要。
LiFePO4的制备方法包括高温固相合成法[1]、碳热还原法[5]、水热合成法[6]、 液相共沉淀法[7]、 固相法[8]、溶胶凝胶法[9]、微波烧结法[10]、雾化热解法[11]等,这些方法都是以碳酸锂、氢氧化锂、磷酸二氢锂、草酸锂、醋酸锂、硝酸锂、氟化锂等锂盐作为锂源制备LiFePO4。锂盐是以锂矿、卤水或其他锂盐为原料,经过湿法冶金或化工方法生产,生产锂盐与生产LiFePO4分别进行,既不能综合循环利用资源,减少生产工序,又增加了流通、储存等成本。水热合成法铁源价格低廉[6];在水溶液中形成磷酸亚铁锂相,原料反应充分,同时可通过控制溶液中的氧含量抑制二价铁氧化,因此产品质量稳定。以科莱恩Life Power®P2为代表的水热法LiFePO4产品受到电池生产商的青睐。但水热合成法存在一个问题,即每生产1 t的LiFePO4会产生0.7 t硫酸锂,若单独建生产线回收则会使成本增加。
1 实验
1.1 LiFePO4的制备
1)将锂辉石煅烧、酸化、浸出、净化、分离,滤液蒸发浓缩,制得初级锂液;2)将初级锂液转化冷冻、过滤、洗涤,滤液蒸发浓缩,制得反应用锂液;3)将反应用锂液与亚铁盐溶液、磷源溶液进行液相合成反应得到磷酸亚铁锂,再经过滤、洗涤,直至滤饼洗涤液中未检出锂离子,在滤饼中加入适量的水,将其稀释成泥浆,加入糖水溶液,干燥,煅烧,即得碳包覆的LiFePO4材料。
其中,步骤(1)和步骤(2)所述蒸发浓缩过程中产生的冷凝水循环用于配制磷源溶液、亚铁盐溶液;收集步骤(3)中的滤液和滤饼洗涤液,即含有锂盐的溶液或回收滤液,将其返回步骤(1)的浸出工序循环利用。步骤(2)所述的“转化冷冻”是指在初级锂液中加入钠盐,初级锂液中的Li2SO4与钠盐反应,生成另一种锂盐和Na2SO4,再将所得反应溶液冷却,从而使生成的硫酸钠结晶析出,过滤分离除去。 步骤(2)所述的反应用锂液中的锂质量浓度为26.2 g/L,Ca2+、Mg2+、Cl-、K+、Cu2+、Pb2+的任意一种含量不高于0.01%(质量分数,采用ARCOS FHS12型电感耦合等离子体光谱仪测定)。步骤(3)所述的亚铁盐的质量浓度为55.8g/L,磷源溶液中PO43-的质量浓度为719.2 g/L。参与液相反应的锂溶液、亚铁盐溶液、磷源溶液之间的体积比为(2.5~3.5)∶(3~4)∶(0.3~0.7)。步骤(3)中配制亚铁盐溶液的亚铁盐原料为硫酸亚铁,配制磷源溶液的磷源原料为磷酸或磷酸二氢铵。步骤(2)转化冷冻时,初级锂液中加入的钠盐为碳酸钠、氢氧化钠或磷酸二氢钠,步骤(3)所述糖原料选自葡萄糖、乳糖的任一种或二者组合。
制备初级锂液时,锂辉石的煅烧温度为1 100~1 380℃,煅烧时间为50~300 min;酸化时加入硫酸,酸料质量比为 1∶(4~7);以锂辉石计,按液固质量比为(2~3)∶1在酸化处理液中加入水或回收滤液,调节 pH为 5.7~6.2,静置,过滤,得母液 1;调节母液1的pH为8.5~9.7,静置,过滤,得母液2;调节母液2的 pH为10~10.8,静置,过滤,得母液 3;检测母液3中Ca2+浓度,加入等摩尔的Na2CO3,搅拌,静置,过滤,得母液4;蒸发浓缩母液4,过滤,得母液5,检测母液5中的SO42-的浓度,加入与SO42-等摩尔氢氧化钠或碳酸钠,将母液5中的SO42-全部转化成Na2SO4,搅拌,在-15~0 ℃下冷却结晶,过滤,得母液6;蒸发浓缩母液6,至其含锂质量浓度为26.2 g/L,得反应用锂溶液。为避免引入其他阳离子,采用氢氧化钠调节pH;为有效除去Ca2+、Mg2+、SO42-等杂质离子,采用分级调节pH进行分级静置沉淀。为有效防止Fe2+的氧化,步骤(3)中的液相合成反应是在密闭反应釜中在氮气或氩气保护下进行,将反应釜加热升温至150~220℃,保温220~720 min。糖原料的加入量为洗净滤饼固含量的5%~20%(质量分数)。为防止Fe2+氧化成Fe3+,煅烧是在氮气气体的保护作用下,650~1 000℃下煅烧 3~15 h。
1.2 LiFePO4的表征
采用DX-2500型X射线衍射仪进行物相分析,辐射条件:Cu靶,Kα辐射,管压为40 kV、管电流为30 mA、扫描速度为 0.02(°)/s、扫描范围为 10~100°。采用JSM-7500型冷场发射扫描电子显微镜,按照JY/T 010—1996《分析型扫描电镜检测方法通则》对LiFePO4进行形貌表征。采用Mastersizer 2000型粒度仪,以颗粒折射率1.740,按通用分析模式进行LiFePO4粒度分布测定。采用C30D库仑法卞氏水分测定仪进行LiFePO4水分测定。采用V-Sorb 2800S型比表面仪测定了样品的比表面积。用CT2001C型电池测试仪对LiFePO4扣式电池的充放电性能进行测试[充放电范围为 2.3~4.2V,环境温度为(25±2)℃]。
按照质量比 83∶10∶7称取 LiFePO4、 导电乙炔黑(Super-P)和 PVDF(HSV900),滴加适量的 N-甲基吡咯烷酮(NMP),研磨均匀,涂布在铝箔上,在80℃下干燥12 h,铳成直径为13 mm的圆片,制得正极片。以金属Li片为对电极,1 mol/L的LiPF6/碳酸乙烯酯(EC)+二甲基碳酸酯(DMC)(EC 与 DMC 体积比为1∶1)为电解液,采用Celgard2300为隔膜,组装成2430型扣式电池。扣式电池的组装是在通有氩气的手套箱内进行。
2 结果与讨论
2.1 结构与形貌分析
图1是LiFePO4样品的XRD谱图。从图1可看出,LiFePO4样品的纯度高,杂相少。样品纯度较高的一个原因是在制备反应锂溶液时,采用氢氧化钠代替锂盐生产领域常用以调节pH的氢氧化钙,避免在反应体系中带入大量的Ca2+,且采用分级调节pH实现分级静置沉淀,有效地清除 Ca2+、Mg2+、SO42-等杂质;用碳酸钠沉淀溶液中的Ca2+、Mg2+等杂质,并彻底清除,制得锂离子浓度及杂质含量符合LiFePO4制备要求的反应用锂溶液。另一个原因是LiFePO4的合成过程是在密闭的惰性气体保护的液相环境中进行的,溶液基本处于无氧状态,既可避免二价铁氧化成三价铁,反应物质又在离子状态下充分反应。
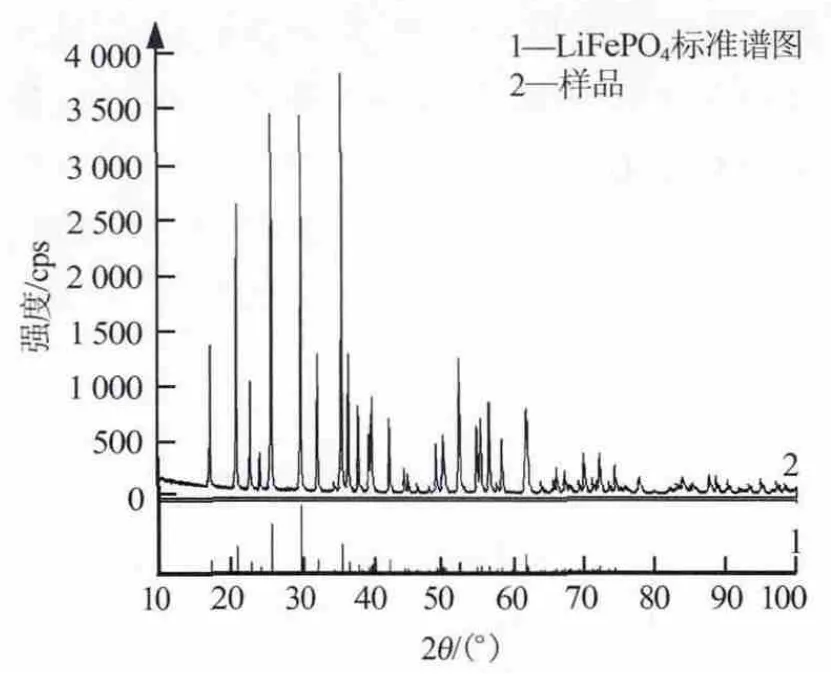
图1 LiFePO4材料的XRD谱图
图2是LiFePO4样品的SEM照片。从图2可知,组成球形二次粒子的一次粒子之间有空隙,便于电解液浸润。二次粒子呈球形或类球形,便于电极制作,且正极材料内部的一次粒子表面均匀包覆碳层,确保了活性材料的导电能力,最大程度地利用活性材料的容量,并能够提高材料的大电流充放电性能。一次粒子具有均匀包覆碳层的原因,是采用糖水溶液与LiFePO4混合,糖以分子形式存在,均匀包覆在LiFePO4上,煅烧后残留碳仍均匀包覆在LiFePO4上。

图2 LiFePO4样品的SEM照片
2.2 粒度、比表面积及水分分析
图3是LiFePO4样品的粒度分布谱图。从图3可见,LiFePO4样品的最终粒度分布在一个比较窄的范围,有助于电极制作。

图3 LiFePO4材料的粒度分布图
表1是LiFePO4材料粒度、水分及比表面积数据。由表1可见,D50为1.677 μm,符合商用LiFePO4要求。LiFePO4正极材料水质量分数为4.8×10-4,较商用LiFePO4规定的1.0×10-3低很多。水分会造成电解液变质,使电池铆钉生锈、电池内部压力过大、内阻增大、自放电高、容量低、循环寿命减少、电池漏液等。本方法制备的LiFePO4正极材料的比表面积也符合商用LiFePO4的要求。

表1 LiFePO4材料粒度、水分及比表面积数据
2.3 电化学性能分析
图4是0.2 C下LiFePO4样品的首次充放电曲线。由图4可见,样品在4.2 V条件下首次充电比容量为164.5 mA·h/g,2.3 V条件下首次放电比容量为160.1 mA·h/g,首次库伦效率为97.3%,效果较佳。图5是0.2C和1C条件下LiFePO4样品的放电曲线。由图5可见,0.2C时样品的放电比容量为160.1mA·h/g,1C时样品的放电比容量为145.3 mA·h/g,结果较佳。

图4 0.2 C下LiFePO4材料的首次充放电曲线

图5 0.2 C、1 C下LiFePO4材料的放电曲线
2.4 LiFePO4制备成本分析
表2是用不同锂源生产1 t碳包覆的LiFePO4所需要的锂原料成本。由表2可见,与以锂盐为锂源制备碳包覆的LiFePO4的方法相比,以锂矿为锂源制备的LiFePO4具有非常明显的成本优势。

表2 不同锂源生产1t碳包覆的LiFePO4所需要的锂原料成本
以锂矿为锂源循环制备LiFePO4,可以根据LiFePO4的制备需要,控制反应用锂溶液中的锂离子浓度及其杂质含量,无需进行繁杂的锂盐精制、纯化处理,部分省略了硫酸法制备锂盐中的冷却结晶、分离、除杂、干燥等步骤,并缩短了母液的蒸发浓缩时间,节省了锂盐的营销成本,降低锂盐精制纯化除杂的难度。此外,制备锂源过程中产生的冷凝水副产品循环用于配制亚铁盐溶液或磷源溶液,LiFePO4生产中的含锂副产品又循环用于锂矿制备锂源的过程,省略了副产品的回收处理工序,减少甚至避免了废水的排放,节约废水处理成本,显著提高资源利用率,降低生产成本,同时实现循环经济。以锂矿为锂源循环制备LiFePO4可综合节约制备成本超过12 000 元/t。
3 结论
以锂矿为锂源制备正极材料LiFePO4,根据LiFePO4的制备需要,控制反应用锂溶液中的锂离子浓度及其杂质含量,减少锂盐制备工序及营销成本,循环利用反应用锂溶液及LiFePO4制备过程中产生的副产品,节约LiFePO4的生产成本超过12000元/t,同时实现了循环经济。所制备的正极材料LiFePO4具有纯度高、电化学性能优(0.2 C时的比容量为 160.1mA·h/g,1C 时的比容量为 145.3 mA·h/g)、粒度分布均匀,比表面积合理(15.5 m2/g),水分低(4.8×10-4)等优点。
[1]Padhi A K,Nanjundaswamy K S,Goodenough J B.Phospho-olivines as positive-electrode materials for rechargeable lithium batteries[J].Journal of the Electrochemical Society,1997,144(4):1188-1194.
[2]Ferrari S,Lavall R L,Capsoni D,et al.Influence of particle size and crystal orientation on the electrochemical behavior of carbon-coated LiFePO4[J].Journal of Physical Chemistry:C,2010,114(29):12598-12603.
[3]Lu Zhouguang,Chen Hailong,Rosa Robert,et al.Citric acid-and ammonium-mediated morphologicaltransformationsofolivine LiFePO4particles[J].Chemistry of Materials,2011,23(11):2848-2859.
[4]Brunetti G,Robert D,Bayle-Guillemaud P,et al.Confirmation of the Domino-Cascade Model by LiFePO4/FePO4precession electron diffraction[J].ChemistryofMaterials,2011,23 (11):4515-4524.
[5]胡国荣.一种真空碳热还原法合成磷酸铁锂的方法:中国,1948134[P].2007-04-18.
[6]Dokko Kaoru,Koizumi Shohei,Sharaishi Keisuke,et al.Electrochemical properties of LiFePO4prepared via hydrothermal route[J].Journal of Power Sources,2007,165(2):656-659.
[7]周海燕,姜华,张玉梅,等.一种沉淀法制备碳包覆的纳米级磷酸铁锂的方法:中国,101393982[P].2009-03-25.
[8]唐致远,高飞.三步高温固相煅烧制备磷酸铁锂正极材料的方法:中国,101279728[P].2008-10-08.
[9]刘新保,贾晓林,马美品,等.高性能锂离子电池正极材料LiFePO4、C 的制备方法:中国,101179124[P].2008-05-14.
[10]金江剑,王国光,徐君.锂离子电池正极材料磷酸铁锂的微波快速固相烧结方法:中国,101279725[P].2008-10-08.
[11]水淼,舒杰,任元龙,等.一种原位喷雾热解磷酸铁锂全固态薄膜电池制造方法:中国,102456929A[P].2012-05-16.

