枣皮红色素理化性质及其食品添加剂研制
于艳琴, 杜京旗, 赵 君, 杨卫民
吕梁学院生命科学系,山西吕梁033001
目前,国内外食品安全屡遭质疑,人们对食用色素的使用也提出了更高的要求,相对于大多数具有致癌风险的人工合成色素,天然植物色素更受到人们的欢迎。天然色素将成为食品、药品、化妆品等产品不可缺少的重要添加剂[1]。研究表明,枣皮红色素主要为类黄酮类[2~4]、橙酮类物质[5,6]、黄烷醇类和黄酮醇类物质[7]。枣皮中除类黄酮外,花青素和多酚类等药用成分含量也很可观[8,9],其他物质还包括总酚酸和花色苷等[10]。赵文恩等[11]通过 FRAP 实验证实,枣皮红色素的总抗氧化能力与其黄酮类物质含量之间呈正相关性。枣皮红色素还具有一定的抗还原能力,一定浓度食品添加剂对其影响不大[12]。因此,枣皮红色素具有重要的实用价值[13]。
枣皮红色素以色泽浓郁纯正,水溶性好,具有消除自由基、抗氧化、抗肿瘤、抗衰老等多种药用功效而著称。目前开发和利用这一天然色素资源还存在许多问题,前人也对其理化性质做了一些初步的研究,但对其质量指标测定和安全性分析还鲜有报道。本文以木枣皮为原料,经酶解和微波超声波处理后用一定浓度的NaOH溶液提取枣皮红色素,对枣皮红色素制品的理化指标、质量指标及安全性进行研究和分析,旨在为食品添加着色寻找一种优质的天然色素资源。
1 材料与方法
1.1 材料与试剂
木枣皮由山西省木枣精华有限公司提供,木枣品种为山西柳林木枣。
实验试剂包括:NaOH、HCl、NaCl、KCl、MgCl2、ZnCl2、CaCl2·2H2O、FeCl3·6H2O、Na2O2、K2HPO4·3H2O、无水乙醇、苯甲酸钠、柠檬酸、苯甲酸、蔗糖、淀粉、抗坏血酸、葡萄糖、丙酮、苯、甲酸、冰乙酸、甲醇、正丁醇、乙酸乙酯、氯仿、石油醚、蛋白胨、乳糖、柠檬酸铁铵、琼脂粉、酸性复红、去氧胆酸钠、溴化麝香草酚蓝、牛肉粉,均为分析纯;纤维素酶、果胶酶均为标准品。
1.2 主要仪器设备
XH-300B型祥鹄电脑微波超声波组合合成萃取仪(北京祥鹄科技发展有限公司);ALB-224电子天平(赛多利斯科学仪器北京有限公司);THZ-82气浴恒温振荡器(江苏省金坛市医疗仪器厂);Anke KA-1000离心机;SHB-ⅢA循环水式多用真空泵(郑州长城科工贸有限公司);真空干燥箱D2F-3型(6020B)(上海福玛实验设备有限公司);VIS-723N可见分光光度计(北京瑞利分析仪器公司);SPX-800B-G型光照培养箱(上海博讯实业有限公司医疗设备厂);LDZX-40Ⅱ型立式自动电热压力蒸汽灭菌器(上海申安医疗器械厂);超净工作台(苏州佳宝净化工程设备有限公司);数位式照度计(北京清大时代科技有限公司)。
1.3 枣皮红色素提取方法
枣皮经粉碎后,采用混合酶液[1%纤维素酶∶1%果胶酶=1∶20(M/V)]酶解,50℃恒温12 h,酶解后用微波超声波组合萃取仪处理15min,分为3阶段进行,分别设置温度50℃、60℃和70℃,超声波功率800 W、900 W和1 000 W,微波功率200 W、250 W 和300 W,超声波频率25 KHz,模式15∶10,电机转速 900 r/min。处理后用 1%NaOH提取,所得处理液3 000 r/min离心去渣,5min/次,离心3次,合并滤液,用45微孔滤膜加100%乙醇反复减压抽滤,直至无絮状物出现,最后在真空干燥箱40℃干燥,得到枣皮红色素制品。
1.4 枣皮红色素的光谱特征与理化特性
1.4.1 光谱特征 将1 g枣皮红色素制品用纯水定容于100mL容量瓶中,采用可见分光光度计在330~760 nm范围内进行扫描,确定红色素的最大吸收波长。
1.4.2 红色素外观的测定 将枣皮红色素提取液经过真空干燥法和冷冻干燥法浓缩后得到固体红色素。观察它的颜色、气味、结晶状况。
1.4.3 溶解度 取1 g的枣皮红色素制品分别溶于5mL纯水、甲醇、无水乙醇、丙酮、苯、甲酸、冰乙酸、乙酸乙酯、氯仿、石油醚,观察溶解性及颜色变化。
1.4.4 红色素色价 称取红色素制品0.1 g,用pH 2.0的盐酸乙醇溶液定容至200mL,以pH 2.0的盐酸乙醇溶液作对照,测定其吸光值。根据公式计算色阶。
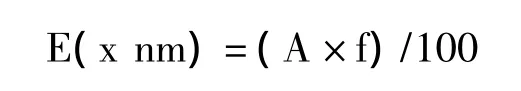
式中,E为色价;A为吸收值;f为稀释度。
1.4.5 干重 称取红色素制品0.5 g,于烘箱(105℃ ±2℃)中干燥2~4 h后称重,直至恒重,即为样品干重。计算公式为:
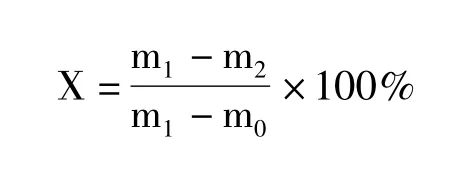
式中,X:样品的干燥失重(%);m1:干燥前带有样品的称量瓶和盖的质量(g);m2:干燥后带有样品的称量瓶和盖的质量(g);m0:干燥后空称量瓶和盖的质量(g)。
1.5 理化因子对枣皮红色素性质的影响
用纯水将5 g红色素制品定容于500mL容量瓶中,制成枣皮红色素液,用于测定各种理化因子对枣皮红色素的影响。
1.5.1 光照对枣皮红色素理化性质的影响 取等份枣皮红色素液10mL,在自然光照条件下分别放置0 h、3 h、6 h、9 h、12 h 和24 h,测定吸光值。
1.5.2 温度对枣皮红色素理化性质的影响 取等份枣皮红色素液10mL分别置于20℃、40℃、60℃、80℃、100℃的恒温水浴中,3 h后至室温时测定吸光值。
1.5.3 pH值对枣皮红色素理化性质的影响 取等份枣皮红色素液10mL,分别调节其pH为1.0、3.0、5.0、7.0、9.0、11.0 和13.0,测定吸光值。
1.5.4 金属离子对枣皮红色素理化性质的影响取5支试管各加入5mL枣皮色素液,再分别加入浓度为 0.1 mol/L 的 KCl、MgCl2、ZnCl2溶液1mL,摇匀后室温放置,定时取样,测定吸光值。
1.5.5 甜味剂对枣皮红色素理化性质的影响在40mL枣皮红色素液中分别加入0.2 g蔗糖、淀粉,使其浓度均为0.5%(M/V),摇匀,每隔一定时间测定一次吸光值。
1.5.6 酸味剂对枣皮红色素理化性质的影响将0.04%和0.4%的柠檬酸钠溶液分别加入到10mL枣皮红色素液中,于室温下暗处放置,每隔一定时间测定吸光值。
1.5.7 防腐剂对枣皮红色素理化性质的影响将0.04%和0.4%的苯甲酸钠溶液分别加入到10mL枣皮红色素液中,于室温下暗处放置,每隔一定时间测定吸光值。
1.6 枣皮红色素微生物含量的检测
1.6.1 细菌总数的测定 依据《食品安全国家标准》(GB 4789.2-2010)进行食品微生物检验,即测定菌落总数。取红色素制品1 g,用无菌生理盐水稀释,按质量体积比(M/V)梯度稀释为0%、1%、0.1%、0.01%的样品溶液。在营养琼脂培养基表面分别滴加不同浓度红色素制品0.2mL,涂布平板培养基表面。将接种好样品的培养基放置于36±1℃的培养箱中培养48±2 h,并计数。
1.6.2 大肠菌群 MPN(coliforms most probable number)的测定 依据《食品安全国家标准》(GB 4789.3-2010)中的方法进行大肠菌群MPN的计数。取红色素制品1 g,用无菌生理盐水按质量体积比(M/V)梯度稀释为10%、1%、0.1%和0.01%的样品溶液,各取1mL放入试管。将DC培养基溶化待冷却至50℃左右,装入上述试管,每管3mL,立即混匀。凝固后于36±1℃培养24 h并记录。对产气试管中的菌用伊红美兰培养基进一步培养,以排除假阳性。
1.7 枣皮红色素的应用试验
1.7.1 在糖果中的应用 称取10 g蔗糖,将其熔化然后立即加入20%的红色素液5mL,将其搅拌混匀,冷却即为一颗糖果。对着色效果进行观察。
1.7.2 在面食中的应用 称取50 g豌豆面两份,取5%红色素液100mL与其混和,取100mL纯水与其混和,制作成面条,煮熟前后对其颜色进行观察。
2 结果与分析
2.1 枣皮红色素的光谱特征与理化特性
枣皮红色素提取液在330~760nm范围内扫描,由图1可知,红色素在340 nm附近有明显的吸收波峰。因此,可将340 nm作为测定红色素理化性质的波段。
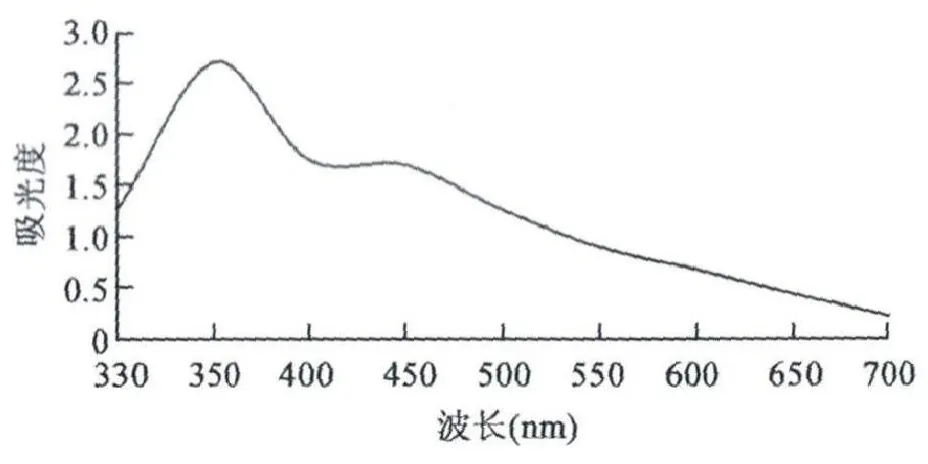
图1 枣皮红色素提取液的波长扫描图Fig.1 Wavelength scan of jujube fruit peel red pigment.
对提取的枣皮红色素外观进行观察,经真空干燥后获得的红色素固体制剂为深枣红色、有光泽、有一定的粘性,呈淡淡的枣香味。经冷冻干燥获得的红色素固体制剂为枣红色、有光泽,有浓浓的枣香味。
枣皮红色素极易溶解于水和甲酸中,溶液均呈枣红色;不溶于甲醇、无水乙醇、丙酮、苯、冰乙酸、乙酸乙酯、氯仿和石油醚,溶液均呈无色。实验中发现,用冰乙酸溶解枣皮红色素时溶液颜色呈无色、红色素制品呈粉末状,可以考虑使用冰乙酸来去杂,进一步纯化枣皮红色素。
经测定,红色素的色价为6.52,含水量为20.12%。
2.2 各种理化因子对枣皮红色素的性质的影响
2.2.1 光照对枣皮红色素理化性质的影响 无论处于光照下还是黑暗中,红色素的吸光值都随时间的变化出现相似的变化规律,即呈现先降低后升高的趋势;光照条件下其吸光值下降较避光条件下要快(图2)。因此,应该尽量避光保存枣皮红色素。
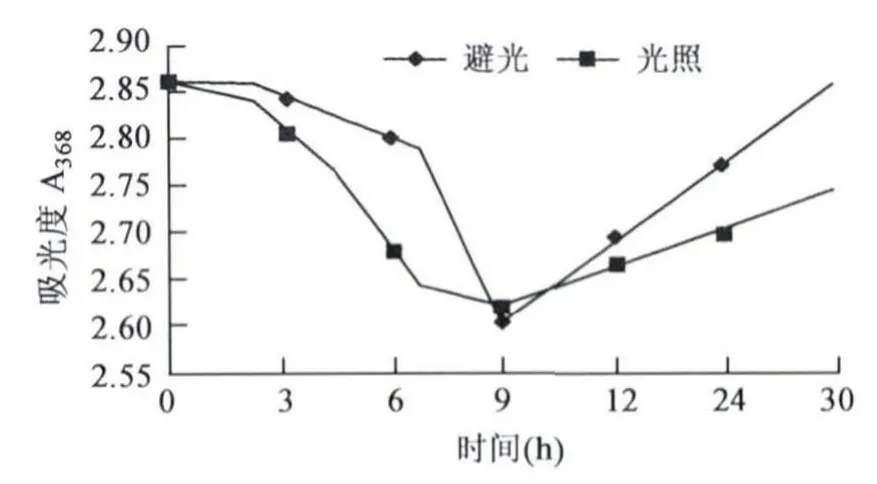
图2 光照时间对枣皮红色素的影响Fig.2 Effects of illumination time on jujube fruit peel red pigment.
2.2.2 温度对枣皮红色素理化性质的影响 在0℃~60℃范围内,红色素吸光值保持不变;60℃ ~100℃范围内,红色素的吸光值有所下降(图3)。说明红色素具有较好的耐热性。
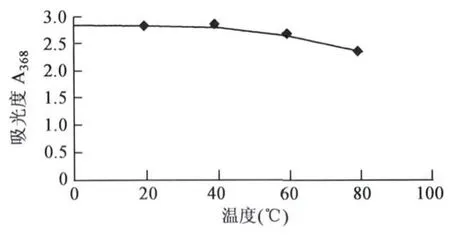
图3 温度对枣皮红色素的影响Fig.3 Effects of temperature on jujube fruit peel red pigment.
2.2.3 pH值对枣皮红色素理化性质的影响 酸碱性对红色素吸光值影响很显著,结果见图4。当pH<3.0时,红色素吸光值比较低,溶液为橙红色;pH>7.0时,枣皮红色素呈一定稳定状态,且溶液为枣红色;pH约为5.0时,枣皮红色素出现沉淀,过滤后,上清液为橙红色。沉淀用纯水洗下来,不完全溶解,加入1.0 mol/L NaOH全部溶解,并成为枣红色溶液。
2.2.4 金属离子对红色素理化性质的影响K+、Mg2+、Zn2+对红色素的理化性质影响较小,在368 nm下的吸光值呈现先缓慢下降后保持稳定的状态,结果见图5。
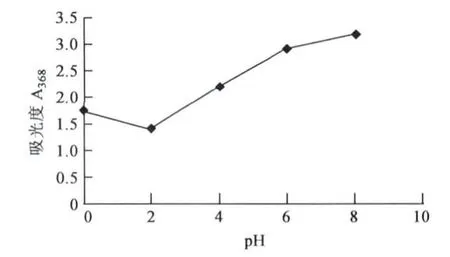
图4 pH值对枣皮红色素的影响Fig.4 Effects of pH on jujube fruit peel red pigment.
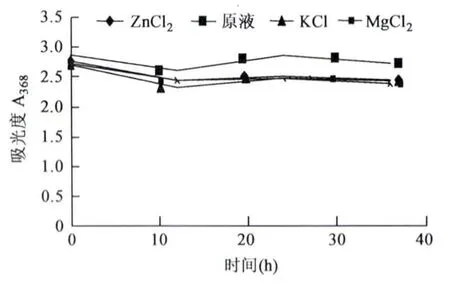
图5 金属离子对枣皮红色素的影响Fig.5 Effects of metal ion on jujube fruit peel red pigment.
2.2.5 甜味剂对枣皮红色素理化性质的影响甜味剂主要考察蔗糖和淀粉对枣皮红色素的影响,结果见图6。蔗糖对枣皮红色素的的理化性质影响较小;淀粉则影响较明显,红色素在368 nm处吸光值明显下降,随时间推移,下降更明显。
2.2.6 酸味剂对枣皮红色素理化性质的影响柠檬酸对枣皮红色素理化性质有一定的影响(图7),高浓度柠檬酸(0.4%)的影响比低浓度柠檬酸(0.04%)的影响稍大,均降低红色素的吸光值。
2.2.7 防腐剂对枣皮红色素理化性质的影响苯甲酸钠是常见食品添加剂,0.04%、0.4%的苯甲酸钠对红色素理化性质有一定影响,但影响不大(图8)。
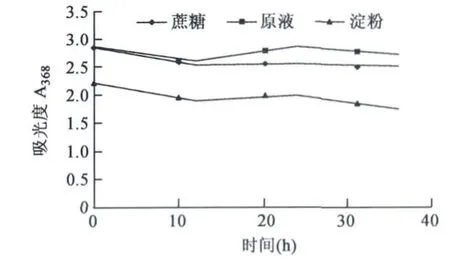
图6 不同甜味剂对枣皮红色素的影响Fig.6 Effects of different sweeteners on jujube fruit peel red pigment.
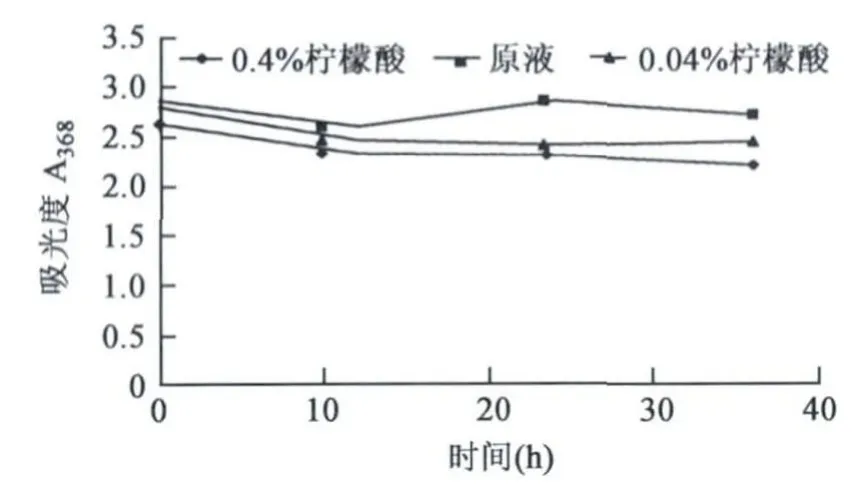
图7 不同浓度柠檬酸对枣皮红色素的影响Fig.7 Effects of different concentrations of citric acid on jujube fruit peel red pigment.
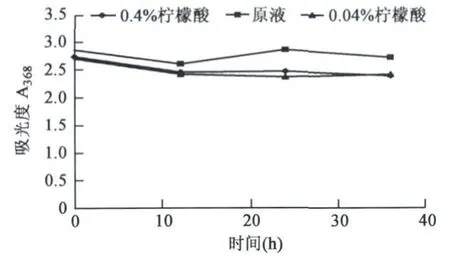
图8 不同浓度苯甲酸钠对红色素的影响Fig.8 Effects of different concentrations of sodium benzoate on jujube fruit peel red pigment.
2.3 枣皮红色素制品的微生物检测
2.3.1 细菌总数 依《食品安全国家标准》(GB 4789.2—2010)测定红色素制品在平板上菌落数,几个稀释度经过48 h培养后均未有菌落产生,经计算红色素的菌落总数0.8×1×10-4=8×10-5CFU/mL。
2.3.2 大肠菌群MPN 对不同稀释度红色素溶液在DC培养基中革兰氏阴性菌生长的情况进行观察。经过48 h培养后,其中一个试管有产气现象,依《食品安全国家标准》(GB 4789.3—2010),用伊红美兰培养基对产气试管中的菌进行检测。经检测,伊红美兰培养基中未形成紫黑色菌落,所以确定产气管为假阳性。因此,被检测的红色素各稀释度下都为阴性。由大肠菌群最可能数(MPN)检索表得大肠菌群MPN<3.0。
2.4 枣皮红色素制品食品添加的应用效果
红色素加入蔗糖后有枣香味,颜色呈橙红色,加热后其橙红色基本保持不变。红色素可作为糖果等食品的食用色素添加剂使用。
在豌豆面中添加枣皮红色素,着色效果如图9(彩图见封三图版),煮后与煮前对比,煮后比煮前颜色更鲜红,含水量增多。
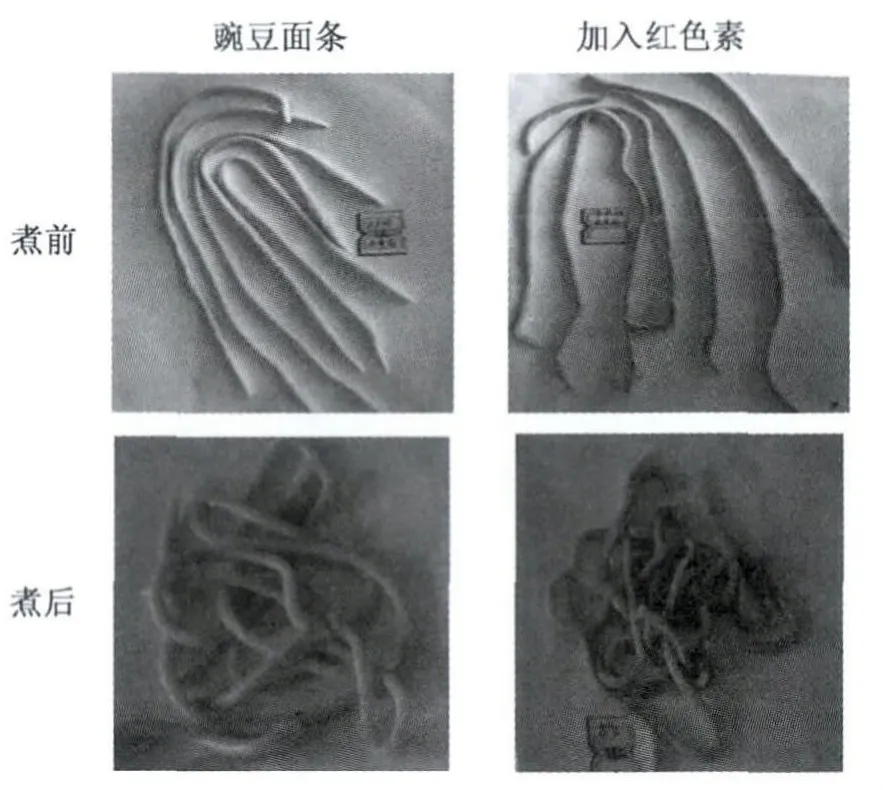
图9 添加枣皮红色素制作成的豌豆面条Fig.9 Peas pasta adding jujube fruit peel red pigment.
3 讨论
本实验制得的枣皮红色素制品呈枣红色颗粒状,其水溶液呈深枣红色,具有典型的枣香味,色泽浓郁纯正,保持了木枣原有的风味特色。枣皮红色素制品不溶于甲醇、无水乙醇、丙酮、苯、冰乙酸、乙酸乙酯、氯仿和石油醚,但在红色素提取中枣皮原料不可避免地混杂有鞣质、蛋白质和淀粉等杂质,利用其不溶于乙醇的特性在红色素纯化中剔除鞣质、蛋白质和淀粉等杂质,安全环保;利用冰乙酸溶解枣皮红色素制品时溶液颜色呈无色,且红色素制品呈粉末状的特点,可以使用冰乙酸来去杂,进一步纯化红色素。此方法应用于从枣泥和枣核中提取红色素应该更有效。
红色素制品对温度、部分金属离子(K+、Mg2+、Zn2+)具有较好的稳定性;光照对其理化性质有一定的影响,呈现先降低后升高的趋势;对酸碱性十分敏感,在pH 1.0~7.0范围内不稳定,pH 7.0~14.0范围内稳定。大部分天然色素分子对金属离子反应敏感,但红色素制品对K+、Mg2+、Zn2+具有较好的稳定性,在实际应用中应充分考虑红色素制品光氧化反应和对酸性条件的敏感度,这样有利于保持红色素制品的品质。
红色素制品对蔗糖、苯甲酸钠、柠檬酸具有较好的稳定性;其色价为6.52,含水量为20.12%;微生物检测结果表明;其菌落总数为8×10-5CFU/mL,细菌污染的可能性很低;大肠菌群MPN值<3,显色呈阴性,无大肠杆菌。由于其着色力较弱,实际使用中会造成成本的提高;含水量高的原因可能是色素制品中还含有其他杂质,也可能是由于其分子结构中有过多的羟基造成的,研究中也发现如果将红色素制品在室内自然保存,其含水量有明显的增加。因此,在实际应用中一定要采取适当的措施,避免自然吸湿造成的质变。
枣皮红色素是水溶性极好的色素,具有较好的理化性质;质量指标测定和安全性分析结果良好;资源丰富、来源广泛且色泽亮丽,提取工艺简单,且具有消除自由基、抗氧化、抗肿瘤、抗衰老等多种药用功效,是一种具有开发潜力的食用色素。
[1]邓祥元,王淑军,李富超,等.天然色素的资源和应用[J].中国调味品,2006,(10):49 -53.
[2]詹嘉红,蓝宗辉,魏小凤.黑布林李子皮色素的提取及稳定性[J].食品研究与开发,2011,32(5):182 -185.
[3]张培成.天然产物化学丛书·黄酮化学[M].北京:化学工业出版社,2008,1 -390.
[4]吴宇宽.红枣红色素的提取纯化及其性质和应用研究[D].武汉:武汉工业学院,硕士学位论文,2008.
[5]常世敏,生吉萍,申 琳.冬枣果皮红色素提取及其性质的分析研究[J].保鲜与加工,2004(5):18-20.
[6]孙灵霞.木枣枣皮红色素的提取工艺及其理化性质研究[D].西安:陕西师范大学,硕士学位论文,2005.
[7]张琼,沈广宁,王淑贞,等.枣果皮色素物质的初步研究[J].安徽农业科学 (工学版),2010,38(19):10034-10036.
[8]Zhao Z H,Liu M J,Tu P F.Characterization of water soluble polysaccharides from organs of Chinese Jujube(Ziziphus jujube Mill.cv.Dongzao)[J].Eur.Food Res.Technol.,2008,(226):985-989.
[9]Sadilova E.Pigments in food:a challenge to life sciences[J].Eur.Food Res.Technol.,2007,225(3):613 -614.
[10]Zhang H,Jiang L,Ye S,et al..Systematic evaluation of antioxidant capacities of the ethanolic extract of different tissues of jujube(Ziziphus jujube Mill.)from China[J].Food Chem.Toxicol.,2010,48(6):1461 -1465.
[11]赵文恩,李倩茜.FPAP法测定大枣枣皮红色素的总抗氧化能力[J].郑州大学学报:工学版,2011,32(3):28 -30.
[12]吴宇宽,刘章武.红枣红色素理化性质的研究[J].武汉工业学院学报2008,27(1):11 -14.
[13]王丽华,黄明发.几种极具发展前景的功能性色素[J].中国食品添加剂,2008,(1):71 -74.

