miR-155种子序列的反义寡核苷酸对抗多发性骨髓瘤的作用*
丰茂晓, 朱容萱, 骆小闯, 古春明, 曾 雪, 费 嘉△
(暨南大学医学院 1生物化学与分子生物学系, 2临床医学系,广东 广州 510632)
多发性骨髓瘤(multiple myeloma,MM)是恶性浆细胞克隆性增殖疾病,其发病机制涉及多个方面,包括染色体数量异常、易位、基因突变、表观遗传学改变以及骨髓微环境的改变[1]。多发性骨髓瘤发病呈现多步骤的过程,早期的染色体易位涉及到14号染色体(14q32.33)和4号染色体(4p16.3),结果导致4号染色体上相邻的多发性骨髓瘤组蛋白(multiple myeloma SET protein,MMSET)基因和成纤维细胞生长因子受体3(fibroblast growth factor receptors 3,FGFR3)基因发生分离[2]。随着疾病的发展,将再次发生染色体易位、相关基因的突变(涉及到K-RAS和N-RAS的激活)、复杂核型畸变、p53和FGFR3基因的突变以及细胞周期素依赖性激酶抑制剂2A (cyclin-dependent kinase inhibitor 2A,CDKN2A)和细胞周期素依赖性激酶抑制剂2C(cyclin-dependent kinase inhibitor 2C,CDKN2C)基因的失活[2]。这些遗传畸变将导致恶性浆细胞黏附分子表达的改变,必然引起浆细胞和骨髓基质的异常作用[2],进而引起人骨髓微环境(human bone marrow microenvironment, huBMM)中的浆细胞发生多级转变,这些转变对肿瘤细胞生长、存活和耐药性有着重要的影响[3-5]。随着研究的深入,发现MM细胞中的miRNAs呈显著的异常表达,并认为这些异常表达的miRNAs与浆细胞发生遗传学畸变,特别是与染色体异常有密切的关联[2,6-7]。
Al Masri等[8]的研究发现在细胞系和病人的骨髓样本中,恶性的浆细胞miRNA的表达水平出现明显的差异,其中高表达的miRNAs包括miR-125b、miR-133a、miR-1和miR-124a。Bakkus等[9]也检测出MM病人以及细胞系中一些高表达的miRNAs(let-7a、miR-16、miR-17-5p和miR-19b)。Picchiorri等[10]还发现,miRNA-17~92群(miRNA-19a、-19b和-92)和miRNA-106~25 群(miRNA-106b、-93和-25)在MM样品中也呈现高表达的现象,miRNA-17~92通过靶向负性调节凋亡前体蛋白Bim的表达,有助于骨髓瘤的形成。Lane等[11]对MM样品中异常表达的miRNA 进行分析,结果发现miRNA-21、miR-19a和miR-19b表达水平升高,并揭示这些miRNAs参与信号转导子及转录激活子3(signal transducer and activator of transcription 3, STAT3)和白细胞介素 6(interleukin-6, IL-6)的抗凋亡途径。根据染色体易位和周期蛋白D (translocation/cyclin D, TC)分类,Lionetti等[6]通过多重分析发现MM在5个TC组中有26个miRNAs具有显著表达差异现象,其中值得注意的是在TC5组中有10种miRNAs相比于其它4个TC组有明显的过表达趋势。在这10种过表达的miRNAs中,miR-155在MM中高水平表达首次被发现。 目前已知miR-155在B细胞淋巴瘤中是一个重要的生物标志物,有关miR-155在恶性浆细胞病中的功能还没有文献报道。由于浆细胞也是来源于B细胞,因此,miR-155在MM中是否具有类似B细胞淋巴瘤中癌基因功能,这引起我们极大的关注。
miRNA是一类内源性,约22个核苷酸长度的非编码小RNA,通过转录后负性调控机制在细胞过程中起着重要的作用。成熟的miRNA与靶mRNA的3’非翻译区(3’-untranslated region,3’UTR)配对,从而抑制翻译过程或降解靶mRNA。这些小分子RNA也可能在肿瘤形成过程中起重要作用[12],类似癌基因(oncomiRs)功能,因此oncomiRs被当作为癌症治疗新的靶点[13]。另一方面,在miRNA的5’端具有7~8个高度保守序列,被称为种子序列。种子序列通过与其靶基因mRNA的3’UTR进行碱基完全互补配对,促进靶基因mRNA降解或抑制mRNA翻译,从而对靶基因的表达水平进行转录后的负性调控[14-16]。针对miRNA种子序列反义核酸可以干扰miRNA与靶基因的配对,从而阻止miRNA发挥功能。相对于成熟miRNA而言,针对种子序列的反义核酸具有分子量小、特异性强、转染效率高等优点,因而开始受到关注[17]。
为了阐述miR-155在多发性骨髓瘤细胞中的作用,本研究针对miR-155的种子序列合成miR-155的微小反义核酸(tiny antimiR-155, t-antimiR-155),靶向作用于多发性骨髓瘤细胞RPMI-8266中的miR-155,探究t-antimiR-155对多发性骨髓瘤细胞的抑制效应,为肿瘤基因治疗寻找新的方法,同时也为针对miRNA种子序列的反义核酸药物开发创造有利条件。
材 料 和 方 法
1 反义寡核苷酸的设计与合成
从microRNA Families数据库中获取人miR-155的种子序列,根据序列互补原理设计针对种子序列的反义寡核苷酸序列(t-antimiR-155),并采用BLAST软件分析确定其反义寡核苷酸序列及随机对照序列,见图1。
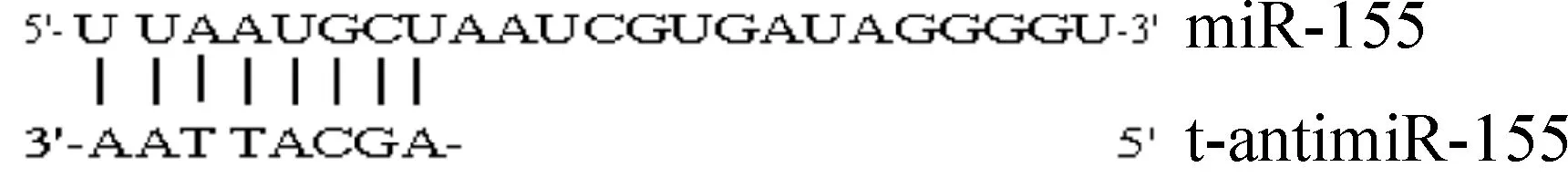
Figure 1. The sequences of miR-155 and t-antimiR-155.
2 主要试剂
MTT和DMSO购自Sigma;胎牛血清及RPMI-1640培养基购自Gibco;LipofectamineTM2000购自Invitrogen。反义寡核苷酸序列(t-antimiR-155):5’-AGCATTAA-3’;随机序列(scrambled sequence,SCR):5’-TCATACTA-3’,均由上海生物工程有限公司合成,全硫代修饰,高效液相色谱(high-performance liquid chromatography, HPLC)纯化。
3 主要方法
3.1细胞培养 将RPMI-8266细胞(多发性骨髓瘤细胞,南方医科大学附属珠江医院惠赠)接种于含10%胎牛血清、无抗生素的RPMI-1640培养基中,置于37 ℃、5% CO2培养箱,饱和湿度下培养。每2~3 d换液传代。实验选用对数生长期、0.2%台盼蓝拒染率>95%的细胞。
3.2MTT法筛选反义寡核苷酸的最佳作用浓度 本实验分t-antimiR-155组、SCR组和空白对照组,每组设5个复孔。t-antimiR-155组中t-antimiR-155的核酸终浓度为0.2、0.3、0.4 和0.5 μmol/L,SCR组中随机序列的核酸终浓度为0.2、0.3、0.4和0.5 μmol/L。取对数生长期的RPMI-8266细胞,各组细胞以1×108cells/L的密度接种于96孔板,每孔50 μL,转染终体积100 μL(转染方法参照Invitrogen公司LipofectamineTM2000说明书),空白对照组加入50 μL无血清Opti-MEM培养基。转染6 h后,每孔加入100 μL含20%胎牛血清的RPMI-1640培养基,使每孔终体积为200 μL。48 h后每孔加入MTT液20 μL,于培养箱中培养4 h后,1 000 r/min离心10 min,弃上清,每孔加入150 μL DMSO,振荡10 min,使结晶充分溶解。在多功能酶标仪上测定吸光度A570。实验重复3次,计算增殖抑制率。增殖抑制率(%)=(1-A实验组/A对照组)×100%。
3.3甲基纤维素细胞集落培养实验观察细胞集落形成情况 实验分组同前,根据文献改进[11],取对数生长期的RPMI-8266细胞,按1×103cells/well接种于含20%胎牛血清、2 mmol/L L-谷氨酰胺、5 μmol/L β-疏基乙醇和0.9%甲基纤维素的半固体培养基中,置37 ℃、5%CO2和饱和湿度条件下培养7 d。倒置显微镜下计数集落数和观察集落形态,以大于40个细胞的细胞团为1个集落。实验重复3次,计算相对集落形成率=(实验组/空白对照组)×100%。
3.4流式细胞仪计量分析RPMI-8266细胞凋亡情况 实验分组同前,各组细胞以5×107cells/L的密度接种于24孔板,每孔400 μL,转染终体积500 μL,空白对照组加入与实验组同体积的RPMI-1640培养基。6 h后加入500 μL 含20%胎牛血清的RPMI-1640培养基置于培养箱中培养。反义寡核苷酸组和随机对照组的核酸终浓度为0.4 μmol/L。48 h后离心收集细胞,采用Annexin V/PI二重染色,流式细胞术检测细胞凋亡情况。
4 统计学处理
数据以均数±标准差(mean±SD)表示,使用SPSS 13.0统计软件,采用单因素方差分析法(one-way AVONA)分析各组数据差异的显著性。以P<0.05为差异有统计学意义。
结 果
1 MTT法筛选反义寡核苷酸最佳作用浓度
t-antimiR-155在0.2 μmol/L和0.4 μmol/L之间有效抑制RPMI-8266细胞增殖活性,其最佳作用浓度为0.4 μmol/L,与SCR组相比差异显著(P<0.05)。t-antimiR-155在0.5 μmol/L的浓度显示出非特异性作用,见图2。
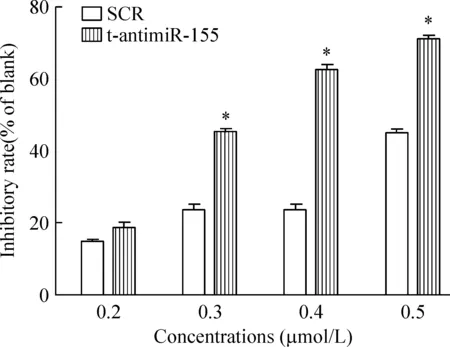
Figure 2. Inhibition rate of RPMI-8266 cells after transfected with t-antimiR-155.Mean±SD.n=3. *P<0.05 vs SCR group.
2 反义寡核苷酸对细胞集落形成的影响
采用甲基纤维素为支持物的集落形成法(colony forming method)检测RPMI-8266细胞的自我更新和增殖能力。7 d后,与SCR组相比,0.4 μmol/L反义寡核苷酸作用于RPMI-8266细胞后,细胞集落形成能力较弱,集落形成抑制率较高,差异显著(P<0.05),见图3。
3 反义寡核苷酸对细胞凋亡的影响
0.4 μmol/L反义寡核苷酸作用于RPMI-8266细胞48 h后,经Annexin V/PI二重染色,流式细胞术检测细胞凋亡率为7.56%。与SCR组相比,其凋亡率明显增加(P<0.05),见图4。以上实验结果表明t-antimiR-155作用于RPMI-8266细胞后,细胞生长受到抑制,细胞凋亡明显增加。

Figure 3. Cell colony formation assay of RPMI-8266 cells.Mean±SD.n=3. *P<0.05 vs SCR.
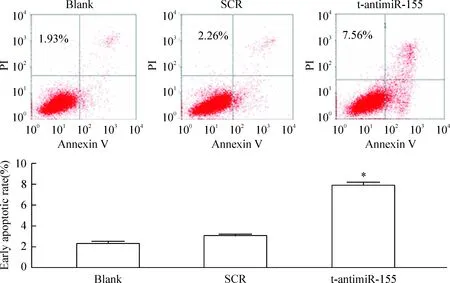
Figure 4. Flow cytometry analysis of the apoptosis of RPMI-8266 cells.Mean±SD.n=3. *P<0.05 vs SCR.
讨 论
多发性骨髓瘤是起源于浆细胞的恶性克隆增殖性疾病,以血清或尿液中出现单克隆免疫球蛋白以及多器官功能损害为特征,约占血液系统恶性肿瘤的10%。常规化疗缓解率低,迄今难以治愈[18-19],因此,需要寻找新的治疗手段。
miR-155位于21号染色体上,参与人体造血、炎症和免疫等功能[6]。作为一个类似癌基因, miR-155在多个肿瘤中高水平表达[20],与白血病、乳腺癌、肺癌、胃癌的形成过程都有密切的关系[21]。在华氏巨球蛋白血症(Waldenstrom macroglobulinemia,WM)中,失调的miR-155通过调节丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/Akt和核因子κB信号通路,影响WM细胞生存和生长[22];通过敲除miR-155,导致位于G1期的WM细胞明显降低,同时导致细胞周期依赖激酶和细胞周期蛋白D下调并刺激p53蛋白过表达。这意味着miR-155在WM细胞中通过调节细胞周期蛋白导致G1期阻滞[22]。虽然WM和MM一样,也是浆细胞病的一种,但miR-155在MM中确切的功能还不清楚。
基于文献报道miR-155在MM中的高水平表达[6],可能具有类似癌基因的作用,本研究针对miR-155的种子序列合成反义寡核苷酸t-antimiR-155,研究其在多发性骨髓瘤中的抑制作用。我们的数据显示t-antimiR-155经脂质体转染,显著抑制RPMI-8266细胞的增殖,其最佳作用浓度为0.4 μmol/L(图2)。其他的研究揭示乳腺癌中miR-155靶基因编码的蛋白是转录因子FOXO3a(forkhead box O3a),涉及细胞的存活[23]。同时,Linnstaedt等[24]也证实在大细胞淋巴瘤和弥散性大B细胞淋巴性淋巴瘤中,抑制miR-155的水平也可以抑制细胞的生长,与我们的结果一致。本研究首次采用了克隆形成实验来研究t-antimiR-155对RPMI-8266细胞恶性程度的影响,数据显示t-antimiR-155可以降低RPMI-8266细胞集落形成的能力(图3),有效抑制RPMI-8266细胞的恶性进展。流式细胞术检测结果显示t-antimiR-155可以明显促进RPMI-8266细胞的凋亡(图4)。
在体内和体外实验中,针对于mRNA的反义核苷酸已经被广泛用于评价靶基因的功能[25],同时有些反义核酸治疗方法已经用于临床实验[25-26],反义核苷酸药物具有安全性高、易合成、直接抑制靶基因表达等优点。miRNA反义核苷酸也是根据碱基互补配对原理,化学或生物合成与特定的miRNA初级转录物、miRNA前体或成熟的miRNA互补的DNA或RNA序列。在细胞中miRNA反义DNA与靶miRNA形成miRNA-DNA杂化链,激活RNA酶H,引起miRNA的降解,从而达到基因控制和治疗的目的。由于成熟miRNA只有19~24个核苷酸,目前认为用反义核苷酸抑制它们的功能是最好、也可能是唯一的方法[27]。
反义核苷酸技术在实际应用中也存在一些不容忽视的问题,比如高浓度药物也有一定的毒副作用,与靶序列的亲和力低,特别是药物在体内易被降解以及向靶器官传递效果不佳等制约了反义药物开发的进程等。对反义寡核苷酸进行一系列的化学修饰,可以增加反义寡核苷酸的亲和力,提高其抗性和在体内的输送效率。提高反义寡核苷酸与靶RNA亲和力的修饰涉及糖环部分,常用的修饰方法有锁核苷酸(locked nucleic acid, LNA)修饰、2′-O-甲基(2′-O-methyl)修饰、2′-O-甲氧乙基(2′-O-methoxyethyl)修饰、2′-氟代(2′-fluoro)修饰,而在这些修饰中提升与互补RNA亲和性最佳的为LNA修饰,可使双联熔解温度(Tm)上升2~8 ℃[28]。另一方面,通过对反义寡核苷酸骨架的硫代修饰和吗啉代修饰,可以提高反义寡核苷酸抗性和体内的输送效率[28]。我们设计合成的miR-155种子序列的反义寡核苷酸进行了全硫代修饰,本文中缺少对miR-155沉默的直接实验验证,这是本文章的不足之处,将作为我们今后进一步研究的内容。
目前,有关于miR-155的反义寡核苷酸经过LNA修饰可以沉默miR-155的报道。他们选用miR-155的多个靶基因做成荧光报告基因,用来检测miR-155是否被沉默。检测的结果显示,经过LNA修饰的antimiR-155可以使miR-155的多个靶基因(SOCS1、SMAD5、CEBPβ、MAFB、SHANK2和SH3PXD2A)的表达量明显增加[29]。由于全硫代修饰的t-antimiR-155的序列和t-LNA-155的序列相同,从理论上看,他们的生物学功能应当是相似的。
我们虽然没有通过检测miR-155的靶基因来获得全硫代修饰的t-antimiR-155沉默miR-155的直接实验证据,但在我们以前的研究中,将miR-21的靶基因程序性细胞死亡4(programmed cell death 4,PDCD4)做成荧光报告基因,转染硫代修饰的anti-miR-21后,PDCD4的荧光活力明显比SCR和空白组要高[30]。此结果可以证明经过全硫代修饰的反义寡核苷酸同样也可以使靶miRNA沉默。
本研究显示miR-155在多发性骨髓瘤中具有重要的类似癌基因的作用,针对种子序列的t-antimiR-155显著抑制多发性骨髓瘤的进展,可用于肿瘤的实验治疗研究,有一定的药物开发前景。
[参 考 文 献]
[1] Raab MS, Podar K, Breitkreutz I, et al. Multiple myeloma[J]. Lancet, 2009,374(9686):324-339.
[2] Benetatos L, Vartholomatos G. Deregulated microRNAs in multiple myeloma[J]. Cancer, 2012, 118(4): 878-887.
[3] Tassone P, Tagliaferri P, Rossi M, et al. Genetics and molecular profiling of multiple myeloma: novel tools for clinical management?[J]. Eur J Cancer, 2006, 42(11): 1530-1538.
[4] Palumbo A, Anderson K. Multiple myeloma[J]. N Engl J Med, 2011, 364(11): 1046-1060.
[5] Tassone P, Tagliaferri P, Teresa Fulciniti M, et al. Novel therapeutic approaches based on the targeting of microenvironment-derived survival pathways in human cancer: experimental models and translational issues[J]. Curr Pharm Des, 2007, 13(5): 487-496.
[6] Lionetti M, Biasiolo M, Agnelli L, et al. Identification of micro-RNA expression patterns and definition of a microRNA/mRNA regulatory network in distinct molecular groups of multiple myeloma[J]. Blood, 2009, 114(25): e20-e26.
[7] Lionetti M, Agnelli L, Lombardi L, et al. MicroRNAs in the pathobiology of multiple myeloma[J]. Curr Cancer Drug Targets, 2012, 12(7): 823-837.
[8] Al Masri A, Price-Troska T, Chesi M, et al. MicroRNA expression analysis in multiple myeloma [J]. Blood, 2005, 106(11):1554.
[9] Bakkus M, Dujardin S, Van Riet I, et al. MicroRNA expression analysis in multiple myeloma plasma cells and cell lines by a quantitative real-time PCR approach[J]. Blood, 2007, 110(11): 2472.
[10] Pichiorri F, Suh SS, Ladetto M, et al. MicroRNAs regulate critical genes associated with multiple myeloma pathogenesis[J]. Proc Natl Acad Sci U S A, 2008, 105(35): 12885-12890.
[11] Lane SW, Scadden DT, Gilliland DG. The leukemic stem cell niche: current concepts and therapeutic opportunities[J]. Blood, 2009, 114(6): 1150-1157.
[12] Calin GA, Sevignani C, Dumitru CD, et al. Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers[J]. Proc Natl Acad Sci U S A, 2004, 101(9): 2999-3004.
[13] Garzon R, Marcucci G, Croce CM. Targeting microRNAs in cancer: rationale, strategies and challenges[J]. Nat Rev Drug Discov, 2010, 9(10): 775-789.
[14] Bartel DP. MicroRNAs: target recognition and regulatory functions[J]. Cell, 2009, 136(2): 215-233.
[15] Guo H, Ingolia NT, Weissman JS, et al. Mammalian microRNAs predominantly act to decrease target mRNA levels[J]. Nature, 2010, 466(7308):835-840.
[16] Djuranovic S, Nahvi A, Green R. miRNA-mediated gene silencing by translational repression followed by mRNA deadenylation and decay[J]. Science, 2012, 336(6078): 237-240.
[17] Obad S, dos Santos CO, Petri A, et al. Silencing of microRNA families by seed-targeting tiny LNAs[J]. Nat Genet, 2011, 43(4): 371-378.
[18] 夏 盈,郑 冬,张珑涓,等. 重组人血管内皮抑素对人多发性骨髓瘤细胞RPMI8226增殖和相关蛋白表达的影响[J]. 中国病理生理杂志,2013,29(5):826-832.
[19] 马泳泳,周淑娟,葛杭萍,等. 丙戊酸对RPMI8226和U266细胞增殖及IL-6/JAK/STAT信号通路的影响[J]. 中国病理生理杂志,2013,29(5):833-838.
[20] Esquela-Kerscher A, Slack FJ. Oncomirs: microRNAs with a role in cancer[J]. Nat Rev Cancer,2006,6(4): 259-269.
[21] Tili E, Michaille JJ, Adair B, et al. Resveratrol decreases the levels of miR-155 by upregulating miR-663, a microRNA targeting JunB and JunD[J]. Carcinogenesis, 2010, 31(9): 1561-1566.
[22] Roccaro AM, Sacco A, Chen C, et al. microRNA expression in the biology, prognosis, and therapy of Waldenstrom macroglobulinemia[J]. Blood, 2009,113(18): 4391-4402.
[23] Kong W, He L, Coppola M, et al. MicroRNA-155 regulates cell survival, growth, and chemosensitivity by targeting FOXO3a in breast cancer[J]. J Biol Chem, 2010, 285(23): 17869-17879.
[24] Linnstaedt SD, Gottwein E, Skalsky RL, et al. Virally induced cellular microRNA miR-155 plays a key role in B-cell immortalization by Epstein-Barr virus[J]. J Virol, 2010, 84(22): 11670-11678.
[25] Lee Y, Vassilakos A, Feng N, et al. GTI-2501, an antisense agent targeting R1, the large subunit of human ribonucleotide reductase, shows potent anti-tumor activity against a variety of tumors[J]. Int J Oncol, 2006, 28(2): 469-478.
[26] Chi KN, Eisenhauer E, Fazli L, et al. A phase I pharmacokinetic and pharmacodynamic study of OGX-011, a 2′-methoxyethyl antisense oligonucleotide to clusterin, in patients with localized prostate cancer[J]. J Natl Canxer Inst, 2005, 97(17): 1287-1296.
[27] Esau CC. Inhibition of microRNA with antisense oligonucleotides[J]. Methods, 2008, 44(1): 55-60.
[28] Stenvang J, Petri A, Lindow M, et al. Inhibition of microRNA function by antimiR oligonucleotides[J]. Silence, 2012, 3: 1.
[29] Zhang Y, Roccaro AM, Rombaoa C, et al. LNA-mediated anti-miR-155 silencing in low-grade B-cell lymphomas[J]. Blood, 2012, 120(8): 1678-1686.
[30] Li Y, Zhu X, Gu J, et al. Anti-miR-21 oligonucleotide enhances chemosensitivity of leukemic HL60 cells to arabinosylcytosine by inducing apoptosis[J]. Hematology, 2010, 15(4): 215-221.

