肺动脉瓣狭窄行经皮肺动脉瓣球囊扩张治疗52例近期随访分析
周红梅 张刚成 尚小珂 彭婷 邓晓娴
肺动脉瓣狭窄(PS)是一种比较常见的先天性心脏病(先心病),占所有先心病的7.5%~9.0%[1]。可单独存在或合并其他心血管畸形,以单纯性PS最常见。过去这类简单先心病只能行外科手术治疗,随着结构性心脏病介入手术的出现及发展,经皮介入治疗逐渐成为主流,大有替代外科手术的趋势[2-4]。首例经皮肺动脉瓣球囊扩张术(PBPV)于1982 年实施,经过20 余年的推广,PBPV 在我国已经成为非常成熟的技术[5]。武汉亚洲心脏病医院先心病中心2007 年至2012 年行PBPV 治疗的单纯PS 患者共52 例,其中包含2 例肺动脉瓣轻度发育不良型PS,近期随访效果良好,现总结报道如下。
对象与方法
1.研究对象:共52 例患者接受PBPV 术治疗,其中男24 例(46.2%),年龄1 ~56(9.2±7.6)岁,<18 岁(中位年龄3.8 岁)38 例(73.1%),≥18 岁(中位年龄22 岁)14 例(26.9%);体重10 ~60(17.3±8.9)kg。其中10 例(19.2%)有活动后心慌、胸闷症状,余42 例(80.8%)均因体检发现心脏杂音而就诊。所有患者均于胸骨左缘第2、3 肋间闻及收缩期杂音伴或不伴震颤。部分患者X线胸片示肺动脉段显著凸出。心电图示23 例(44.2%)右心室增大,余皆正常。超声心动图示45 例(86.5%)右心房、右心室增大,7 例(13.5%)房室大小正常;肺动脉瓣环平均直径(14.6±2.5)cm。右心室造影示52 例患者均有典型射流征,符合圆顶样肺动脉瓣征象,其中2 例(3.8%)符合轻度发育不良型PS;经造影影像测瓣环直径基本同超声检查。排除标准:肺动脉瓣下漏斗部狭窄;重度发育不良型PS;合并重度右心衰竭,预计开放肺动脉瓣无助于改善病情者;合并窦状隙开放者;合并其他需要心外科手术矫治畸形者;复杂先心外科术后残余肺动脉瓣狭窄者。
2.PBPV 术:30 例(57.7%)全麻气管插管呼吸机辅助呼吸(均为儿童),22 例(42.3%)基础麻醉。选择球囊直径为瓣环直径1.2 ~1.4 倍,重度PS 首先选择小球囊,再选稍大球囊扩张肺动脉瓣,球囊沿加硬交换导丝定位于瓣环处,用稀释的对比剂以3 ~4 atm(1 atm=101.325 kPa)压力,5 ~10 s 快速充盈球囊,透视下见球囊凹陷充盈,切迹消失,可扩张2 ~3 次。球囊直径13 ~ 25 mm,共51 例选择单球囊,1 例选择双球囊扩张。
3.评价标准:参照《常见先天性心脏病介入治疗中国专家共识》[6]。球囊扩张术后重复肺动脉与右心室压力检测及右心室侧位造影。若术后肺动脉与右心室(漏斗部)之间跨瓣压差≤25 mmHg(1 mmHg=0.133 kPa),右心室造影示PS 已解除,为PBPV 术效果良好。如跨瓣压差≥50 mmHg 为效果不良,应考虑是否需更换更大的球囊重新行PBPV 术。部分患者(多为重度PS)在PBPV 术后瓣口梗阻虽已解除,但由于反应性漏斗部狭窄,右心室压力下降不理想,但连续曲线示肺动脉与漏斗部压差已解除,则仍为有效。
4.观察指标:术后即刻、24 h,术后1、3、6、12 个月进行随访。复查心电图,超声心动图,测定心腔内径、肺动脉瓣上最大流速等指标;右心导管检查测定术后右心室压力、肺动脉压力、肺动脉瓣跨瓣压差;右心室造影确定肺动脉瓣环位置,测量瓣环直径,并根据造影瓣环直径确定扩张球囊直径。
5.统计学分析:应用SPSS 软件进行统计学处理。计量资料以x-±s表示,采用重复测量的方差分析方法。计数资料采用频数(%)表示,相关分析采用χ2检验。以P<0.05 为差异有统计学意义。
结 果
1.术中情况分析:术中,1 例(1.9%)球囊充盈时出现心室颤动而发生阿斯综合征,回抽球囊后即刻缓解;1 例(1.9%)突发呼吸、心跳骤停,立即行心肺复苏成功后手术成功;24 例(46.2%)出现一过性心律失常,表现为室性早搏,短阵室性心动过速等;1 例(1.9%)低血压,1 例(1.9%)心动过缓,1 例(1.9%)氧饱和度下降,给予相应处理均好转。2 例(3.8%)出现穿刺后血肿,行加压包扎后血肿消退;2 例(3.8%)行PBPV 术后造影显示肺动脉瓣开放显著改善,但右心室压力仍很高,出现反应性漏斗部狭窄,给予盐酸普萘洛尔片口服,1 个月后复查,肺动脉瓣跨瓣压差显著减小。
2.手术效果分析:本组患者无死亡。术后即刻轻度肺动脉瓣反流8 例(15.4%),手术效果良好48 例(92.3%);术后1 月随访49 例,轻度肺动脉瓣反流6 例(12.2%),手术效果良好46 例(93.9%);术后6 月随访47 例,轻度肺动脉瓣反流2 例(4.3%),手术效果均良好(100.0%);术后12 月随访45 例,轻度肺动脉瓣反流2 例(4.4%),手术效果均良好(100.0%)。术后无一例出现中度以上肺动脉瓣反流。见表1。
3.影像学检查情况:(1)导管测量右心室肺动脉瓣跨瓣压差术前(86.3±27.6)mmHg,术后即刻(13.8±7.7)mmHg,差异有统计学意义(P<0.01)。(2)心脏彩超评估右心室肺动脉瓣跨瓣压差术前(96.6±30.4)mmHg,术后即刻(31.2±14.6) mmHg,差异有统计学意义(P<0.01);术后1 月(20.1±13.7)mmHg,与术后24 h 比较,差异有统计学意义(P<0.05)。术后24 h 与术后即刻比较,术后3 月与术后1 月比较,术后6 月与术后3 月比较,术后12 月与术后6 月比较,差异均无统计学意义(P>0.05)。见表1。
4.杂音变化情况:术前胸骨左缘第2 ~3 肋间可闻及收缩期杂音4/6 级14 例(26.9%),3/6 级24 例(46.2%),2/6 级14 例(26.9%)。术后24 h,52 例患者杂音均较术前减轻,4/6 级2 例(3.8%),3/6 级6 例(11.5%),2/6 级29 例(55.8%),1/6级15 例(28.8%)。
讨 论
PS 是一种常见的先心病,其发病率在先心病中排第四位。PS 患者由于瓣口狭窄,右心室射血阻力增加,导致右心室和肺动脉之间产生收缩期压力阶差而引起右心室肥厚,最终右心室扩张、右心衰竭,出现颈静脉怒张、肝肿大、腹水和下肢浮肿等症状。重度狭窄甚至出现运动后晕厥或猝死。而当PS 被解除,瓣孔直径显著扩大,使右心室收缩期负荷减低,右心室收缩力和跨瓣压差显著下降,右心室舒张功能亦显著改善。传统方法是正中开胸进行肺动脉瓣切开术。自1982 年Kan 等成功开展PBPV 术后,随着对PBPV 应用的适应证、方法学、手术前后血流动力学、作用机制及随访等进行深入研究,以及介入器械的完善,PBPV 简单、有效、安全、经济,已成为单纯PS的首选治疗方法,可代替外科开胸手术。王霄芳等[7]研究纳入204 例患者,结果证实,PBPV 治疗PS及室间隔完整型肺动脉闭锁(PA-IVS)安全有效,但应严格掌握适应证,规范操作可以减少并发症。
对于PS 行PBPV 的适应证,中国专家共识已经明确[6]。肺动脉瓣跨瓣压差≥40 mmHg 是球囊成形术的适应证。若婴幼儿患者肺动脉瓣跨瓣压差处于介入临界值(40 ~50 mmHg),笔者建议进行随访,一年后再次行心脏彩超等检查评估肺动脉瓣跨瓣压差。
PBPV 主要机制是通过球囊扩张撕裂瓣膜的薄弱部位以解除梗阻[8-10]。球囊长度要求:球囊长20 mm 适用于婴儿,30 mm 适用于除婴儿外的所有儿童,成人用30 ~40 mm 长的球囊。选择球囊直径与瓣环比值根据右心室造影及超声的测量结果。在早期研究中,有报道使用1.2 ~1.4 倍于瓣环直径的超大球囊扩张肺动脉瓣疗效满意[11-12]。但也存在潜在的长期大量肺动脉瓣反流,部分患儿甚至可能需要瓣膜置换,故推荐选择的球囊不要过大,球囊/瓣环直径比接近1.2 倍,避免超过1.3倍,且年龄越小,建议该比值越小,达到临床能够接受的术后即刻肺动脉瓣跨瓣压差即可(术后即刻肺动脉瓣跨瓣压差下降为术前的60%以下常被认为是PBPV 成功的标志)[13-14],不能盲目追求术后所谓“理想”的肺动脉瓣跨瓣压差,否则会因过度扩张带来严重瓣膜反流,甚至右心室流出道损伤等严重并发症。周开宇等[15]观察21 例小于2 月龄小婴儿及新生儿,选用球囊/瓣环直径比值为1.0 ~1.2,手术效果确切,术后肺动脉瓣跨瓣压差下降显著,尚余留30 ~40 mmHg 的肺动脉瓣跨瓣压差,大部分在随访中逐步减小,仅有2例出现再狭窄,再次实施PBPV 术,术后肺动脉瓣反流主要为微量至轻度(18/21),且在随访过程中无加重趋势。本研究观察的52 例患者中,有2 例患者扩张后造影显示肺动脉瓣开放显著改善,但右心室压力很高,主要由于右心室流出道术前继发性肥厚,且球囊扩张后右心室流出道痉挛所导致。刘芳等[16]认为心脏超声检查或右心室造影均无法提示发生此种现象的原因,多数病例术后在短期内(数天至数个月)会逐渐恢复,不需特殊处理,如痉挛严重引起持续性低氧可给予β阻滞剂,长期随访效果良好。本组2 例患者给予盐酸普洛尔片口服3 d,术后第2 天复查超声心动图,跨瓣压差已降至30 mmHg 以下,且在此后的复查中未再升高。本组无死亡病例,且手术效果满意。文献报道极重度PS 患儿的球囊成形术病死率为0 ~8%,再扩张率为3%~36%[17],而外科手术病死率为20%~25%[16,18],且很多患者需要右心室流出道的再手术。再次扩张的患者远期PS 解除均较理想,偶有需外科手术的患者。右心室发育不良是球囊扩张不成功的主要原因,多数文献报道肺动脉瓣和三尖瓣发育不良导致球囊扩张效果不理想[19-20]。但亦有报道,即使肺动脉瓣和右心室发育不良,部分患者仍可获得理想效果[21-22]。本研究有2 例轻度发育不良型PS,经超声及造影确诊后选择球囊直径为瓣环直径1.4 倍进行PBPV,术后效果满意。
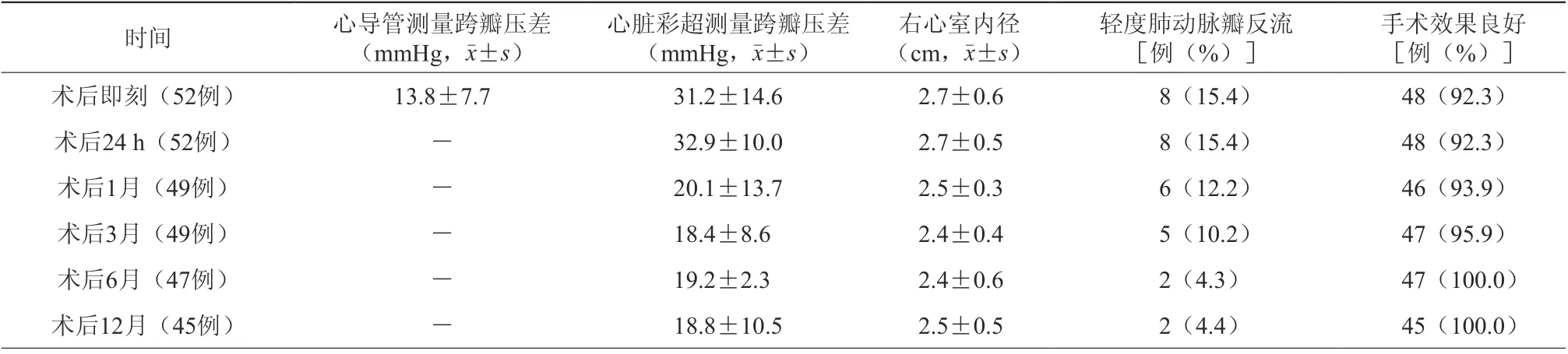
表1 患者PBPV术后超声心动图、右心室造影情况
本研究中关于PS 介入手术的经验总结如下。(1)婴幼儿重度PS 手术指征:越小年龄行PBPV,右心室跨瓣压差恢复越好。重度PS 婴幼儿的球囊扩张手术难度大,并发症发生率高。但是对于重、极重度PS 患者,出现低氧血症者,需早期手术,甚至在新生儿期就应该行PBPV 术。婴幼儿重度PS 如不及时处理,易出现脑血管栓塞和严重心功能衰竭,另外心室肥厚会发生不可逆性改变。(2)选择球囊/瓣环直径比:球囊/瓣环直径比通常为1.2 ~1.4,有研究认为最合适的球囊/瓣环直径比值是1.25,也有报道认为应该≥1.1,但不能>1.5。这与本研究的结果相似。同时,笔者发现球囊/瓣环直径比值不能≤1,因为比值过低会导致PBPV 术后残余压差较大,常需二次PBPV 术。关于新生儿是否适用该比值,目前相关研究较少。(3)球囊导管和单、双球囊的选择:近年来普遍认为单球囊法较简便,疗效好。但在临床应用中某些球囊对重度PS 或发育不良型PS 效果并不理想。18 ~20 kg 以上的小儿扩瓣效果有时不太满意(因瓣环太大),但其年龄、体重又未达到可用Inova球囊导管(主要是血管问题),此时用双球囊也许更恰当。
综上所述,PBPV 术在PS 患者中应用安全,效果好,并发症少,患者痛苦小,可作为外科治疗的一种替代疗法。
[1] Weryfiski P,Rudzifiski A,Krol-Jawien W,et a1. Percutaneous balloon valvuloplasty for the treatment of pulmonary valve stenosis in children-a single centre experience. Kardiol Pol, 2009, 67:369-375.
[2] 张刚成,沈群山,尚小珂,等.经皮导管介入封堵与外科微创封堵治疗室间隔缺损的对比研究.中国介入心脏病学杂志,2013,21:17-20.
[3] 尚小珂,柳梅,张刚成,等.并发中、重度三尖瓣反流的膜周型室间隔缺损行介入封堵的可行性.心脏杂志,2013,25:695-698.
[4] 尚小珂,张刚成,沈群山,等.膜周型室间隔缺损经皮导管介入封堵术中建立输送轨道的操作技巧.中国介入心脏病学杂志,2014,22:26-29.
[5] 周爱卿.先天性心脏病心导管术.上海:上海科学技术出版社,2009:270-456.
[6] 中国医师协会心血管内科分会先心病工作委员会.常见先天性心脏病介入治疗专家共识.介入放射学杂志,2011,20:253-256.
[7] 王霄芳,金梅,吴邦骏,等.经皮球囊肺动脉瓣成形术204 例临床分析.心肺血管病杂志,2011,30:371-374.
[8] Rao PS, Galal O, Patnana M, et a1. Results of three to 10 year follow up of balloon dilatation of the pulmonary valve. Heart, 1998,80:591-595.
[9] Stock JH, Relier MD, Sharma S, et a1. Trans balloon intravascular ultrasound imaging during balloon angioplasty in animal models with coarctation an branch pulmonary stenosis. Circulation, 1995,92:2354-2357.
[10] 王玉玮.肺动脉瓣狭窄的介入治疗.山东医药,2002,42:56-59.
[11] Wang JK, Wu MH, Lee WL, et a1. Balloon dilatation for criticalpulmonary stenosis. Am J Cardiol, 1999, 69:27-32.
[12] Jureidini SB, Rao PS. Critical pulmonary stenosis in the neonate:role of transcatheter management. J Invasive Cardiol, 1996, 8:326-331.
[13] Kobayashi T, Momoi N, Fukuda Y, et a1. Percutaneous balloon valvuloplasty of both pulmonary and aortic valves in a neonate with pulmonary atresia and critical aortic stenosis. Pediatr Cardiol, 2005, 26:839-842.
[14] Gardiner HM, Belmar C, Tulzer G, et a1. Morphologic and functional predictors of eventual circulation in the fetus with pulmonary atresia or critical pulmonary stenosis with intact septum.J Am Coll Cardiol, 2008, 5l:1299-1308.
[15] 周开宇,华益民,王一斌,等.不同手术时机对危重肺动脉瓣狭窄球囊扩张术疗效的影响研究.中华儿科杂志,2013,51:584-589.
[16] 刘芳,吴琳,黄国英,等.经皮肺动脉瓣球囊扩张成形术治疗小婴儿重度肺动脉瓣狭窄.中华医学杂志,2009,89:3253-3256.
[17] Cheung YF, Leung MP, Lee JW, et a1. Evolving management for critical pulmonary stenosis in neonates and young infants. Cardiol Young, 2000, 10:186-192.
[18] Blieden LC, Berant M, Zeevi B. Pulmonic stenosis//Moiler JH,Hoffman JI. Pediatric cardiovascular medicine. Philadelphia:Churchill Livingstone, 2000:552-564.
[19] Gildein HP, KIeinert S, Cob TH, et a1. Pulmonary valve annulus grows after balloon dilatation of neonatal critical pulmonary valve stenosis. Am Heart J, 1998, 136:276-280.
[20] Fedderly RT, Lloyd TR, Mendelsohn AM, et a1. Determinants of successful balloon valvotomy in infants with critical pulmonary stenosis or membranous pulmonary atresia with intact ventricular septum. J Am Coll Cardiol, 1995, 25:60-65.
[21] Tabatabaei H, Boutin C, Nykanen DG, et a1. Morphologic andhemodynamic consequences after percutaneous balloon valvotomyfor neonatal pulmonary stenosis:medium-term followup. J Am Coll CardioI, 1996, 27:473-478.
[22] Harley FL, Sade RM, Freedom RM, et a1. Outcomes in critically ill neonates with pulmonary stenosis and intact ventricular septum:a multiinstitutional study. Congenital Heart Surgeons Society.J Am Coll Cardiol, 1993, 22:183-192.

