急性淋巴细胞白血病患儿叶酰多聚谷氨酸合成酶和γ-谷氨酰水解酶基因表达与大剂量甲氨蝶呤疗效相关性
李 越 文飞球 陈小文 麦惠容 袁秀丽 李长钢
·论著·
急性淋巴细胞白血病患儿叶酰多聚谷氨酸合成酶和γ-谷氨酰水解酶基因表达与大剂量甲氨蝶呤疗效相关性
李 越1文飞球1陈小文2麦惠容1袁秀丽1李长钢1
目的 研究叶酰多聚谷氨酸合成酶(FPGS)、γ-谷氨酰水解酶(GGH)基因表达水平在急性淋巴细胞白血病(ALL)患儿和正常儿童中是否存在差异,并分析不同基因表达水平与大剂量甲氨蝶呤(MTX)疗效、毒副作用及预后的相关性。方法 以深圳市儿童医院(我院)血液科收治的ALL初诊且接受大剂量MTX化疗患儿为ALL组,以非造血系统恶性疾病儿童为对照组;采用SYBR Green荧光定量RT-PCR检测ALL组骨髓和对照组外周血中FPGS与GGH基因相对表达水平,比较ALL组和对照组FPGS与GGH基因表达水平差异。进一步按照ALL组FPGS、GGH基因表达水平的中位数分为相应的高表达亚组和低表达亚组,分析FPGS、GGH不同表达亚组MTX疗效、毒副作用及预后的差异。结果 2003年1月至2013年12月61例ALL患儿进入分析,男39例,女22例,平均年龄4.6岁;对照组纳入30例,男19例,女11例,平均年龄4.2岁。ALL组FPGS、GGH基因相对表达水平及其比值中位数(P25~P75)分别为14.14(6.52~27.31)、9.34(4.97~14.22)和1.74(0.76~2.91),对照组分别为0.59(0.3~1.23)、3.00(0.94~5.26)和0.26(0.13~1.00),差异均有统计学意义(P均<0.01)。FPGS高表达和低表达亚组复发率分别为3.7% (1/27)和23.3% (7/30),差异有统计学意义(P<0.05)。FPGS基因表达水平升高增加发生中性粒细胞减少的风险(OR=4.17,95%CI:1.65~10.52,P=0.003)。GGH基因高表达水平增加肝毒性的风险(OR=5.61,95%CI :1.14~27.47,P=0.033)。未观察到FPGS/GGH比值对MTX疗效及毒副作用的影响。结论 ALL患儿FPGS、GGH基因表达水平及其比值高于正常儿童;FPGS基因表达水平对ALL患儿大剂量MTX疗效及毒副作用有一定的影响。
叶酰多聚谷氨酸合成酶; γ-谷氨酰水解酶; 基因表达; 急性淋巴细胞白血病; 儿童
抗叶酸类药物甲氨喋呤(MTX)是儿童急性淋巴细胞白血病(ALL)巩固和维持化疗的重要药物,约80%的患儿对应用MTX治疗获得较好的临床反应,但仍有部分患儿出现耐药或者严重的毒性反应,需减少MTX剂量甚至终止治疗[1]。由于患儿间MTX药动学、疗效和毒性存在个体差异,临床通常监测MTX血药浓度指导个体化用药以提高疗效并减少毒副作用发生。叶酰多聚谷氨酸合成酶(FPGS)和γ-谷氨酰水解酶(GGH)是叶酸和叶酸拮抗剂细胞内代谢过程中的关键酶。FPGS催化叶酸及其衍生物、叶酸拮抗剂的聚谷氨酸化,GGH裂解叶酸及抗叶酸类药物多聚谷氨酸盐的谷氨酸残基,两者是维持体内叶酸平衡和细胞增殖必不可少的酶系[2]。MTX多聚谷氨酸(MTXPG)是MTX发挥抗白血病作用的重要活性形式,其水平高低是FPGS和GGH两者活性协同作用的结果,细胞内MTX和MTXPG的累积与白血病患儿化疗疗效和无病生存相关[3],因此两者活性及其比值在MTX体内抗白血病效应中起重要作用[4]。
FPGS和GGH均是MTX药动学中关键代谢酶,目前报道较多的是基因多态性、MTX耐药和药动学的研究,FPGS基因和GGH基因表达水平与ALL患儿临床结局是否存在相关性?非常有必要进行研究。
1 方法
1.1 研究设计 本文以病例对照研究设计,回顾性收集ALL患儿作为病例组,非造血系统恶性疾病儿童为对照组,比较两组FPGS和GGH基因表达;并分析ALL组FPGS和GGH基因不同表达水平亚组与MTX疗效、毒副作用及预后的相关性。
1.2 伦理和知情同意 本研究获得深圳市儿童医院(我院)生物伦理委员会审核同意。骨髓液采集及基因表达检测获得了ALL患儿家长的知情同意。
1.3 ALL诊断和分型标准 ALL的诊断、分型、危险度分型均符合中华医学会儿科学分会血液学组制定的方案[5,6]。
1.4 ALL组纳入标准及亚组 ①2003年1月至2013年12月我院血液科收治的ALL初发且留有化疗及输血前骨髓标本的病例;②采用大剂量 MTX(HD-MTX)化疗的病例,其中标危型和中危型患儿予MTX 2 g·m-2×4,高危型患儿予MTX 5 g·m-2×4)化疗的病例。并以ALL组FPGS、GGH基因表达水平及其比值的中位数,分为相应的高表达和低表达亚组。
1.5 对照组纳入标准 ①上呼吸道感染或儿童保健体检儿童;②与ALL组年龄、性别尽量匹配;③血生化检查的剩余血标本量足以行本研究基因检测。
1.6 ALL治疗方案 采用GZ2002 ALL方案或GD2008 ALL方案,应用HD-MTX+甲酰四氢叶酸钙(CF)方案预防髓外白血病,两方案HD-MTX+CF应用相同。HD-MTX治疗前要求一般情况良好,无严重感染;心电图、心肌酶谱、肝肾功能均正常,符合化疗条件。巩固化疗时标危型和中危型患儿接受4轮HD-MTX治疗,并每晚顿服巯嘌呤25 mg·m-2·d-1,高危型患儿接受2轮共4次HD-MTX治疗。所有患儿均用CF解救MTX毒性。HD-MTX化疗前使用止吐药;为防止口腔和肛周感染,化疗期间每日0.1%洗必泰溶液漱口,0.05%利凡诺溶液坐浴;为保护消化道黏膜,每日思密达含漱后口服。
1.7 不良反应统计 查阅病史评估每轮HD-MTX输注后至下轮开始间或每次HD-MTX输注后14 d内的毒副作用。毒副作用分级采用美国国立癌症研究所的第4版常规毒性判定标准,≥2级者为明显毒副作用。①外周血Hb、中性粒细胞和PLT评估骨髓抑制情况;②血清ALT、AST水平评估肝脏毒性;③SCr和BUN水平评估肾毒性;④以心率、心律、心功能情况及心肌酶谱水平评估心脏毒性;⑤以情绪障碍、失眠、严重头痛、惊厥和瘫痪等评估神经系统毒性反应;⑥以恶心、呕吐、腹泻、腹痛和肠梗阻等评估消化道毒性;⑦口腔黏膜损害单独作为一项进行评估。
1.8FPGS和GGH基因相对表达检测
1.8.1 总RNA提取及cDNA的制备 初次发病的ALL患儿骨髓液(白血病细胞比例>80%)1~1.5 mL,对照组儿童采集静脉血0.5~2 mL,使用QIAamp®RNA Blood Mini Kit(QIAGEN,德国)抽提总RNA,紫外分光光度计测定浓度和纯度。1 μg总 RNA使用禽成髓细胞瘤病毒逆转录酶(大连宝生物公司)逆转录获取cDNA, -80℃冻存,采用样本库标本一次性完成实验。
1.8.2 荧光定量PCR 根据FPGS基因的mRNA序列(NCBI序列号:M98045.1),GGH基因mRNA序列(NCBI序列号:NM_003878),采用Prime Premier 5.0 软件自行设计引物, BLAST比对NCBI数据库,以β-actin为内参。引物参数分别为:FPGS(上游引物:5′CATGGAGTACCAGG-ATGCCG 3′, 下游引物: 5′CGTGCCAGGTACAGTTCCAT 3′, 扩增片段长度130 bp);GGH(上游引物:5′CCAAGAAG-CCCATCATCGGAA 3′, 下游引物: 5′ACTGGTACAACTC-TCGCACC 3′, 扩增片段长度130 bp);β-actin (上游引物:5′CGCGGCTACAGCTTCACCAC 3′, 下游引物: 5′GGAAGCAGCCGTGGCCAT 3′,扩增片段长度112 bp) ;按照本实验室已建立的SYBR Green相对定量荧光定量PCR法进行:应用购自Roche公司的LightCycler®480 SYBR GreenⅠMaster, 总反应体系20 μL, 2×MasterMix 10 μL,上、下游引物(10 μmol·L-1)各0. 4 μL, RNase-Free Water 9 μL, RT反应产物0.2 μL。在LightCycler®480 Ⅱ荧光定量PCR 仪(Roche)进行扩增和分析,采用96 孔反应模块。每份标本均做3管平行检测(即3管检测β-actin基因作为内参, 3管检测目的基因),扩增参数为:95℃ 10 min, 再95℃ 10 s, 60℃ 25 s, 72℃ 20 s, 45 次循环。扩增完毕后,进行熔解曲线分析,95℃ 5 s, 65℃ 60s,以0.1℃·s-1的速度升温至97℃,连续监测荧光,对扩增产物进行特异性分析。使用LightCycler®480Ⅱ自带软件进行相对定量分析。

2 结果
2.1 一般情况 符合本文纳入标准的ALL患儿61例进入分析,男39例,女22例,发病年龄6月龄至13岁,平均年龄为4.6岁;BCP-ALL 58例,T-ALL 3例;2003至2005年ALL患儿诊断依据文献[5],标危型9例,高危型7例;2006至2013年ALL患儿诊断依据文献[6],标危型20例,中危型15例,高危型10例。61例均获CR,并完成了巩固化疗。符合本文对照组纳入标准30例进入分析,男19例,女11例,平均年龄 4.2岁(4月龄至12岁),ALL组和对照组年龄和性别匹配(P>0.05)。
2.2 ALL组与对照组FPGS及GGH基因相对表达水平比较FPGS、GGH基因扩增熔解曲线分析显示,PCR产物熔解曲线均为锐利的单一峰形,无其他非特异性峰形,说明扩增产物特异,无引物二聚体及非特异性产物产生(图1)。
图2显示, ALL组FPGS、GGH基因相对表达水平及其比值的中位数(P25~P75)分别为14.14(6.52~27.31)、9.34(4.97~14.22)和1.74(0.76~2.91),对照组分别为0.59(0.35~1.23)、3.00(0.94~5.26)和0.26(0.13~1.00),差异均有统计学意义(P均<0.01)。
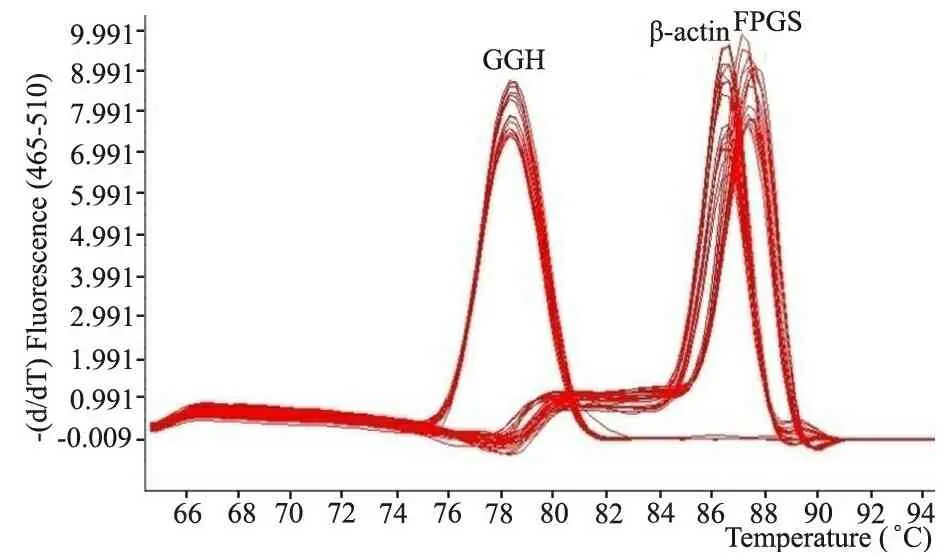
图1FPGS、GGH基因与β-actin相对定量熔解曲线分析
Fig 1 Melting curve analysis ofFPGS,GGHgene and β-actin in relative quantitative real-time PCR
Notes Single peak of melting curve analysis was displayed inFPGS,GGHgene and β-actin when carrying out relative quantitative real-time PCR by using method of fluorescence dye SYBR GreenⅠ, which showed that specificity of the quantitative real-time PCR was good

图2 ALL组与对照组FPGS、GGH基因相对表达水平
Fig 2FPGS,GGHgene expression andFPGS/GGHbetween ALL and control groups
Notes A: The median (P25-P75) expression ofFPGSgene in ALL group were 14.14(6.52-27.31), significantly higher than 0.59(0.35-1.23) in the control group;B: The expression ofGGHgene in ALL group were 9.34(4.97-14.22), significantly higher than 3.00(0.94-5.26) in the control group;C: The rate ofFPGStoGGHgene expression in ALL group were 1.74(0.76-2.91), significantly higher than 0.26(0.13-1.00) in the control group
2.3 ALL组FPGS、GGH基因表达水平及其比值与临床分型、疗效的相关性 表1显示,ALL组FPGS基因高表达亚组(FPGS/β-actin>14.88)30例,FPGS基因低表达亚组(FPGS/β-actin≤14.88)31例,两亚组患儿的年龄、性别、临床分型差异无统计学意义。FPGS基因高表达亚组WBC>50×109·L-1占10.0%(3/30),低表达亚组占22.6%(7/31),差异无统计学意义(χ2=1.761,P=0.185)。FPGS基因高表达亚组的CR率为90.0 % (27/30),低表达组为96.8 % (30/31),差异无统计学意义(χ2=1.213,P=0.271)。
ALL组61例中57例具有随访资料,57例随访14~60个月,中位随访时间27.7个月 ,有8例(14.0%)出现复发,其中FPGS基因高表达亚组复发率3.7% (1/27),FPGS基因低表达亚组为23.3%(7/30),差异有统计学意义(χ2=4.538,P=0.033)。FPGS基因高表达亚组无病生存率为86.7%(26/30),FPGS基因低表达亚组为74.2% (23/31),差异无统计学意义(χ2=1.501,P=0.221)。GGH基因表达水平及FPGS/GGH比值与临床分型、疗效的相关性差异均无统计学意义(P>0.05)。
2.4FPGS、GGH基因表达水平及其比值与MTX毒副作用的相关性 表2显示,FPGS基因高表达亚组与中性粒细胞减少的发生率相关(OR=4.17,95%CI:1.65~10.52,P=0.003),未观察到其他毒副作用与FPGS基因表达水平的相关性(P>0.05)。GGH基因高表达水平增加肝毒性的风险(OR=5.61,95%CI :1.14~27.47,P=0.033)。FPGS/GGH比值与毒副作用未见显著的相关性(P>0.05)。
表1 ALL患儿FPGS,GGH基因相对表达水平及FPGS/GGH与临床分型、疗效的相关性[n(%)]
Tab 1 Analysis of correlation betweenFPGS,GGHgene expression ,FPGS/GGHand clinical typing, chemotherapeutic effect in children with ALL[n(%)]

ItemsFPGSexpressionHigh(n=30)Low(n=31)PGGHexpressionHigh(n=30)Low(n=31)PFPGS/GGHexpressionHigh(n=30)Low(n=31)PM/F(n/n)19/1120/110.92318/1221/100.52918/1221/100.529Age/years4.34.70.6344.34.80.4094.74.40.629BCP/T⁃ALL(n/n)29/129/20.57327/331/00.07128/230/10.534WBC>50×109·L-13(10.0)7(22.6)0.1853(10.0)7(22.6)0.1858(26.7)2(6.5)0.044Completeression27(90)30(96.8)0.27127(90)30(96.8)0.27129(96.7)28(90.3)0.317Relapserate1/27(3.7)7/30(23.3)0.0333/27(11.1)5/30(16.7)0.5475/29(17.2)3/28(10.7)0.478EFS26(86.7)23(74.2)0.22124(80.0)25(80.6)0.94924(80.0)25(80.6)0.949
表2 ALL患儿FPGS,GGH基因相对表达水平及FPGS/GGH与MTX毒副作用的相关性[n(%)]
Tab 2 Analysis of correlation betweenFPGS,GGHgene expression ,FPGS/GGHand toxicity of drug in children with ALL[n(%)]

ItemsFPGSexpressionHigh(n=30)Low(n=31)ORPGGHexpressionHigh(n=30)Low(n=31)ORPFPGS/GGHexpressionHigh(n=30)Low(n=31)ORPNeutropenia15(50.0)6(19.4)4.170.00313(43.3)8(25.8)2.200.08112(40.0)9(29.0)1.630.273Anemia5(16.7)3(9.7)1.460.5184(13.3)4(12.9)0.750.6215(16.7)3(9.7)1.460.518Thrombocytopenia2(6.7)2(6.5)0.900.8842(6.7)2(6.5)0.900.8842(6.7)2(6.5)0.900.884Hepatotoxicity5(16.7)2(6.5)2,740.1606(20.0)1(3.2)5.610.0334(13.3)3(9.7)1.170.813Gatrointestinal7(23.3)12(38.7)0.490.13811(36.7)8(25.8)2,180.1138(25.8)11(35.5)0.830.699Oralmucosadamage5(16.7)1(3.2)4.230.0815(16.7)1(3.2)4.230.0813(16.7)3(9.7)0.600.452
3 讨论
MTX是经典叶酸拮抗剂,广泛应用于多种肿瘤的治疗。MTX本身的药理活性并不大,在体内必须经过一系列的酶催化过程才能发挥药理学作用。MTX结构类似叶酸,经还原型叶酸载体运输进入细胞后,在FPGS作用下连接上谷氨酸残基形成MTXPG,稳定地停留在细胞内,通过竞争性抑制二氢叶酸还原酶活性,也可间接抑制胸苷酸合成酶活性,使四氢叶酸产生受阻,一碳单位形成减少,影响核酸和蛋白质的合成,起到抗肿瘤作用[7]。另一方面,细胞内的MTXPG经GGH催化逐渐脱掉谷氨酸残基直至彻底还原为MTX,然后由ABC蛋白超家族转运出细胞。因此,MTXPG浓度受FPGS和GGH共同影响来维持动态平衡。
本研究显示ALL组的FPGS、GGH基因相对表达水平均显著高于对照组,且ALL组FPGS/GGH比值也显著高于对照组,FPGS、GGH的mRNA表达水平与其活性相关[4,8],提示白血病细胞中FPGS/GGH比值高更有利于MTXPG的形成,从而提高MTX药物疗效。有研究发现B-ALL患者的FPGS活性高于T-ALL患者[4,9],本研究由于T-ALL患儿病例数有限,未进行相关分析。
此外,通过比较分析ALL组FPGS、GGH基因表达水平及其比值与临床分型、疗效的关系时,观察到FPGS基因高表达亚组复发率(3.7%)显著低于FPGS基因低表达亚组(23.3%)。而GGH基因表达水平及FPGS/GGH比值与临床分型、疗效相关分析未得到阳性发现。有研究显示GGH基因高表达可过度地将MTXPG水解成MTX,再从细胞中释放至血液,减少细胞内MTXPG浓度和作用时间,降低疗效[10]。这提示FPGS作为合成MTXPG的关键酶,可能处于更为主导的地位,FPGS基因表达低时,合成MTXPG相对较少,MTX发挥的抗肿瘤效应也小,从而导致疗效不足,复发率高;而FPGS基因高表达的ALL患儿对化疗反应佳[11],且只有当FPGS表达较高致MTXPG达到一定量时,GGH基因表达水平及FPGS/GGH比值才可能发挥作用。
大剂量MTX治疗儿童ALL时毒副作用较为常见,但多轻微,其中骨髓抑制最为常见,其次为消化道反应、口腔黏膜损害等。FPGS基因高表达亚组与中性粒细胞减少的发生率有一定的相关性,FPGS基因表达水平升高使发生中性粒细胞减少的风险升高,Koomdee等[11]发现MTX血药浓度超过治疗阈值可能导致毒副反应增加。本研究还观察到FPGS基因高表达与口腔黏膜损害也可能有一定的相关性,FPGS基因高表达组的发生率(16.7%)高于FPGS基因低表达组(3.23%),P=0.081。GGH基因高表达水平增加肝毒性风险,P=0.033,处于临界统计学意义,这与既往研究报道结果不符[12],可能均与样本量小有关。未来需要设计更加严谨和大样本的研究,同时检测MTX血药浓度和GGH活性,验证GGH表达水平和活性与毒副作用的关系。
本研究结果表明对初发ALL患儿进行FPGS基因表达检测有一定的临床指导意义,其表达水平和复发率呈负相关,在一定程度上可作为判断化疗效果的预后因子。
本研究的不足之处和局限性:①动态检测MTX血药浓度,对于分析FPGS和GGH基因表达水平与MTX浓度的关系更有意义;②与MTX疗效,毒性和预后存在相关性除了FPGS和GGH代谢关键酶,还有MTX转运、作用靶点相关的还原型叶酸载体、胸苷酸合成酶、二氢叶酸还原酶、亚甲基四氢叶酸还原酶的基因多态性及表达水平[13~16]。
[1]Stanulla M, Schrappe M. Treatment of childhood acute lymphoblastic leukemia. Semin Hematol, 2009, 46(1):52-63
[2]Suthandiram S, Gan GG, Zain SM, et al. Effect of polymorphisms within methotrexate pathway genes on methotrexate toxicity and plasma levels in adults with hematological malignancies. Pharmacogenomics, 2014,15(11):1479-1494
[3]Whitehead VM, Shuster JJ, Vuchich MJ, et al. Accumulation of methotrexate and methotrexate polyglutamates in lymphoblasts and treatment outcome in children with B-progenitor-cell acute lymphoblastic leukemia: a Pediatric Oncology Group study. Leukemia, 2005, 19(4): 533-536
[4]Rots MG, Pieters R, Peters GJ, et al. The role of folylpolyglutamate synthetase and folylpolyglutamate hydrolase in methotrexate accumulation and polyglutamylation in childhood leukemia. Blood, 1999, 93(5):1677-1683
[5]The Subspecialty Group of Hematology Diseases,The Society of Pediatrics, Chinese Medical Association(中华医学会儿科学分会血液组) .Suggestion of diagnosis and treatment of acute lymphoblastic leukemia in childhood ( the 2nd revised version). Chin J Pediatr(中华儿科杂志),1999,37(5):305
[6]The Subspecialty Group of Hematology Diseases,The Society of Pediatrics, Chinese Medical Association(中华医学会儿科学分会血液组) .Suggestion of diagnosis and treatment of acute lymphoblastic leukemia in childhood ( the 3rd revised version). Chin J Pediatr(中华儿科杂志),2006,44(5):392-395
[7]Fotoohi AK, Albertioni F. Mechanisms of antifolate resistance and methotrexate efficacy in leukemia cells. Leuk lymphoma, 2008, 49(3):410-426
[8]Raz S, Stark M, Assaraf YG. Binding of a Smad4/Ets-1 complex to a novel intragenic regulatory element in exon12 of FPGS underlies decreased gene expression and antifolate resistance in leukemia.Oncotarget, 2014, 5(19):9183-9198
[9]Panetta JC, Sparreboom A, Pui CH, et al. Modeling Mechanisms of In Vivo Variability in Methotrexate Accumulation and Folate Pathway Inhibition in Acute Lymphoblastic Leukemia Cells. PLoS Comput Biol, 2010, 6 (12):e1001019
[10]Wang SM, Sun LL, Zeng WX, et al. Influence of genetic polymorphisms of FPGS, GGH, and MTHFR on serum methotrexate levels in Chinese childrenwith acute lymphoblastic leukemia. Cancer Chemother Pharmacol, 2014 ,74(2):283-289
[11]Koomdee N, Hongeng S, Apibal S, et al. Association between polymorphisms of dihydrofolate reductase and gamma glutamyl hydrolase genes and toxicity of high dose methotrexate in children with acute lymphoblastic leukemia. Asian Pac J Cancer Prev , 2012,13(7):3461-3464
[12]Chen X, Wen F, Yue L, et al. Genetic polymorphism of γ-glutamyl hydrolase in Chinese acute leukemia children and identification of a novel double nonsynonymous mutation. Pediatr Hematol Oncol, 2012, 29(4):303-312
[13]Canalle R, Silveira VS, Scrideli CA, et al. Impact of thymidylate synthase promoterand DNA repair gene polymorphisms on susceptibility to childhood acute lymphoblastic leukemia. Leuk Lymphoma, 2011, 52(6): 1118-1126
[14]Radtke S, Zolk O, Renner B, et al. Germline genetic variations in methotrexate candidate genes are associated with pharmacokinetics, toxicity, and outcome in childhood acute lymphoblastic leukemia. Blood, 2013, 121(26): 5145-5153
[15]Zintzaras E, Doxani C, Rodopoulou P, et al. Variants of the MTHFR gene and susceptibility to acute lymphoblastic leukemia in children: a synthesis of genetic association studies. Cancer Epidemiol, 2012, 36(2): 169-176
[16]Faganel Kotnik B, Grabnar I, Bohanec Grabar P, et al. Association of genetic polymerphism in the folate metabolic pathway with methotrexate pharmacokinetics and toxicity in childhood acute lymphoblastic leukaemia and malignant lymphoma. Eur J Clin Pharmacol, 2011, 67(10): 993-1006
(本文编辑:丁俊杰)
Study on the correlation between expressions of folypolyglutamate synthetase and gamma-glutamyl hydrolase genes and efficacy and toxicity of methotrexate in childhood acute lymphoblastic leukemia
LIYue1,WENFei-qiu1,CHENXiao-wen2,MAIHui-rong1,YUANXiu-li1,LIChang-gang1
(1DepartmentofHematology, 2ShenzhenInstituteofPediatrics,ShenzhenChildren'sHospital,Shenzhen518038,China)
Corresponding Author:WEN Fei-qiu,E-mail:fwen62@126.com; CHEN Xiao-wen,E-mail:cxwbrian@aliyun.com
ObjectiveThe activities of folylpolyglutamate synhase (FPGS) and gamma-glutamyl hydrolase (GGH) dynamically determine the intracellular concentrations of methotrexate(MTX) and its active metabolites, methotrexate polyglutamates (MTXPG), in ALL cells, is the key determinant of its antileukemic effects. To investigate whether the expressions ofFPGS,GGHand the ratio ofFPGStoGGHgene expression between pediatric patients with ALL and the normal control children are different, and if they are correlated with chemotherapeutic efficacy of MTX in ALL patients. Methods The children newly diagnosed with ALL at Shenzhen Children's Hospital were recruited as ALL group, children with nonmalignancy as the control group. Bone marrow samples from ALL group and peripheral blood samples from the control group were analyzed for the expressions ofFPGSandGGHgenes by SYBR Green relative quantitative real-time PCR. The difference ofFPGSandGGHgene expressions was compared between ALL group and the control group. The subjects were divided into high- and low-expression subgroups according to the median ofFPGSandGGHexpression level,the discrepancies of MTX effect, toxicity and prognosis were analyzed by different expression subgroups ofFPGSandGGH.ResultsSixty-one children with newly diagnosed ALL at mean age 4.6 years were enrolled in this study, including 39 males and 22 females; thirty children averagely aged 4.2 years were enrolled in the control group, including 19 males and 11 females. The median (P25-P75) expressions ofFPGS,GGHand the ratio ofFPGStoGGHgene expression in ALL group(FPGS/β-actin,GGH/β-actin,FPGS/GGH)were 14.14(6.52,27.31),9.34(4.97,14.22) and 1.74(0.76,2.91), significantly higher than 0.59(0.35-1.23),3.00(0.94-5.26) and 0.26(0.13-1.00) in the normal group(P<0.01). The recurrence rate was 3.7% (1/27) in the subjects with higherFPGSgene expression verse 23.3% in those with lower gene expressions (P<0.05). High expression ofFPGSgene was correlated with higher risk of neutropenia(OR=4.167,95%CI:1.65-10.52,P=0.003). High expression ofGGHincreased the risk of hepatotoxicity(OR=5.61,95%CI =1.14-27.47,P=0.033). No correlation was found between the ratio ofFPGStoGGHgene expression and chemotherapeutic effect, toxicity of MTX in this study.ConclusionThe expressions ofFPGS,GGHand the ratio ofFPGStoGGHgene expression in ALL children were higher than that in the control children. Expression ofFPGSgene is associated with chemotherapeutic effect, toxicity of MTX in ALL children.
Folypolyglutamate synthetase; Gamma-glutamyl hydrolase; Gene expression; Acute lymphoblastic leukemia; Childhood
深圳市科技创新委员会基础研究项目:JCYJ20130401114111456;深圳市科技创新委员会技术创新计划:CXZZ20130320172336579
广东省深圳市儿童医院 1 血液科,2 儿科研究所 深圳,518038
文飞球,E-mail:fwen62@126.com; 陈小文,E-mail:cxwbrian@aliyun.com
10.3969/j.issn.1673-5501.2014.06.007
2014-10-17
2014-12-02)

