植物晶体的形态结构、生物功能及形成机制研究进展
朱广龙,马 茵,韩 蕾,霍张丽,魏学智,*
(1. 山西师范大学生命科学学院, 临汾 041000; 2. 华中农业大学植物科学技术学院, 武汉 430070)
植物晶体的形态结构、生物功能及形成机制研究进展
朱广龙1,2,马 茵1,韩 蕾1,霍张丽1,魏学智1,*
(1. 山西师范大学生命科学学院, 临汾 041000; 2. 华中农业大学植物科学技术学院, 武汉 430070)
晶体是植物体内产生的一种具有特殊形态结构与生理功能的代谢物,其分布广泛,已在500多种植物中发现有晶体的存在。晶体形态多样,有针晶、柱晶、棱晶、砂晶、簇晶等;类型丰富,有草酸钙晶体、钟乳体、硅质体、硫酸钙晶体及其它类型的晶体;功能特殊,具有钙调节、植物保护和防御、重金属解毒、离子平衡、缓解逆境胁迫及其它多种生物功能。晶体的形成涉及钙离子的体外吸收和体内转运,草酸的生物合成,以及钙离子和草酸的耦合过程;晶体的生长发育涉及液泡、晶异细胞的调控及与其它细胞结构的相互协作。对晶体的研究进行综述,以期为晶体的进一步研究提供基础资料。
晶体;形态结构;生物功能;形成机制
显微镜的发明为微观世界的探索和科学的发展起到非常重要的作用。Frey在1929年就发现植物体内有晶体的存在[1]。Foster 1956年将可以产生晶体并专事于这种功能的细胞称作含晶异细胞(crystalidioblast),简称含晶细胞[2]。在不同植物和同种植物的不同组织中都可观察到晶体,至今所观察到的晶体大部分都聚积在特化的细胞——晶异细胞的液泡中[3]。植物的草酸钙晶体被认为是首先通过光学显微镜观察而被报道的晶体之一。自此之后在自然界陆续发现了各种草酸钙晶体[3],如岩石、土壤以及所有五界生物(原核、原生、真菌、植物、动物界)中,尤其是在从海洋藻类[4]到陆地被子植物[5]都有草酸钙晶体的发生。大部分的晶体都是由来自于环境中的钙和生物体内合成的草酸形成的[3]。到目前为止, 已在500多种植物体内发现了草酸钙的沉积, 其中90%的目属于高等植物, 80%的目属于被子植物, 50%的目属于双子叶植物[6- 26], 其主要存在于维管束植物中(图1)[27]。晶体在植物体内如此广泛的存在,必定有重要的生物学功能,有研究表明晶体的形成是植物体内正常的代谢过程[28],也有研究指出晶体在植物适应逆境中具有重要的作用[29- 35]。本文主要论述晶体的类型、生物学功能和产生的机制等,以期对晶体的功能和形成机理有进一步的认识,为晶体生物学的研究提供参考和基础资料。
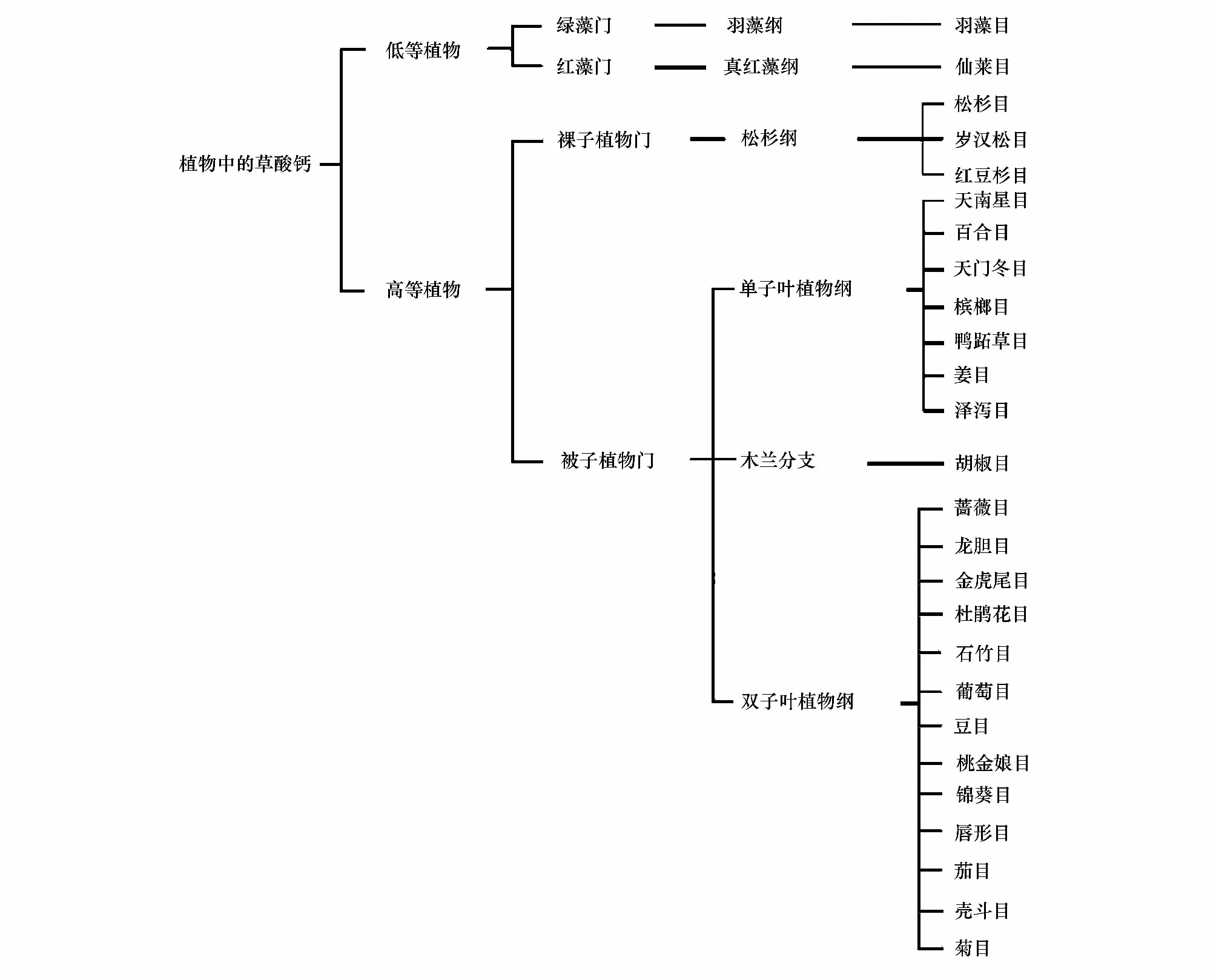
图1 草酸钙晶体在植物中的分布[27]Fig.1 The distribution of Calium oxalate crystal in plant[27]依据APGⅢ分类法
1 植物体晶体的类型和形态结构
自20世纪80年代以来, 随着对生物大分子活性结构的深入了解,晶体学也逐渐成为研究的热点, 这些研究促进了结构植物学的长足发展。在植物的根、茎、叶等器官中均研究发现有晶体的存在,植物的含晶结构中可以产生多种晶体, 这些晶体一般被认为是后含物。后含物是指细胞在生活过程中产生的各种代谢产物或无生命活性的物质。其中, 不少后含物在植物细胞中形成结晶, 在每种植物的生长发育过程中, 组织细胞所含的结晶类型、形状及大小是比较稳定的, 但结晶体在不同科、属的组织中,其形态、大小、分布等均有一定的差异[36]。
1.1 晶体的类型
1.1.1 草酸钙晶体
含晶细胞中晶体的主要成分大多数是草酸钙[29]。植物中的草酸钙沉积较普遍,植物中有超过215个科的成员在组织中有草酸钙晶体聚积,其中约54%为热带植物,3%为热带-亚热带植物,1%为亚热带植物,2%为亚热带-温带植物,18%为温带植物[30]。产生草酸的植物(包括很多农作物)可聚积3%—80%干重的草酸,植物中大概有90%的钙可以在草酸盐中发现[31- 32]。草酸钙沉积的主要部位分布在植物的叶片、茎、种子、苞片、花药、根等器官中的晶异细胞中[9,23,33], 另外还可形成在特定的组织或细胞类型中, 如通气组织和石细胞[34]。
根据研究中常见的草酸钙晶体的形态,可分为以下5类(图2[26]和图3[35]):(1)针晶,为细小针状结晶, 常排列不规则而充塞于细饱中。少数聚集成球状针晶丛或狭长延伸的针状晶体束(图2:e,h;图3:e);(2)柱晶,一个有锐利末端的延伸的晶体,可能延伸成立方体、四方柱状或棱柱状,两端平截或呈三角锥状, 少数呈斜尖或分叉状。在有些植物中柱晶的排列较有规律, 如白桐树及淫羊霍, 柱晶多沿茎或叶的轴向分布,因而只有在纵切面才可见其全形[37](图3:c,d); (3)棱(方)晶,形状多样,有类方形、角锥形、菱形、多面形或不规则块状, 多存在于薄壁组织中(图2:a,b,c;图3:a,b);(4) 砂晶,单个细胞中由很多微小的、单独的晶体组成的结晶块;(5)簇晶,为许多棱形或角锥形结晶聚集而成的晶簇, 小单晶的尖端突出在整个表面,簇晶的大小及棱角角度的大小等具有鉴别意义, 如刺五加与无梗五加粉末的区别[37](图2:d;图3:f)。晶体的其它形状似乎是这些形态的变异或中间体[38]。草酸钙晶体无器官、组织特异性,有时数种形态的晶体有可能在同一植物的同一或不同组织或器官中并存。植物

图2 植物体内草酸钙晶体的形态[26]Fig.2 The morphology of Calium oxalate in plant[26](a)香蕉叶柄中分离出的棱晶The prism isolated from petiole of Musa cavendishit;(b)大豆种皮中分离到的棱晶The prism isolated from coat of Soybean;(c)番茄叶片中分离到的假四面体棱晶The pseudotetrahedral fourlings crystals isolated from blade of Lycopersicon esculentum;(d)椒草叶片栅栏组织中的晶簇 The vug distributed in palisade tissue of Peperomia.;(e)美洲葡萄叶片中分离出的针晶束The raphid isolated from blade of Vitis labrusca.;(f)光学显微镜下晶异细胞内的针晶束(R)和与针晶束相连的有机质(M)The raphid linked with organic matter in crystal idioblast;(g)香蕉叶片中分离出的晶异细胞(细胞内包含针晶束)The crystal idioblast isolated from blade of Musa cavendishit;(h)晶异细胞内露出的针晶束(h) The raphids were emited from crystal idioblast

图3 不同地区酸枣叶片分泌的晶体的形态[35]Fig.3 The morphology of crystal excreted from blades of Zizyphus jujube in different regions[35](a)不规则棱晶Irregular edge prism crystal;(b)正六棱体晶体Six-sided prism crystal;(c)正棱柱体晶体Regular edge prism;(d)长棱柱体晶体Long prismatic crystal;(e)针晶Raphid;(f)簇晶Vug
中的草酸钙主要以2种水合状态存在,即一水合物CaC2O4·H2O (水草酸钙石)和多水合物CaC2O4·(2+x)H2O(草酸钙石)[39]。两者具有不同的结构,一水合物属于单斜晶系而多水合物属于四方晶系[30,39]。
1.1.2 钟乳体
钟乳体呈棒锤形、长圆球形或圆球形, 表面具有不规则层状波纹及小瘤状突起, 常具有纤维素柄而与细胞壁相连结,其主要成分是CaCO3。在植物体内,钟乳体多存在于叶或茎的表皮细胞或毛茸基部的细胞腔内。少数植物如球花马蓝等的皮层、韧皮部及髓部也有沿茎轴向排列的钟乳体[37]。
1.1.3 硅质体
硅质体的主要成分是SiO2。硅质体多为圆簇状小团块, 除氢氟酸外不溶于其它任何酸。其多存在于表皮细胞或薄壁组织中, 少数分布在纤维束周围的细胞中而类似晶鞘纤维(如石解)或存在于种皮厚壁细胞腔内(如姜科)[37]。
1.1.4 硫酸钙结晶
怪柳科植物无草酸钙结晶,而具簇晶状或棱晶状石膏结晶, 这种晶体的主要成分为CaSO4,有的形成晶鞘纤维(如西河柳)。
1.1.5 其它类型的晶体
除上述常见的晶体外,还存在其它类型的晶体。这些晶体从化学结构组成上属于有机物类晶体,主要有以下几种:(1)菊糖,分子式(C6H10O5)n, 为吠喃果糖聚合物,球形或半球形结晶, 表面观具放射状线,主要分布在桔梗目(桔梗科、菊科)。(2)橙皮甙,分子式C28H34O15,为二氢黄酮甙,聚集成球簇状、树枝状或羽毛状淡黄色针状结晶, 主要分布于芸香科, 此外在冬青科、唇形科及菊科的某些属中也有分布。(3)蛋白质拟晶体,为黄褐色或红色,存在于复合糊粉粒中, 其外部有无定形蛋白质薄膜, 内含一个球晶体和一至数个拟晶体或仅含拟晶体。拟晶体并不是真正的晶体, 而是蛋白质结合了结晶和胶体的性质而形成的一种多角形或类方形的实体。(4)植酸,马槟榔种子糊粉粒中的球晶体主要成分为植酸。另外在一些少数植物中还存在不常见的晶体,如荻蓝叶肉细胞中含细小颗粒状或片状蓝色靛蓝结晶,肉豆蔻中析出的针簇状或羽毛状结晶。
2 晶体的功能
随着科学技术的发展和研究的不断深入,人们对植物体中晶体功能的认识不断提高。最初人们认为草酸钙晶体是植物体内新陈代谢的最终垃圾产物对生物体内有毒害作用[28]。然而后来的研究表明,晶体并不是植物体内代谢的垃圾产物,其在植物体内具有多种重要的功能[29- 35,39]。晶体是植物体内产生的一种具有特殊形态结构与生理功能的代谢物。晶体形态和大小的多态性及其时间和空间的分布特征,引发形成了许多有关植物内晶体功能的假说。其可能的功能涉及到钙调节、离子平衡(如Na+、K+)、植物防御、组织支撑和植物硬度、解毒(如重金属或草酸)、光的聚集和反射及植物逆境的适应等。
2.1 Ca调节功能生
Ca是一种重要的基本植物营养元素,植物对其需求形式是以离子形式表现出来的。大多数植物通过特殊的细胞器如内质网、液泡、叶绿体和线粒体的吸收来调节胞质Ca2+水平,或主动将Ca2+泵入质外体中[40]。作为胞质第二信使,Ca2+连接一定范围内的外界刺激与生理反应。一般认为,含晶细胞的主要功能是一个局部钙库,可减少毗邻细胞周围质外体中Ca 浓度[41- 42]。外源Ca2+可诱导大量草酸钙晶体的快速生成(在1 h之内),生成晶体的大小及数量随着植物生长环境中Ca 浓度的变化而变化[41- 42]。Volk等研究认为针晶体的形成可能有双重功效:一是Ca调节,二是植物防御;而晶簇(球形)的形成则只与Ca 调节有关。晶簇的形成是种动态过程,与Ca水平的波动相互响应:当Ca 水平高时,晶簇的大小和数量迅速增长;而当Ca受限制时,晶簇的大小和数量则减少。其分解出的Ca可便于植物利用[43],以此推测,晶体可能是Ca的临时储存单位。晶体随Ca源这种结晶以及溶解的现象在很多植物中都有存[42,44- 45]。
2.2 植物保护和防御
晶体具有多种形态结构,这与其保护防御功能有关[46]。在瞪羚(Gazelladorcas)食草性的研究中观察到,全能花属植物Pancratiumsickenbergeri只有其叶片的尖端受到啃食,而叶片的尖端是整个叶片中唯一无针晶的部分[47]。Ruiz等2002年研究发现生长在放牧最多的地方的植物含有的晶体最多,而生长在放牧最少的地方的晶体积聚较少或没有晶体;且剪下的或受损伤的植物叶片中草酸钙的积聚并没有增加,这表明,在这种情况下,晶体的形成是非诱导性的[46]。这样看来,此研究中晶体的形成可能是一个进化的程序化过程,晶体的形成也可能是植物对取食压力的响应[46]。某些植物的草酸钙晶体有倒钩和凹槽[34],被取食后晶体突出物会刺激食草动物的黏膜[47],凹槽释放化学刺激物(如一类有毒的蛋白水解酶或葡糖苷)进入动物伤口[5],从而避免被取食伤害。由此看来,这些结构可能有防止被取食的威慑作用。
2.3 重金属解毒
酸性土壤大约占全世界可耕地面积的40%, 酸性土壤中铝的毒性是限制农作物产量的一个主要问题。微摩尔浓度的铝就能抑制植物根的生长并影响植株体内营养物质和水分的平衡[48]。植物可合成有机酸(如柠檬酸、苹果酸和/或草酸)与游离的重金属离子结合为非活性态以增强其对重金属的耐受[49]。有些植物用草酸(盐)解除环境中有害金属的毒性,如铅、铝、锶和镉等。此类作用于植物生长环境的金属,通常将重金属结合成草酸盐晶体[50- 52]。
2.4 离子平衡
某些植物的有机酸影响离子吸收和离子平衡。草酸是许多植物的主要有机酸,可能在离子平衡中起特殊作用[53]。荞麦中Ca的聚集可引发草酸增加;且高钾水平下形成的草酸盐较少[54]。晶体能螯合除去植物体内多余的草酸[38],因而,含晶细胞中草酸盐晶体的形成可能有助于调控植物体内的离子平衡[19]。
2.5 缓解逆境胁迫
含晶细胞的广泛存在暗示了含晶异细胞具有重要的生理功能。越来越多的实验证据表明草酸盐、草酸盐氧化酶及其草酸被分解后的产物都参与植物正常的生理生化代谢及其抗逆反应[55]。含晶细胞多集中在沙生、旱生植物的叶和轴器官中,荒漠植物中的含晶细胞被认为是其抗旱结构特征之一, 推测它们可能与荒漠植物适应干旱和盐碱环境有关[56- 58]。这些沙生、旱生植物中的含晶细胞有较高的渗透势,吸水能力强,在外界环境水分状况较好和导管中水分输导良好时,它们可以吸收并贮存水分;当外界环境干旱时,导管中水分输导受阻而不能正常供给植物体内各部分对水分的需求时,此种结构组织可为其周边细胞提供一个较为湿润的小环境,从而提高植物的抗旱性[56- 58]。从几种荒漠植物的解剖结构可以看出, 晶体主要在栅栏组织、贮水组织和维管束中出现, 这符合形成晶体的相关离子(Ca2+)从土壤到根、茎、叶的运输过程[19]。徐静静等对天津盐渍化生境54种植物钙晶体的研究表明,草酸钙晶体在落叶乔、灌木抵御盐分胁迫中发挥着重要作用[59]。
2.6 其它功能
遮荫植物椒草属(Peperomia)的叶片具厚而清晰的多层上皮层(即“窗口组织”),叠加在栅栏组织细胞上形成光合作用层。每个栅栏细胞中都具有含晶簇的液泡。晶簇是一个由中心向外各个方向辐射的小平面聚集而成的多面体球形(图3:f)。据推测这种弱光适应性植物的晶体结构有助于将光平均分配给沿着边缘壁排列和围绕在液泡周围的叶绿体中,也可能将多余的光反射回“窗口组织”,以驱散间歇光照时的间歇光[59]。
水生植物中,通常含有与通气组织相关的草酸钙晶体,有时晶体会伸入气腔(air space)中,如天南星科(Aracea)和香蒲属(Typha)的针晶体等[19]这类晶体可能与气腔的形成有关[5]。
在许多药用植物中,根据晶体的类型和结构特征,可以作为药材鉴别的依据。药材植物种类繁多,所含晶体的形状、大小、数量、分布疏密、排列方式、所处位置等因植物而异, 这对不同药材的原植物真伪、代用品的鉴别有重要意义。如人参中只有簇晶、其伪品华山参有砂晶;亲缘关系极近的川黄柏和关黄柏的横切面上, 维管束周围都有方晶, 但关黄柏多于川黄柏, 便于区别;怀牛膝的薄壁细胞中含砂晶, 而川牛膝中的砂晶多聚积在细胞的角隅处;药用大黄、掌叶大黄、唐古特大黄的根茎中所含的簇晶最大直径分别为155、135、106 μm, 有利于三者的鉴定区别;茜草中的针晶长、轴多呈平行,甘草中的方晶长轴多呈纵向排列,葛根中的方晶长轴多呈横向排列, 何首乌中的簇晶与大晶方晶共生, 桑寄生中的方晶存在于石细胞中[37]。
3 晶体的形成机制
植物体内草酸钙晶体是内源合成的草酸和外源吸收的钙离子共同反应的产物, 这一过程并不是简单的化学沉淀过程, 而是受严格的遗传调控[34]。草酸(C2H2O4)容易和钙结合成难溶的草酸钙, 当溶液处于过饱和态时就会形成晶体。由此可见,晶体的形成包括体内草酸的合成和体外钙离子的转运两个过程。
3.1 草酸的合成
草酸是植物体内一种简单的二元酸,其合成的部位主要是细胞质和液泡[60]。早期的研究证明植物有机酸(包括草酸)的产生与植物的光合作用和碳水化合物代谢有关。大量实验表明草酸不是植物体光合作用的直接产物, 而是由光合作用的产物作为前体合成的[34]。草酸的生物合成主要包括以下途径(图4[55]): ①在光呼吸过程中, 1,5-二磷酸核酮糖被氧化形成乙醇酸, 乙醇酸再转化为乙醛酸。②在乙醛酸途径中, 异柠檬酸裂解形成乙醛酸。③在微生物体内主要通过草酰乙酸的裂解来合成草酸, 在非绿色植物中也可能利用此途径合成。④ L-抗坏血酸可作为合成草酸的底物[61]。通过放射自显影证明只有L-抗坏血酸可用于草酸钙含晶异细胞的形成。但是在含晶异细胞中没有发现乙醛酸氧化酶的存在, 所以由抗坏血酸转变成草酸的途径当时还不清楚(图4)[55]。后来进一步的研究表明合成草酸的前体物质可能是抗坏血酸, 通过14C标记证实L-抗坏血酸用于合成草酸并最终形成草酸钙晶体[62- 64]。抗坏血酸合成草酸在晶异细胞内完成, 合成反应受钙水平的调控[65- 66]。
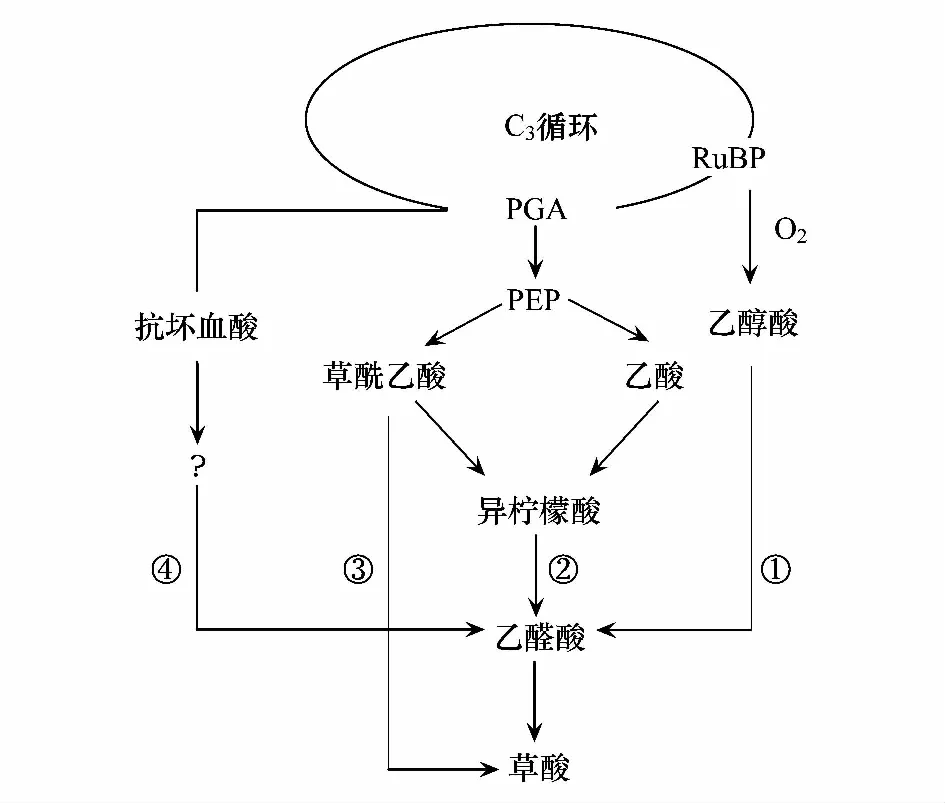
图4 植物体内草酸钙的合成途径[55]Fig.4 Pathways for plant oxalate biosynthesis
3.2 钙的转运
植物根系与土壤中的离子吸附交换后通过质外体途径和共质体途径转运。吸收的钙离子通过钙离子通道在Ca2+-ATP(三磷酸腺苷, adenosine triphosphate)酶和Ca2+/H+反向转运子的参与下,通过跨越内皮层凯氏带和木质部薄壁细胞组织进行运输[67]。部分Ca2+可由离子通道流进内皮层细胞, 这部分钙离子有两种去向, 一种是通过共质体途径到达木质部薄壁细胞组织, 需要Ca2+-ATP 酶驱动进入中柱质外体;另一种是由内皮层细胞运出, 沿内皮层内侧的质外体途径进入木质部导管, 并通过导管沉积在植物器官中[69]再随质外体途径由木质部流通到细胞间进行再次分配[68- 69]。胞内钙离子浓度的增加为草酸钙晶体的形成提供了充足的钙源,而钙浓度的变化对草酸钙晶体的形态及水化状态都具有影响[43]。
3.3 晶体的形成
晶异细胞是形成草酸钙晶体的场所。晶异细胞的细胞质中含有大量的高尔基体、线粒体、内质网、特化质体及与液泡内晶体相连的独特膜结构[34,69- 70](图3a)。高尔基体和线粒体为细胞的快速增长提供能量, 而内质网与细胞内合成草酸钙密切相关[69]。植物体内的钙离子主要是通过质外体即木质部流进入叶肉细胞壁内, 然后通过细胞壁上的钙通道或泵进入内质网[69], 最终由内质网输送到液泡内。与此同时草酸(盐)也向液泡内运输, 它主要是在含晶异细胞的细胞质或者液泡合成[60], 但是合成的亚细胞位点不清楚。如果草酸盐在细胞质合成,主要由液泡膜上的通道或者运输工具转入液泡内与钙离子结合形成草酸钙沉淀。如果草酸在液泡产生,其中草酸盐的主要前体L-抗坏血酸可以在叶绿体内大量合成包括所有的细胞壁, 因此处于细胞壁上的由L-抗坏血酸合成的草酸盐可以与钙离子结合形成草酸钙晶体。位于叶绿体内的L-抗坏血酸合成草酸盐后可能通过细胞壁上的通道进入邻近异细胞的细胞质, 参与草酸钙晶体的形成, 其运输的具体机制尚不清楚[71]。
晶体的形成是多个过程协调的结果。基质Ca2+增加后, 质外体Ca2+浓度也增加, 从而启动异质细胞的分化, 细胞从抑制钙积累模式转为钙吸收模式。钙通道阻遏物可以抑制晶体的形成,用荧光标记的通道蛋白阻遏物使异质细胞带上标记, 这就证明异质细胞利用钙通道蛋白从质外体吸收Ca2+[69]。液泡积累Ca2+的同时, 草酸被运输到液泡。液泡中的小室控制着晶体生长的速率、方向和形态, 非晶体基质也有调控作用。从晶体中分离出来的基质蛋白质可以促进晶体沉淀, 基质可能充当最初的成核物质, 决定晶体生长方向和形态[72]。
含晶细胞表现出的特征包括:一个增大的核、特化的质体、增多的内质网、高水平的rRNA及独特的液泡成分(图5:a)[38]。细胞核和核仁的扩大是含晶细胞发育过程中观察到的最初变化之一,此时,胞质密集,且富含细胞器和小泡;与周围细胞相比,质体变小并且几乎无基粒(图5:c)[38]。在含晶细胞发育过程中,发现一些与晶体腔相关的结构—微管,如在九节属植物Psychotriapunctata的中心液泡中,发现有大量直径在10—13nm的微管,通常平行于发育中的晶体腔存在[37]。作为细胞骨架元件的微管,可调节生长细胞的形态[73]。含晶细胞(如针晶体和柱状晶)在晶体生长时会有所延长,因而研究者们推测微管可能作用于调节晶体和细胞的生长[3]。在晶体快速生长时期,对晶体和细胞生长的细致的调节是极为重要的。
晶异细胞中含有许多小囊泡(图5:d箭头所示), 这些小囊泡可能是通过融合方式调节腔膜形成的(图5:d插图箭头所示)[70]。膜腔和包裹膜腔的基质分子能调控晶体的形成[28,43,70]:主要是通过调节钙和草酸进入空腔的速率来控制晶体的生长速度和形貌[43]。从晶异细胞中分离出的基质蛋白含有大量的酸性氨基酸,具有较强的结合钙的能力[74], 这将影响晶体成核、成核后的生长及最终的形貌。液泡调控晶体的形貌, 同时协调晶体生长和细胞增大。通常当晶异细胞膨胀到最大尺寸时, 晶体就会停止生长[34]。但对于晶体不同形貌的分化机制还有待进一步的研究。
综上所述,晶体的合成和调控机制如图6所示,植物吸收的钙离子通过钙通道和离子泵,完成跨膜转运到达内质网,由内质网输送到液泡中;与此同时细胞质和液泡特定部位合成的草酸也转运到液泡中。钙离子和草酸进入液泡后被转运到晶异细胞的特定部位,在各细胞器的共同协调作用下形成晶体。晶异细胞的高尔基体和线粒体为晶细胞的快速增长提供能量,晶异细胞的微管和基质蛋白及液泡中的小室控制着晶体生长的速率、方向和形态;晶异细胞中的内质网和小囊泡主要通过调节钙和草酸进入空腔的速率来控制晶体的生长速度和形貌。由此可见晶体合成及生长主要通过晶异细胞内部微管、基质蛋白和液泡的共同作用进行主调控,其次是通过小囊泡调节钙离子和草酸的转运速率来进行副调控。
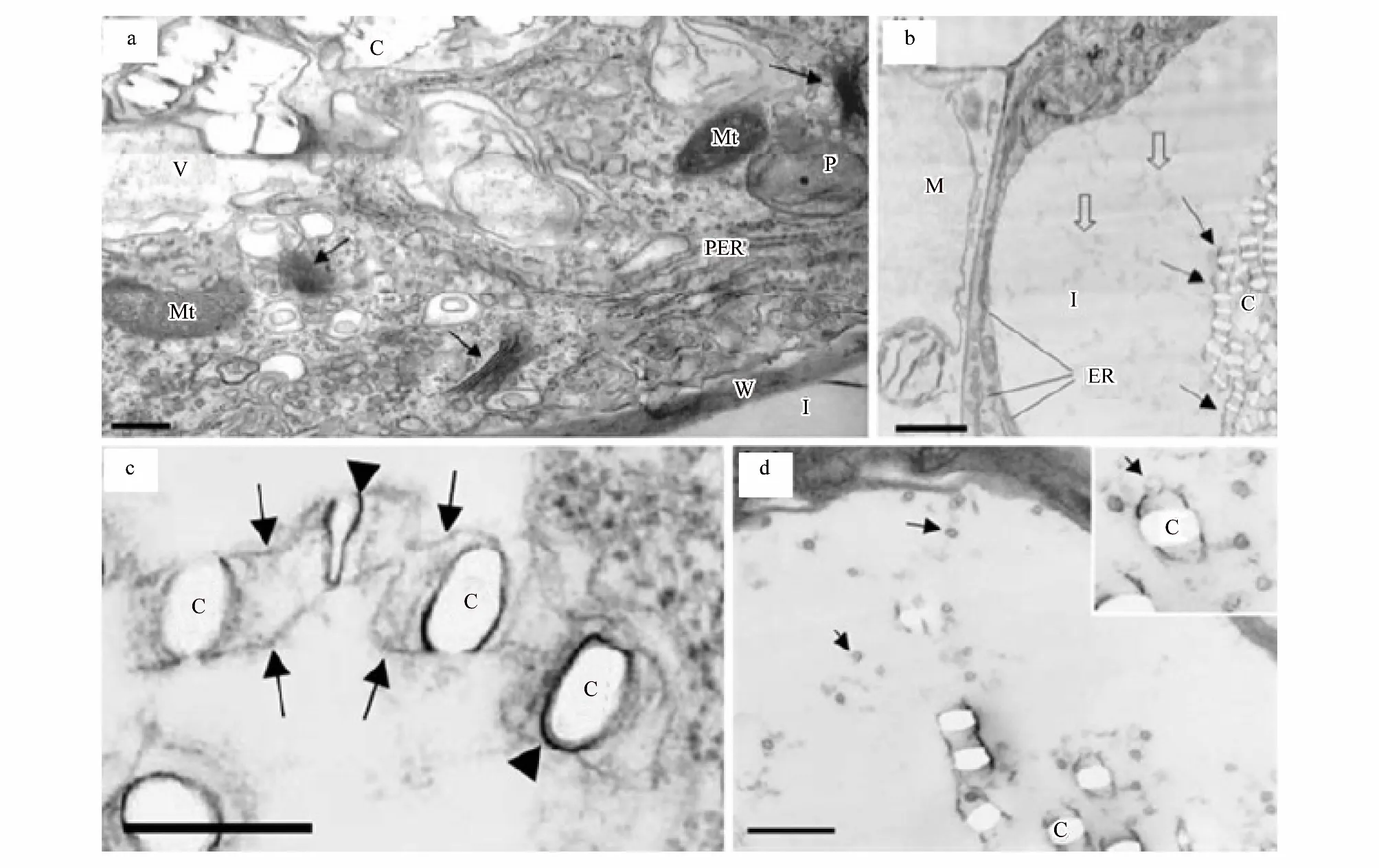
图5 草酸钙晶异细胞的透射电子显微镜图[38]Fig.5 crystal idioblast of calcium oxalate was observed under transmission electron microscopy[38](a)晶体存在于晶异细胞的液泡中,晶异细胞的细胞质中含有大量的线粒体、质体、光面内质网、高尔基体(箭头所示)和其它膜结构,标尺为1um;(b)晶异细胞及相邻叶肉细胞的横切面,在晶异细胞中晶体存在于液泡中并在膜的作用下排成纵列(箭头所示),液泡中含有许多絮状物质(空心箭头所示),细胞质中含有丰富的内质网,标尺为2um;(c)一列正在形成的晶体,每个晶体的两侧都膜包裹(无尾箭头所示),标尺为0.25um;(d)晶异细胞中含有许多小囊泡(箭头所示),小囊泡与膜腔的一端融合,标尺为1um;图(a)为大藻,其余为浮萍;M:叶肉;C:晶体;I:晶异细胞;Mt:线粒体;P:质体;V:液泡;W:细胞壁;PER:粗面内质网;ER:内质网(a)crystals exist invacuole of crystal idioblast which contains majority of Mt, P, ER, Golgi apparatus and others membrane structure, bar is 1 um; (b)the transection of crystal idioblast and its adjacent mesophyll cell,with the help of membranous, crystals align tandem(arrows show), vacuole contains numerous flocculent material(open arrows show),abundant ER distribute in cytoplasm, bar is 2 um; (c)the forming crystals and its two sides were pack by membrane(anury arrows show), bar is 0.25 um; (d)crystal idioblast contains a large amount of Capsule bubble,which were fusing with one side of membranous Cavity, bar is 1 um; the plant of(a)is Pistia stratiotes,and others is lesser duckweed; M: mesophyll; C: crystals; I: crystal idioblast; Mt: mitochondria; P: plastid; V: vacuole; W: cell wall; PER: rough endoplasmic reticulum; ER: endoplasmic reticulum
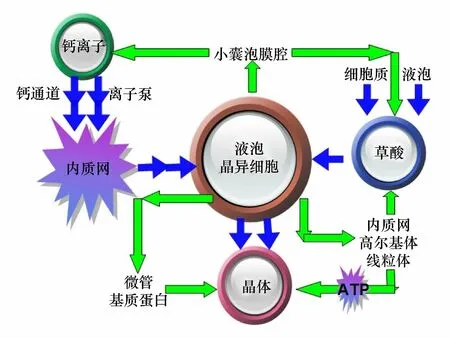
图6 晶体的合成与调控Fig.6 The synthesis and regulation of crystal图中蓝色路线为晶体合成途径,绿色路线为调控途径
4 展望
对晶体的研究日益完善现已逐步形成一门学科,且与其它学科交叉发展,利用材料化学的方法可以模拟合成一些简单的晶体用作纳米材料。现有的研究对晶体的形态结构和基本功能阐述较清楚,但对晶体发育过程中一些精细的调控机制和合成的亚细胞位点仍需进一步的研究。掌握这些机制,就可以体外模拟合成和体内诱导生成晶体,这对晶体材料的开发利用具有重要的意义。
致谢:感谢华中农业大学植物科学技术学院彭少兵教授对本文写作的帮助。
Reference:
[1] Frey A. Calciumoxalat-monohydrat und trihydrat// Linsbauer K, ed. Handbuch der Pflanzenanatomie (Vol. 3). Berlin: Gebruder Borntraeger, 1929: 82- 127.
[2] Foster A S. Plant idioblasts: remarkable examples of cell particles from photosynthetic tissue. Ⅱ. Oxidative decarboxylation of oxalic acid. Physiologia Plantarum, 1956, 7: 614- 624.
[3] Nakata P A. Advances in our understanding of calcium oxalate crystal formation and function in plants. Plant Science, 2003, 164(6): 901- 909.
[4] Friedmann E I, Roth W C, Turner J B, McEwen R S. Calcium oxalate crystals in the aragonite-producing green alga Penicillus and related genera. Science, 1972, 177(4052): 891- 893.
[5] Prychid C J, Rudall P J. Calcium oxalate crystals in monocotyledons: a review of their structure and systematics. Annals of Botany, 1999, 84(6): 725- 739.
[6] Nakata P A, McConn M M. Isolation ofMedicagotruncatulamutants defective in calcium oxalate crystal formation. Plant Physiology, 2000, 124(3): 1097- 1104.
[7] Lersten N R, Horner H T. Crystal macropatterns in leaves of Fagaceae and Nothofagaceae: A comparative study. Plant Systematics and Evolution, 2008, 271(3- 4): 239- 253.
[8] Hudgins J W, Krekling T, Franceschi V R. Distribution of calcium oxalate crystals in the secondary phloem of conifers: A constitutive defense mechanism? New Phytologist, 2003, 159(3): 677- 690.
[9] Cote G G. Diversity and distribution of idioblasts producing calcium oxalate crystals inDieffenbachiaseguine(Araceae). American Journal of Botany, 2009, 96(7): 1245- 1254.
[10] Bouropoulos N, Weiner S, Addadi L. Calcium oxalate crystals in tomato and tobacco plants: Morphology and in vitro interactions of crystal-associated macromolecules. Chemistry-A European Journal, 2001, 7(9): 1881- 1888.
[11] Pueschel C M, West J A. Cytoplasmic streaming of calcium oxalate crystals inCallipsygmawilsonis(Bryopsidales, Chlorophyta). Phycological Research, 2007, 55(4): 278- 285.
[12] Pueschel C M, West J A. Calcium oxalate crystals in the marine red algaSpyridiafilamentosa(Ceramiales; Rhodophyta). Phycologia, 2007, 46(5): 565- 571.
[13] Korth K L, Doege S J, Park S H, Goggin F L, Wang Q, Gomez S K, Liu G J, Jia L L, Nakata P A. Medicago truncatula mutants demonstrate the role of plant calcium oxalate crystals as an effective defense against chewing insects. Plant Physiology, 2006, 141(1): 188- 195.
[15] Osuji J O, Ndukwu B C. Probable functions and remobilisation of calcium oxalates in Musa L. African Journal of Biotechnology, 2005, 4(10): 1139- 1141.
[16] Katayama H, Fujibayashi Y, Nagaoka S, Sugimura Y. Cell wall sheath surrounding calcium oxalate crystals in mulberry idioblasts. Protoplasma, 2007, 231(3- 4): 245- 248.
[17] Demiray H. Calcium oxalate crystals of someCrataegus(Rosaceae) species growing in Aegean region. Biologia, 2007, 62(1): 46- 50.
[18] Coelhoa E G, Amaral A C F, Ferreirab J L P, Santos A G, Pinheiro M L B, de Silva J R A. Calcium oxalate crystals and methyl salicylate as toxic principles of the fresh leaves from Palicourea longiflora, an endemic species in the Amazonas state. Toxicon, 2007, 49(3): 407- 409.
[19] Yan Q D, Su P X, Chen H B, Zhang L H. Comparative analysis of the crystal cells located in photosynthesis organs among five kinds of C4 desert plant. Journal of Plant Ecology, 2008, 32(4): 873- 882.
[20] Park S H, Doege S J, Nakata P A, Korth K L.Medicagotruncatula-derived calcium oxalate crystals have a negative impact on chewing insect performance via their physical properties. Entomologia Experimentalis et Applicata, 2009, 131(2): 208- 215.
[21] Gonzalez J A Z, Costa M D, Silva I R, Neves J C L, de Barros N F, Borges A C. Accumulation of oxalic acid and calcium crystals in eucalypt ectomycorrhizas. I-Oxalic acid production and nutrient concentration in fine lateral roots colonized with ectomicorrhizal fungi. Revista Brasileira de Ciênc do Solo, 2009, 33(3): 541- 553.
[22] Lersten N R, Horner H T. Crystal diversity and macropatterns in leaves of Oleaceae. Plant Systematics and Evolution, 2009, 282(1- 2): 87- 102.
[23] Prywer J. Theoretical analysis of specific evolution of some faces of plant COM crystals. CrystEngComm, 2009, 11(1): 196- 202.
[24] Çölgeçen H, Kaplan A, Büyükkartal H N. Calcium oxalate crystals in leaves ofQuercuscerrisL and Q Ilex L. Bangladesh Journal of Botany, 2009, 38(1): 103- 105.
[25] Meric C. Calcium oxalate crystals in some species of the tribe inuleae (asteraceae). Acta Biologica Cracoviensia Series Botanica, 2009, 51(1): 105- 110.
[26] Li X L, Zhang W J, Lu J W, Wang L J. Biological mineralization of calcium oxalate in the Plant. Chinese Science Bulletin, 2012, 57(26): 2443- 2455.
[27] Bremer B, Bremer K, Chase M W, Fay M F, Reveal J L, Soltis D E, Soltis P S, Stevens P F, The Angiosperm Phylogeny Group. An update of the angiosperm phylogeny group classification for the orders and families of flowering plants: APG III. Botanical Journal of the Linnean Society, 2009, 161(2): 105- 121.
[28] Webb M A, Cavaletto J M, Carpita N C, Lopez L E, Arnott H J. The intravacuolar organic matrix associated with calcium oxalate crystals in leaves ofVitis. The Plant Journal, 1995, 7(4): 633- 648.
[29] Finley D S. Patterns of calcium oxalate crystals in young tropical leaves: a possible role as an anti-herbivory defense. Revista de Biología Tropical, 1999, 47(1- 2): 27- 31.
[30] McNair J B. The interrelation between substances in plants: essential oils and resins, cyanogen and oxalate. American Journal of Botany, 1932, 19(3): 255- 271.
[31] Gallaher R N. The occurrence of calcium in plant tissue as crystals of calcium oxalate. Communications in Soil Science and Plant Analysis, 1975, 6(3): 315- 330.
[32] Libert B, Franceschi V R. Oxalate in crop plants. Journal of Agricultural and Food Chemistry, 1987, 35(6): 926- 938.
[33] Da Costa L M, Tronto J, Constantino V R L, Fonseca M K A, Oliveira A P, Da Costa M R. Extraction and concentration of biogenic calcium oxalate from plant leaves. Revista Brasileira de Ciênc do Solo, 2009, 33(3): 729- 733.
[34] Franceschi V R, Nakata P A. Calcium oxalate in plants: Formation and function. Annual Review of Plant Biology, 2005, 56(1): 41- 71.
[35] Zhu G L. The characteristics of physio-biochemical and features of morphological structure of Zizyphus jujuba Mill. response to grads drought stress [D]. Linfen: Shanxi Normal University, 2012.
[36] Sun R, Meng Z N, Pang Y, Zhou G L.the current study status of crystals in plant and utilization method.Shandong Forestry Science and Technonogy, 2004, (2): 35- 36.
[37] Xu Y M, Li J X, Wu Q N, Chen J L, Jiang X P. The types and distribution of crystals in the medicinal plants. The Journal of Chinese Medicine, 1989, 14(2): 69- 72.
[38] Franceschi V R, Horner H T. Calcium oxalate crystals in plants. The Botanical Review, 1980, 46(4): 361- 427.
[39] Frey-Wyssling W. Crystallography of the two hydrates of crystalline calcium oxalate in plants. American Journal of Botany, 1981, 68(1): 130- 141.
[40] Bush D S. Regulation of cytosolic calcium in plants. Plant Physiology, 1993, 103(1): 7- 13.
[41] Borchert R. Calcium acetate induces calcium uptake and formation of calcium-oxalate crystals in isolated leaflets ofGleditsiatriacanthosL.. Planta, 1986, 168(4): 571- 578.
[42] Franceschi V R. Calcium oxalate formation is a rapid and reversible process inLemnaminorL. Protoplasma, 1989, 148(2- 3): 130- 137.
[43] Volk G M, Lynch-Holm V J, Kostman T A, Goss L J, Franceschi V R. The role of druse and raphide calcium oxalate crystals in tissue calcium regulation inPistiastratiotesleaves. Plant Biology, 2002, 4(1): 34- 45.
[44] Tilton V R, Horner H T. Calcium oxalate raphide crystals and crystalliferous idioblasts in the carpels ofOrnithogalumcaudatum. Annals of Botany, 1980, 46(5): 533- 539.
[45] Ilarslan H, Palmer R G, Imsande J, Horner H T. Quantitative determination of calcium oxalate and oxalate in developing seeds of soybean (Leguminosae). American Journal of Botany, 1997, 84(8): 1042- 1046.
[46] Ruiz N, Ward D, Saltz S. Calcium oxalate crystals in leaves ofPancratiumsickenbergeri: constitutive or induced defence? Functional Ecology, 2002, 16(1): 99- 105.
[47] Ward D, Spiegel M, Saltz D. Gazelle herbivory and interpopulation differences in calcium oxalate content of leaves of a desert lily. Journal of Chemical Ecology, 1997, 23(2): 333- 346.
[48] Foy C D, Chaney R L, White M C. The physiology of metal toxicity in plants. Annual Review of Plant Physiology, 1978, 29(1): 511- 566.
[49] Ryan P R, Delhaize E, Jones D L. Function and mechanism of organic anion exudation from plant roots. Annual Review of Plant Physiology and Plant Molecular Biology, 2001, 52(1): 527- 560.
[50] Ma J F, Ryan P R, Delhaize E. Aluminium tolerance in plants and the complexing role of organic acids. Trends in Plant Science, 2001, 6(6): 273- 278.
[51] Long X X, Yang X E, Ye Z Q. Metal ligand of super accumulation plant and application in phytoremediation. The Journal of Plant Physiology, 2003, 39(1): 71- 77.
[52] Li D H, Huang S M, He L Y, L W D. Organic acid secretion in plant roots and effect for reconciliation aluminum toxicity. The Journal of Plant Physiology, 2004, 40(4): 505- 510.
[53] Dijkshoorn W. Organic acids and their role in ion uptake// Butler G W, Bailey R W, eds. Chemistry and Biochemistry of Herbage. Volume 2. New York: Academic Press, 1973: 63- 187.
[54] Dunne T C. Plant buffer systems in relation to the absorption of bases by plants. Hilgardia, 1932, 7(3): 207- 234.
[55] Chen Z, Geng H C, Wang S S, Ding M L, Chen X J, Chen J Y. The formation, degradation and funtion of oxalic acid (salt) in plant. Molecular Plant Breeding, 2007, 5(S): 105- 110.
[56] Li Z L, Li R A.Anatomical observations of assimilating branches of nine xerophytes in Gansu. Chinese Bulletin of Botany, 1981, 23(3): 181- 185.
[57] Liu J Q.Xerophilous structures of desert plants in different ecological types. Journal of Plant Ecology, 1982, 6(4): 314- 319.
[58] Su P X, An Z L, Ma R J, Liu X M. H. Wreath structure and C4 photosynthetic characteristics of desert plants Ammodendron and Calligonum mongolicum. Chinese Journal of Plant Ecology, 2005, 29(1): 1- 7.
[59] Xu J J, Ci H C, He X D, Xue P P, Zhao X L, Guo J T, Gao Y B. The calcium crystals and calcium component characteristics of 54 plants in salinization habitat in Tianjin. Chinese Journal of Applied Ecology, 2012, 23(5): 1247- 1253.
[60] Kostman T A, Tarlyn N M, Loewus F A, Franceschi V R. Biosynthesis of L-ascorbic acid and conversion of carbons 1 and 2 of L-ascorbic acid to oxalic acid occurs within individual calcium oxalate crystal idioblasts. Plant Physiology, 2001, 125(2): 634- 640.
[61] Yu L, Jiang J Z, Zhang C, Jiang L R, Ye N H, Lu Y S, Yang G Z, Liu E, Peng C L, He Z G, Peng X X. Glyoxylate rather than ascorbate is an efficient precursor for oxalate biosynthesis in rice. Journal of Experimental Botany, 2010, 61(6): 1625- 1634.
[62] Keates S E, Tarlyn N M, Loewus F A, Franceschi V R. L-ascorbic acid and L-galactose are sources for oxalic acid and calcium oxalate inPistiastratiotes. Phytochemistry, 2000, 53(4): 433- 440.
[63] Horner H T, Kausch A P, Wagner B L. Ascorbic acid: A precursor of oxalate in crystal idioblasts of Yucca torreyi in liquid root culture. International Journal of Plant Sciences, 2000, 161(6): 861- 868.
[64] Kostman T A, Koscher J R. L-galactono-γ-lactone dehydrogenase is present in calcium oxalate crystal idioblasts of two plant species. Plant Physiology and Biochemistry, 2003, 41(3): 201- 206.
[65] Sakai W S, Jones R C. Raphides with barbs and grooves in Xanthosoma sagittifolium (Araceae). Science, 1972, 178(4058): 324- 325.
[66] Nakata P A, McConn M M. IsolatedMedicagotruncatulamutants with increased calcium oxalate crystal accumulation have decreased ascorbic acid levels. Plant Physiology and Biochemistry, 2007, 45(3- 4): 216- 220.
[67] Yang H Q, Jie Y L. Uptake and transport of calcium in plants. Journal of Plant Physiology and Molecular Biology, 2005, 31(3): 227- 234.
[68] White P J, Broadley M R. Calcium in plants. Annals of Botany, 2003, 92(4): 487- 511.
[69] Volk G M, Goss L J, Franceschi V R. Calcium channels are involved in calcium oxalate crystal formation in specialized cells ofPistiastratiotesL. Annals of Botany, 2004, 93(6): 741- 753.
[70] Mazen A M A, Zhang D Z, Franceschi V R. Calcium oxalate formation inLemnaminor: Physiological and ultrastructural aspects of high capacity calcium sequestration. New Phytologist, 2003, 161(2): 435- 448.
[71] Smironff N, Wheeler G L. Ascorbic acid in plant: biosynthesis and function. Critical Reviews in Biochemistry and Molecular Biology, 2000, 35(4): 291- 314.
[72] Tan Y. The formation and function of plant calcium oxalate crystal. Bulletin of Biology, 2007, 42(10): 20- 21.
[73] Zhai Z H, Wang X Z, Ding M X. Cell biology. Beijing:High Education Press, 2000: 280- 299.
[74] Li X X, Zhang D Z, Lynch-Holm V J, Okita T W, Franceschi V R. Isolation of a crystal matrix protein associated with calcium oxalate precipitation in vacuoles of specialized cells. Plant Physiology, 2003, 133(2): 549- 559.
[19] 严巧娣, 苏培玺, 陈宏彬, 张岭梅. 五种C4荒漠植物光合器官中含晶细胞的比较分析. 植物生态学报, 2008, 32(4): 873- 882.
[26] 李秀丽, 张文君, 鲁剑巍, 王荔军. 植物体内草酸钙的生物矿化. 科学通报, 2012, 57(26): 2443- 2455.
[35] 朱广龙. 酸枣生理生化特性及结构特征对梯度干旱的响应 [D]. 临汾: 山西师范大学, 2012.
[36] 孙锐, 孟振农, 房用, 周光鲁. 植物体内所含晶体的研究进展及其应用的思路. 山东林业科技, 2004, (2): 35- 36.
[37] 许益民, 李建新, 吴启南, 陈建楼, 姜小平. 药用植物中结晶物的类型及分布述要. 中国中药杂志, 1989, 14(2): 69- 72.
[51] 龙新宪, 杨肖娥, 叶正钱. 超积累植物的金属配位体及其在植物修复中的应用. 植物生理学通讯, 2003, 39(1): 71- 77.
[52] 李德华, 黄升谋, 贺立源, 刘武定. 植物根系有机酸的分泌和解铝毒作用. 植物生理学通讯, 2004, 40(4): 505- 510.
[55] 陈峥, 耿华春, 王沙沙, 丁明丽, 陈新建, 陈军营. 植物体内草酸(盐)的形成、降解及其作用. 分子植物育种, 2007, 5(S): 105- 110.
[56] 李正理, 李荣敖. 我国甘肃九种旱生植物同化枝的解剖观察. 植物学报, 1981, 23(3): 181- 185.
[57] 刘家琼. 我国荒漠不同生态类型植物的旱生结构. 植物生态学与地植物学丛刊, 1982, 6(4): 314- 319.
[58] 苏培玺, 安黎哲, 马瑞君, 刘新民. 荒漠植物梭梭和沙拐枣的花环结构及C4光合特征. 植物生态学报, 2005, 29(1): 1- 7.
[59] 徐静静, 慈华聪, 何兴东, 薛苹苹, 赵雪莱, 郭健潭, 高玉葆. 天津盐渍化生境54种植物钙晶体与钙组分特征. 应用生态学报, 2012, 23(5): 1247- 1253.
[72] 谭云. 植物草酸钙晶体的形成和功能. 生物学通报, 2007, 42(10): 20- 21.
[73] 翟中和, 王喜忠, 丁明孝. 细胞生物学. 北京: 高等教育出版社, 2000: 280- 299.
Current status of research on morphological structure, biological function and formation mechanism of plant crystals
ZHU Guanglong1,2, MA Yin1, HAN Lei1, HUO Zhangli1, WEI Xuezhi1,*
1CollegeofLifeScience,ShanxiNormalUniversity,Linfen041000,China2CollegeofPlantScienceandTechnology,HuazhongAgricultureUniversity,Wuhan430070,China
Plant crystals are one of the metabolin that have peculiar morphological structure and physiological function. They are widespreading and have been found in more than 500 floristics. Crystals have multiple shapes, such as raphid, column crystal, prism, sand crystal and cluster crystal and have multifarious types, including crystals of calcium oxalate, cystolith, silicon plastid, calcium sulfate crystal etc. They also have significant functions, for instance, calcium regulating, plant defense and protection, detoxifing heavy metal, ionic equilibrium, increasing stress tolerance and others biological functions. The synthesis of crystal is associated with calcium ion absorbed in vitro and transported in vivo, the biosynthesis of oxalate, and the coupling process of calcium ion and oxalate. The growth and development of crystal has close relationship with interaction among vacuole, idioblast regulation, and others eucaryotic cell structures. Previous studies have been summarized in this paper in order to identify the areas of further research.
crystal; morphological structure; biological function; formation mechanism
国家自然科学基金(30972396); 山西省自然科学基金项目资助(2009011041- 1)
2013- 02- 24; 网络出版日期:2014- 03- 14
10.5846/stxb201302240293
*通讯作者Corresponding author.E-mail: wxz3288@163.com
朱广龙,马茵,韩蕾,霍张丽,魏学智.植物晶体的形态结构、生物功能及形成机制研究进展.生态学报,2014,34(22):6429- 6439.
Zhu G L, Ma Y, Han L, Huo Z L, Wei X Z.Current status of research on morphological structure, biological function and formation mechanism of plant crystals.Acta Ecologica Sinica,2014,34(22):6429- 6439.

