四氧嘧啶诱导的实验性高血糖小鼠模型建立及其稳定性
陈 琳,乐 凯,茹 琴,田 香,熊 琪,马宝苗,刘 璐,吴日辉,邢俊俏,王 宁,张 琨,赵小伟,陈 卫,何 丽,欧阳康乐,司远仁,李超英,4,
(1.江汉大学武汉生物医学研究院,湖北 武汉 430056; 2. 福格森(武汉)生物科技股份有限公司,湖北 武汉 430050;3. 湖北省中山医院,湖北 武汉 430032;4. 汉济生物科技(武汉)有限公司,汉济生物医药研究院,湖北 武汉 430075;)
保健食品安全性和功能评价是国家对保健食品安全监管的一项重要措施[1]。在辅助降血糖功能试验评价中,成功构建实验性高血糖模型是前提,功能试验周期一般长达4~6周,因此保持该模型的稳定性是评价工作顺利进行的重要保障。四氧嘧啶(alloxan,ALX)诱导实验性高血糖模型的方法因其能高度模拟人类糖尿病临床表现而被国际上一贯用于糖尿病机制研究[2],同时也是我国保健食品安全性和功能评价试验中采用的经典造模方法[3]。影响该药物造模成功的因素很多[4],如动物品系[5, 6]、性别[7]、体重[8]、给药途径[9]、溶媒[10]、给药剂量[11, 12]、禁食时间[13]等,专家学者对此也进行了广泛研究探讨。其中,溶媒[10]和剂量[8, 11]对腹腔注射ALX致实验性高血糖小鼠模型的稳定性研究通常为注射后7d[14]~30d[15],针对这一研究现状,本实验对腹腔注射ALX致实验性高血糖小鼠模型建立的溶媒及剂量因素进行优化组合,对小鼠成模率、存活率、体重、空腹血糖、血糖曲线下面积(反映糖耐量水平)的稳定性进行了长达6周的动态观察,同时测定血清胰岛素水平及其组间差异,以期为辅助降血糖功能试验评价及实验性高血糖相关机制研究提供实验支持。
1 材料和方法
1.1 实验动物
SPF级昆明种成年小鼠160只,雌雄各半,6~8周龄,体重22~28 g,自由采食与饮水,由湖北省疾病预防与控制中心动物中心提供,生产合格证号为:SCXK(鄂)2008-0005,实验动物使用合格证号SYXK(鄂)2007-0042。
1.2 试剂与仪器
四氧嘧啶、葡萄糖、柠檬酸及柠檬酸钠(分析纯,Sigma,美国),生理盐水(双鹤,中国)。安准型血糖检测仪及试纸条(长沙三诺,中国),小鼠胰岛素ELISA检测试剂盒(上海博谷,中国),高速离心机(Thermo,美国),酶标仪(Thermo,美国),电子天平(上海梅特勒-托利多,中国)。
1.3 动物分组与干预方法
小鼠适应性喂养3 d后随机分为8组,每组各12只小鼠:A组:生理盐水(normal saline,NS)对照组(注射NS);B组:柠檬酸钠缓冲液(sodium citrate-hydrochloric acid buffer solution,CS)对照组(注射pH 4.5的CS);C组:NS + ALX 160 mg(注射NS配制的ALX 160 mg/kg 体重);D组:NS + ALX 190 mg(注射NS配制的ALX 190 mg/kg 体重);E组:CS + ALX 190 mg(注射pH 4.5的CS配制的ALX 190 mg/kg 体重);F组:CS + ALX 180 mg(注射pH 4.5的CS配制的ALX 180 mg/kg 体重);G组:CS + ALX 160 mg(注射pH 4.5的CS配制的ALX 160 mg/kg 体重);H组:CS + ALX 140 mg(注射pH 4.5的CS配制的ALX 140 mg/kg 体重)。所有组别小鼠适应性喂养3 d后,在造模前禁食不禁水16 h后检测体重、空腹血糖及血糖曲线下面积的基础值,然后采取单次腹腔注射(溶剂或药物,0.2 mL/kg 体重)进行造模,ALX配制均避光、现用现配。血糖高于10 mmol/L者确定为造模成功,计算各组成模率。所有组别小鼠继续常规饲养,动态检测体重、空腹血糖及血糖曲线下面积,1次/周,共6周,观察结束后收集小鼠血清保存于-20℃用于检测血清胰岛素水平。
1.4 小鼠血清胰岛素水平检测
实验步骤严格按照小鼠胰岛素ELISA检测试剂盒提供的说明书进行,显色终止后于450 nm波长处测定吸光度值,绘制标准曲线,计算相对浓度值,用于统计分析。
1.5 统计学方法
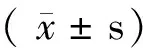
2 结果
2.1 小鼠存活率动态观察
如图1中所示,NS腹腔注射组或与ALX 160 mg/kg 体重配伍腹腔注射组,造模后6 周小鼠存活率稳定在100%;NS与ALX 190 mg/kg 体重配伍腹腔注射组及CS腹腔注射组,造模后小鼠存活率6 周稳定在90%;CS与ALX 190 mg/kg 体重配伍腹腔注射组,造模后1 周小鼠存活率为67%,2~6 周逐步下降至47%,与NS对照组相比显著下降,P<0.05;CS与ALX 180 mg/kg 体重配伍腹腔注射组,造模后1 周小鼠存活率为73%,2~6 周维持稳定在67%;CS与ALX 160 mg/kg 体重配伍腹腔注射组,造模后小鼠存活率6 周稳定在75%,CS与ALX 140 mg/kg 体重配伍腹腔注射组,造模后小鼠存活率6周稳定在70%,组间存活率相比无显著性差异,P>0.05。
2.2 小鼠成模率动态观察
如图2所示,NS腹腔注射组或CS腹腔注射组,造模后6周小鼠成模率为0;NS与ALX 160 mg/kg 体重配伍腹腔注射组,造模后小鼠1周成模率为0,2~6周为7%;NS与ALX 190 mg/kg 体重配伍腹腔注射组,造模后2周小鼠成模率由0上升至40%,第3周降低至7%,第4周上升至15%,5~6周降低至7%,呈现较大波动;CS与ALX配伍腹腔注射组成模率与NS对照组相比显著增高,P<0.05,其中,CS与ALX 190 mg/kg 体重配伍腹腔注射组,造模后6周小鼠成模率稳定在93%;CS与ALX 180 mg/kg 体重配伍腹腔注射组,造模后1周小鼠成模率为87%,2~6周内在67%至87%之间反复波动;CS与ALX 160 mg/kg 体重配伍腹腔注射组,造模后小鼠成模率1周小鼠成模率为70%,2~6周内稳定保持在60%至70%水平;CS与ALX 140 mg/kg 体重配伍腹腔注射组,造模后1周小鼠成模率为47%,2~6周内在47%至27%之间反复波动。
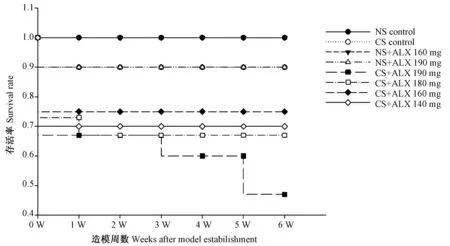
图1 造模前后各组小鼠存活率动态变化曲线
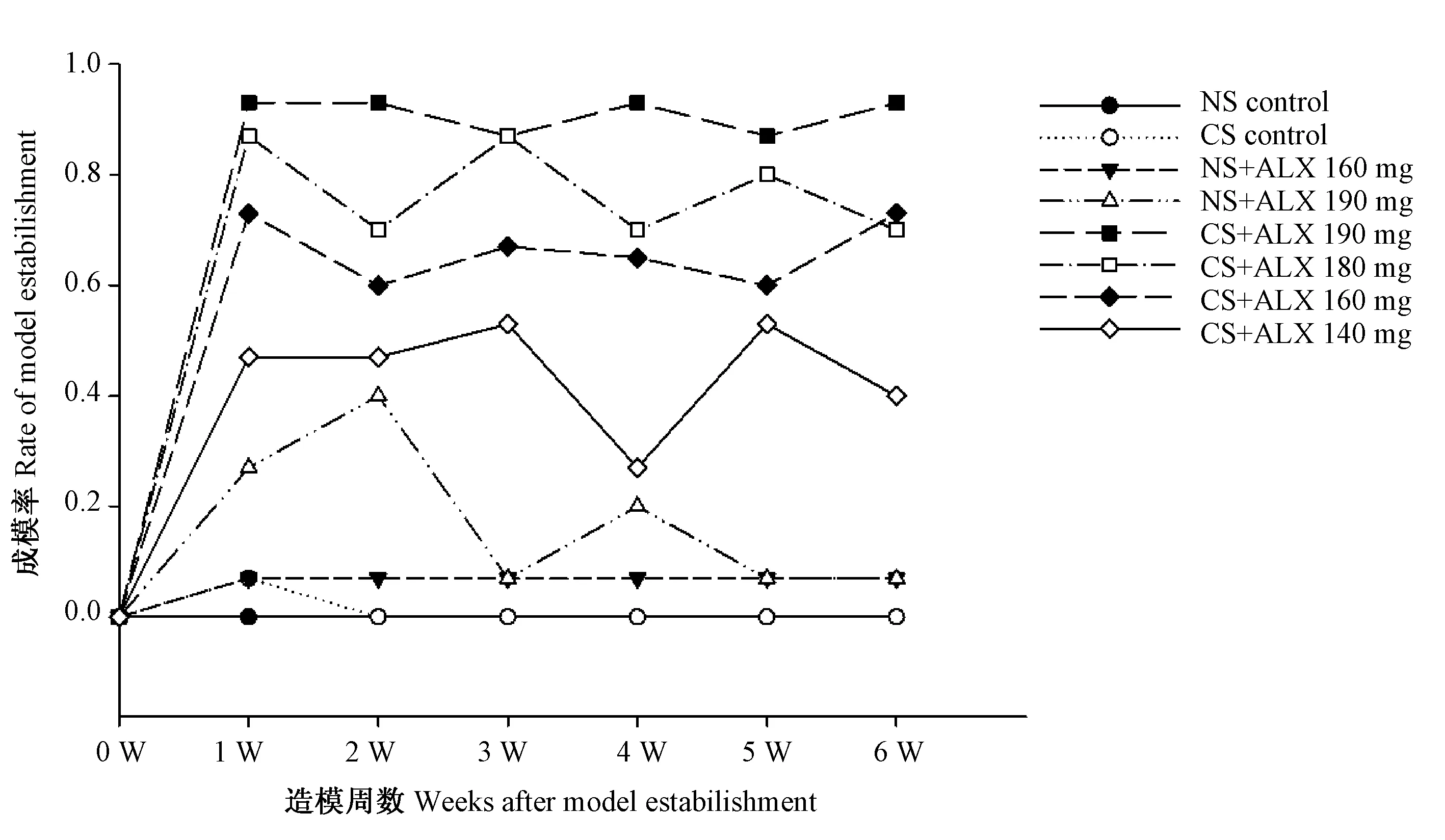
图2 各组小鼠成模率动态变化曲线
2.3 小鼠体重动态观察
如图3所示6周观察期内,NS腹腔注射或与ALX 160 mg/kg 体重、ALX 190 mg/kg 体重配伍腹腔注射、CS腹腔注射或与ALX 140 mg/kg 体重配伍腹腔注射对小鼠体重及其稳定性的影响,与NS对照组相比,差异无显著性,P> 0.05;与NS对照组相比,CS与ALX 180、190 mg/kg 体重配伍会导致小鼠体重极显著下降,P<0.01,CS与ALX 160 mg/kg 体重配伍会导致小鼠体重显著下降,P<0.05。
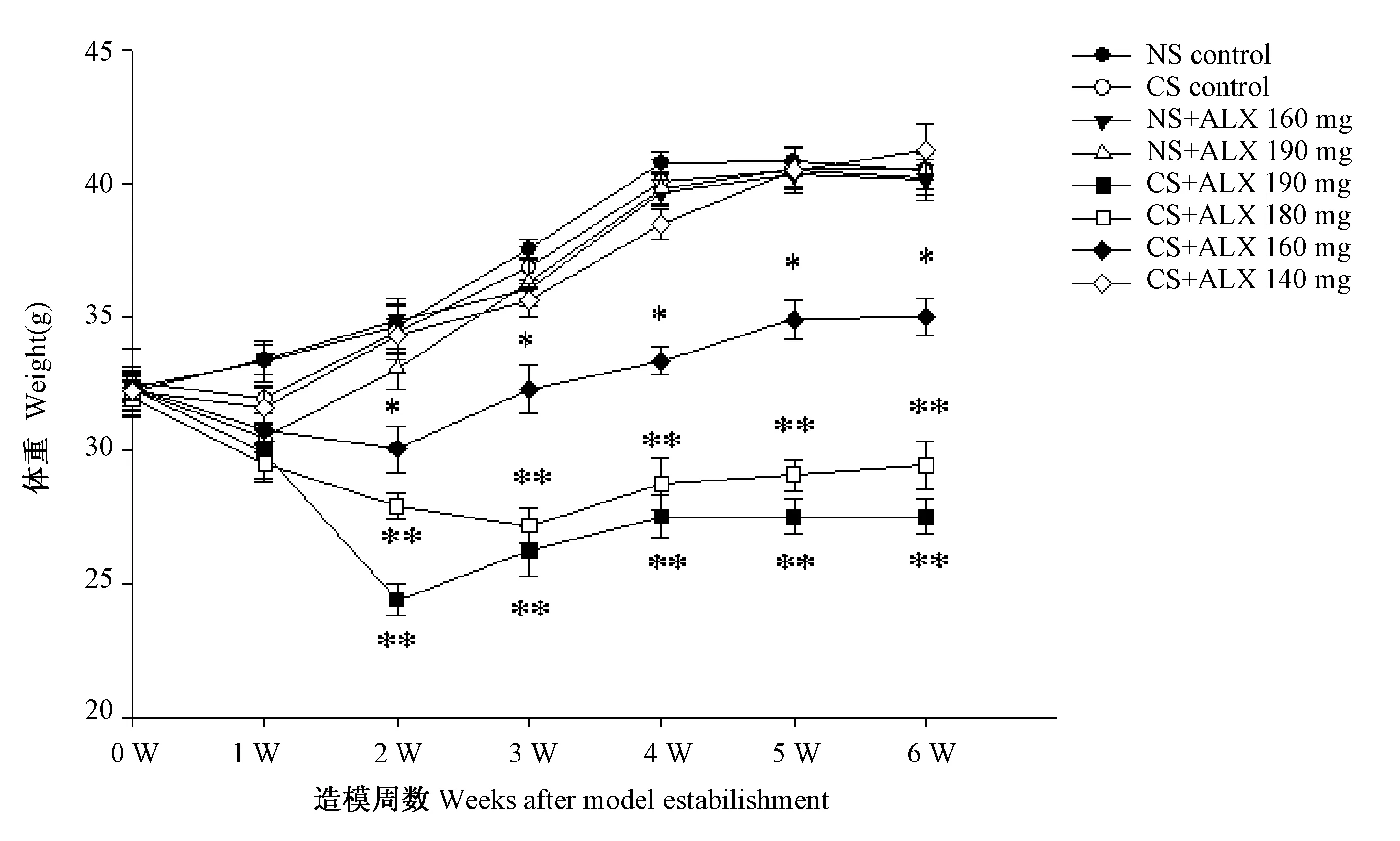
注:* 与NS对照组相比有显著性差异,P<0.05;** 与NS对照组相比有极显著性差异,P<0.01
注:* 与NS对照组相比有显著性差异,P<0.05;** 与NS对照组相比有极显著性差异,P<0.01
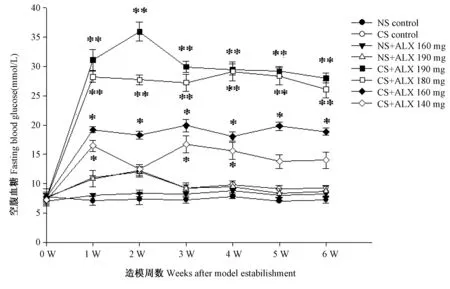
2.4 小鼠空腹血糖动态观察
如图4所示,造模后,NS对照组及NS+ALX 160 mg组,小鼠空腹血糖未见升高,6周内呈持续稳定不变趋势;NS+ALX 190 mg组、CS对照组造模后小鼠空腹血糖呈一过性轻度升高,3周后下降至正常水平并呈持续稳定不变趋势;CS+ALX 140 mg组造模后小鼠空腹血糖较NS对照组显著升高,2-6周呈波动性下降趋势,至第6周空腹血糖仍显著高于NS对照组(P< 0.05);CS+ALX 160 mg组造模后小鼠空腹血糖较NS对照组显著升高,2~6周呈稳定保持高水平(15`20 mmol/L),至第6周空腹血糖仍显著高于NS对照组(P<0.05);CS+ALX 180 mg组及CS+ALX 190 mg组,造模后小鼠空腹血糖较NS对照组极显著升高,2~6周呈稳定保持极高水平,至第6周空腹血糖仍极显著高于NS对照组(>25 mmol/L,P<0.01)。结果提示,6周观察期内,NS腹腔注射或与ALX 160 mg/Kg体重、ALX 190 mg/Kg体重配伍腹腔注射NS、CS腹腔注射对小鼠空腹血糖及其稳定性无显著影响,CS与ALX 160~190 mg/Kg 体重配伍会导致小鼠空腹血糖显著升高,ALX剂量越大,小鼠空腹血糖越高。
注:* 与NS对照组相比有显著性差异,P < 0.05;** 与NS对照组相比有极显著性差异,P < 0.01
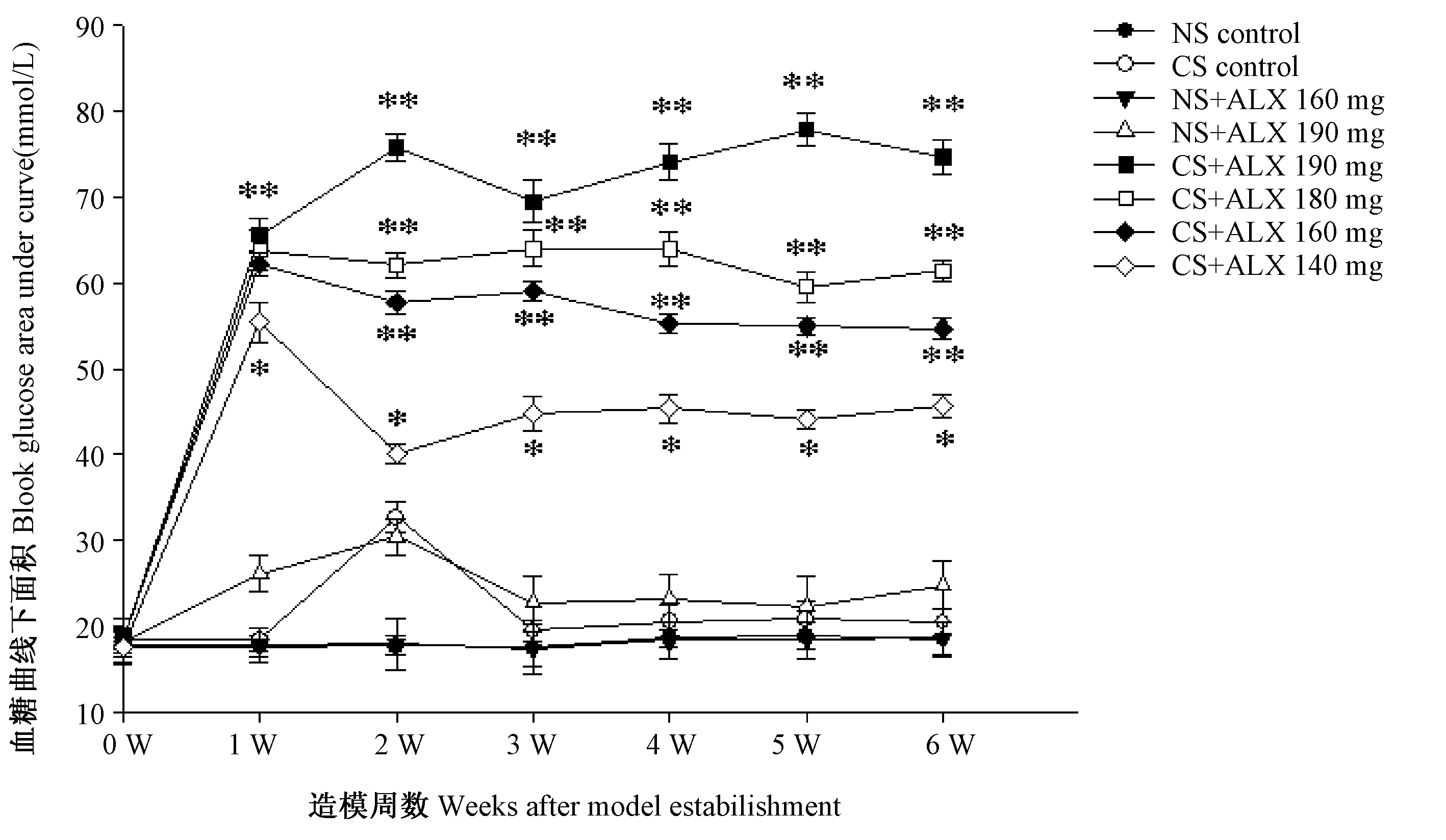
2.5 小鼠糖耐量水平动态观察
如图5所示,造模后,NS对照组及NS+ALX 160 mg组,小鼠血糖曲线下面积未见升高,6周内呈持续稳定不变趋势;NS+ALX 190 mg组、CS对照组造模后小鼠血糖曲线下面积呈一过性轻度升高,3周后下降至正常水平并呈持续稳定不变趋势;CS+ALX 140 mg组造模后小鼠血糖曲线下面积较NS对照组显著升高,第2周下降,3~6周血糖曲线下面积仍显著高于NS对照组(P<0.05);CS+ALX 160 mg组及CS+ALX 180 mg组造模后小鼠血糖曲线下面积较NS对照组极显著升高,2-6周呈稳定保持高水平(55~65 mmol/L),至第6周血糖曲线下面积仍极显著高于NS对照组(P<0.01);CS+ALX 190 mg组,造模后小鼠血糖曲线下面积较NS对照组极显著升高,2-6周呈稳定保持极高水平,至第6周血糖曲线下面积仍极显著高于NS对照组(P<0.01)。结果提示,6周观察期内,NS腹腔注射或与ALX 160 mg/Kg体重、ALX 190 mg/kg 体重配伍腹腔注射、CS腹腔注射对小鼠血糖曲线下面积及其稳定性无显著影响,CS与ALX 140~190 mg/kg体重配伍会导致小鼠血糖曲线下面积显著升高,ALX剂量越大,小鼠血糖曲线下面积越高。
2.6 小鼠血清胰岛素水平组间差异
如图6所示,造模后第6周,NS对照组、CS对照组、NS+ALX 160 mg组、NS+ALX 190 mg组小鼠血清胰岛素水平组间无差异;CS+ALX 140 mg组、CS+ALX 160 mg组及CS+ALX 180 mg组小鼠血清胰岛素水平组间无差异,均显著低于NS对照组,P<0.05,CS+ALX 190 mg组小鼠血清胰岛素水平极显著低于NS对照组,P<0.01。提示NS、CS单独腹腔注射,NS与ALX 160或190 mg/kg 体重联合腹腔注射均不会对造模后第6周小鼠血清胰岛素水平有显著影响,而CS与ALX 140、160、180及190 mg/kg 体重联合腹腔注射均对造模后第6周小鼠血清胰岛素水平有显著降低作用(P<0.05),其中以CS与ALX 190 mg/kg 体重联合腹腔注射降低血清胰岛素水平作用最为显著(P<0.01)。
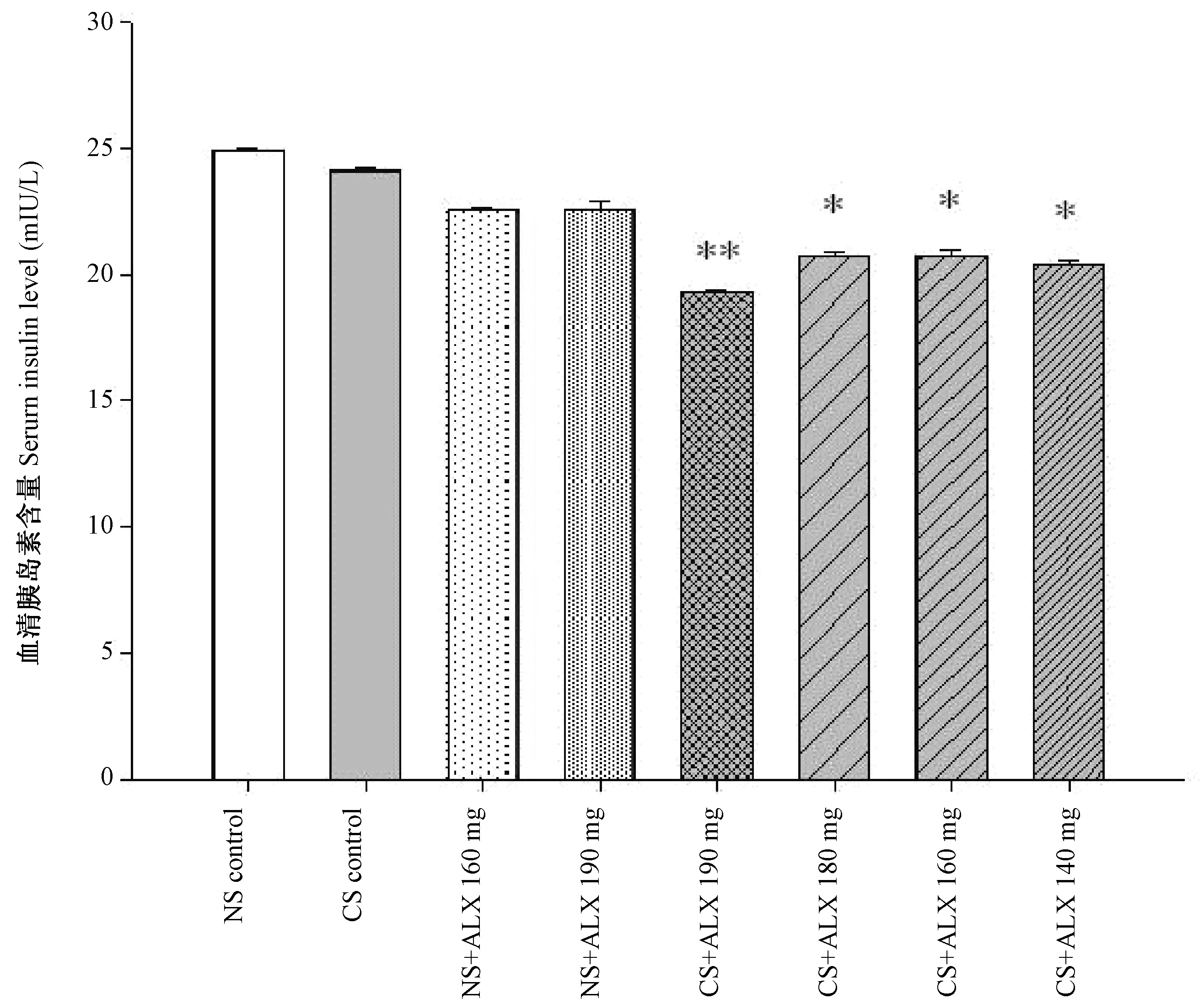
注:* 与NS对照组相比有显著性差异,P<0.05;** 与NS对照组相比有极显著性差异,P<0.01
3 讨论
随着人们生活水平的不断提高和人口老龄化,糖尿病的发病呈逐年上升趋势。建立理想的实验性糖尿病动物模型,无论对糖尿病机制的深入研究,还是保健食品及抗糖尿病新药的开发都具有非常重要的实际意义。
ALX易与SH基(主要是半胱氨酸)发生反应,而胰岛的β细胞中SH基含量较其他组织多,故ALX可以选择性地损害胰岛β细胞,通过产生超氧自由基破坏β细胞,使细胞内DNA损伤,并激活多聚核糖体合成酶的活性,从而导致mRNA功能受损,细胞合成前胰岛素减少,最终导致胰岛素缺乏性的高血糖[7]。利用ALX制造高血糖模型能高度模拟人类糖尿病临床表现[2],同时具有胰岛外分泌不受损伤;几乎所有常用实验动物都可以进行实验研究;胰岛的β细胞不是功能消失,而是功能不同程度的降低,有利于研究胰岛组织的再生和功能的恢复,动物不用注射胰岛素也能存活等优点而被国际上广泛采纳[16]。
四氧嘧啶造模成功受诸多因素影响,例如动物品系、性别、体重、给药途径、溶媒、给药剂量、禁食时间等,专家学者对此也进行了广泛研究探讨,研究发现这些因素对造模成功率的影响各异[9, 17],已报道的实验结果中溶媒[10]的选择、药物的剂量[8, 11]仍是关键的影响因素,文献中使用ALX造模剂量从100 mg/kg 体重到300 mg/kg 体重(小鼠)[7, 8, 11]均有报道且结果各异,可能与各文献中实验条件各异以及动物个体差异有关[17, 18]。ALX水溶液的稳定性取决于pH值,pH 4.5的CS减少ALX的氧化分解有利于药物的溶解以及在体内的吸收利用从而提高成模率[10]。我们的实验中以pH值为4.5的CS为溶剂配制ALX,并且避光、现用现配。实验结果发现全部以此为溶液的组别造模后成模率及其稳定性都显著高于以生理盐水为溶剂的组别(无论药物浓度高低),与文献报道一致[10],造模后6周内血糖值稳定维持在成模水平(>10 mmol/L),因此我们认为pH值为4.5的CS为溶剂是造模成功及维持模型长期稳定性的必要条件。
最重要的是,在辅助降血糖功能试验评价中,成功构建糖尿病模型是前提,而功能试验周期一般长达4~6周,因此,保证该模型的稳定性,是该项评价工作顺利进行的重要保障和前提。目前大多数文献仅考察了上述相关因素对造模率等指标7~30d期间的影响[14, 15]。针对这一研究现状,本实验对腹腔注射ALX致实验性高血糖小鼠模型建立的溶媒及剂量因素进行优化组合,对小鼠成模率、存活率、体重、空腹血糖、血糖曲线下面积(反映糖耐量水平)的稳定性进行了长达6周的动态观察,同时测定血清胰岛素水平及其组间差异。
我们的实验结果表明ALX(以pH值为4.5 CS为溶剂)浓度达到190 mg/kg 体重时,6周内成模率(93%),空腹血糖(>25 mmol/L)及血糖曲线下面积(>70 mmol/L)较持续稳定在高水平,但体重(27g)、动物存活率(47%)及血清胰岛素水平(19 mIU/L)极显著降低(P<0.01),提示该剂量可能会因动物损耗过大、小鼠胰腺及其胰岛分泌胰岛素功能被不可逆损害,高血糖状态不可逆转而不适用于辅助降血糖功能试验研究。药物浓度在140、160、180 mg/kg 体重时,6周内小鼠空腹血糖(15~25 mmol/L)及血糖曲线下面积(40~60 mmol/L)动物成模率(40%~73%)、存活率(67%~75%)及体重(29~41g)持续稳定在较高水平,血清胰岛素水平(21 mIU/L)显著降低(P<0.05),其中尤以160 mg/kg 体重组各项指标最为稳定,可用于辅助降血糖功能试验的研究,而140及180 mg/kg 体重组各项指标波动较大可能会影响试验结果的稳定性。
综上,我们的实验选择体重22~28 g 的昆明小鼠,禁食16 h,并用pH值为4.5的CS溶解的160 mg/kg 体重 ALX腹腔单次注射,连续动态观察6周,获得成模率较高、存活率较高、空腹血糖及血糖曲线下面积较持续稳定在成模水平,血清胰岛素水平下降但不丧失的糖尿病小鼠模型,可用于实验性糖尿病的基础研究及辅助降血糖的功能研究。
我们通过对关键因素的不同组合,动态观察成模后6周的小鼠成模率、存活率、体重、空腹血糖、糖耐量变化情况,并检测血清胰岛素水平,从稳定性及胰岛β细胞功能角度来评价组间差异,筛选出造模药物ALX最适剂量,更具科学性和准确性,为辅助降血糖功能试验的准确评价提供有力的实验依据和保障。
参考文献:
[1] 耿莉萍. 当前我国保健食品市场存在的问题与监管对策 [J]. 食品科学技术学报,2013(03):7-12.
[2] Lenzen S, Panten U. Alloxan: history and mechanism of action [J]. Diabetologia,1988, 31(6):337-342.
[3] 卫生部. 保健食品检验与评价技术规范 [S]. 2003.
[4] 李聪然,游雪甫,蒋建东. 糖尿病动物模型及研究进展 [J]. 中国比较医学杂志,2005, 15(01):59-63.
[5] 刘洪艳,周建平. KM、ICR、NIH三品系小鼠四氧嘧啶法致糖尿病动物模型的比较 [J]. 实验动物科学与管理, 2002, (03): 12-13.
[6] 陈华. 小型猪糖尿病模型 [J]. 中国实验动物学报,2008, (06):458-462.
[7] 叶华虎,袁菊芳,李敏,等. 四氧嘧啶诱发糖尿病模型效果的性别差异 [J]. 中国比较医学杂志,2010, 20(1):19-22.
[8] 黄桂红, 邓航, 李江, 等. 四氧嘧啶腹腔注射致小鼠糖尿病模型因素考察 [J]. 中国医药导报,2012, (01): 15-17.
[9] 樊志奇,杨勇,容蓉,等. 四氧嘧啶制备糖尿病小鼠模型的影响因素研究 [J]. 时珍国医国药,2010, 21(8):1948-1949.
[10] 郭莉,王桂华,杨丽娟,等. 溶媒对四氧嘧啶诱导建立糖尿病小鼠模型的影响 [J]. 中国医药导报,2012(34): 27-28.
[11] 杨明华,杨苏蓓,柴可夫,等. 四氧嘧啶致小鼠糖尿病造模条件优化及稳定性考察[J]. 中药药理与临床,2007(05): 213-216.
[12] 杨明华,柴可夫,杨苏蓓. 四氧嘧啶致糖尿病大鼠模型血糖稳定性考察[J]. 中国比较医学杂志,2006, 16(08): 482-484.
[13] 黄敏,王书奎,王小峰,等. 不同禁食时间对四氧嘧啶糖尿病小鼠模型的血清胰岛素和血糖的影响 [J]. 中国药科大学学报,2001, 32(3):217-220.
[14] 王柳萍,杨斌,周丽. 四氧嘧啶制备小鼠糖尿病模型的影响因素探讨 [J]. 广西医科大学学报,2004, (01): 33-35.
[15] 奚清丽,周伟. 四氧嘧啶致小鼠糖尿病造模条件组合优化研究 [J]. 江苏预防医学,2011, (04):18-20.
[16] 施新猷. 医学动物实验方法 [M]. 人民卫生出版社, 1980;
[17] 黄彦峰,晋玲,赵善民,等. 四氧嘧啶糖尿病小鼠模型的复制与应用体会 [J]. 时珍国医国药,2011, (11): 2784-2785.
[18] 韩丽莎,阎秀英,任健梅,等. Alloxan糖尿病模型复制中的多因素作用 [J]. 内蒙古医学杂志,1996, (06): 340-342.

