Pu催化HNO2氧化U(Ⅳ)的研究
王浩文,周贤明,李高亮,兰 天,刘金平,常尚文,何 辉,段红卫
1.中国原子能科学研究院 放射化学研究所,北京 102413;2.环境保护部 核与辐射安全中心,北京 100082
Pu催化HNO2氧化U(Ⅳ)的研究
王浩文1,周贤明1,李高亮1,兰 天1,刘金平1,
常尚文1,何 辉1,段红卫2,*
1.中国原子能科学研究院 放射化学研究所,北京 102413;
2.环境保护部 核与辐射安全中心,北京 100082
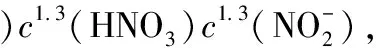
HNO2;U(Ⅳ)氧化;Pu催化;机理
在乏燃料水法后处理的Purex流程中,U(Ⅳ)-N2H4体系以其能迅速将Pu(Ⅳ)还原为Pu(Ⅲ),且不向流程中引入新的盐类物质的特点,常用作铀钚分离的还原剂。在进行钚纯化循环前,为了保证钚的收率,需要破坏1BP中还原剂并将Pu(Ⅲ)完全氧化到Pu(Ⅳ)。因此,在使用U(Ⅳ)-N2H4体系作为铀钚分离还原剂的工艺流程中,需要破坏1BP中的U(Ⅳ)与N2H4,并将Pu(Ⅲ)氧化到Pu(Ⅳ)[1-2]。钚价态的调整通常都采用亚硝酸钠作为氧化剂,它可以在几分钟内将Pu(Ⅲ)全部氧化为Pu(Ⅳ)[3-4]。用亚硝酸钠调节钚价态的优点是快速、安全、操作简单、试剂价格便宜;缺点是向流程中引入了固体盐分,增加了废物处理的困难。为此,用氮氧化物气体代替亚硝酸钠调节钚价态成为了目前常用的方法。该方法调节钚价态的实质仍然是利用HNO2将U(Ⅳ)氧化为U(Ⅵ),并将Pu(Ⅲ)氧化为Pu(Ⅳ)[4]。
有文献[5]报道,钚离子能对HNO2氧化U(Ⅳ)的反应起到催化作用,但是钚对该反应的催化能力强弱以及催化反应发生的途径,并没有文献报道。为此本工作拟研究钚存在下HNO2氧化U(Ⅳ)的反应,并推导其中可能的反应途径。
1 实验部分
1.1试剂与仪器
UO2(NO3)2溶液由在硝酸溶液中溶解UO2(NO3)2固体所得。Pu(NO3)4溶液,用2606 型阴离子交换树脂(自制)以阴离子交换法制备和纯化制得。N2H5NO3溶液由中和市售水合肼(分析纯)所得。其他试剂为市售分析纯。
U(Ⅳ)储备液采用电解法制备。自制带隔膜的H形玻璃电解池,铂网作为阳极材料、钛片作为阴极材料。
LS-6000L型液体闪烁谱仪,美国Bechman公司;UV-1000紫外可见分光光度计,Lab-Tech公司;FJ414型低本底α闪烁探头,α能谱仪,北京核仪器厂。
1.2实验方法
将所需的U(Ⅳ)、Pu(Ⅳ)溶液依次加入到离心管中,调节溶液酸度后准确加入所需的NaNO2溶液,充分振荡至溶液中气泡消失并将溶液转移至厚度为1 cm的比色皿中,观察并记录溶液在350~1 100 nm吸光度值随时间的变化情况。参比溶液为含相同浓度的硝酸溶液。
U(Ⅳ)浓度的分析采用分光光度法。
Pu浓度的分析采用制源测α计数法。
1.3实验数据处理方法
假定U(Ⅳ)的氧化速率对U(Ⅳ)浓度为一级反应。
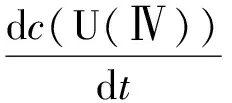
kc(U(Ⅳ))cm(HNO3)cn(HNO2)
(1)
lnka=lnk+mlnc(HNO3)+nlnc(HNO2)
(2)
由于反应过程中U(Ⅳ)在648 nm处的摩尔消光系数未发生改变,因此依据Lambert-Beer定律,假定反应在t、t0和反应结束时刻t∞的吸光度值分别为At、A0和A∞,则c0(U(Ⅳ)) =A0/(εb),ct(U(Ⅳ))=At/(εb)。式中:ε,摩尔吸光系数;b,比色皿长度,为1 cm。方程(2)中表观速率常数ka是温度、酸度、催化剂(Pu离子)浓度、NaNO2浓度的函数,单位为min-1;k是温度的函数。
2 结果和讨论
2.1Pu离子对U(Ⅳ)氧化的催化作用
Pu离子存在条件下U(Ⅳ)在648 nm处吸光度值随时间的变化示于图1。由图1可知,随着反应时间的延长,U(Ⅳ)的吸收峰(432、481、544、648 nm处)逐渐降低;相应U(Ⅵ)的吸收峰(404、414、426 nm处)则逐渐增大。当反应时间为18 min时,648 nm处U(Ⅳ)的吸收峰基本消失,结果表明,U(Ⅳ)以较快的速度不断氧化至U(Ⅵ)。
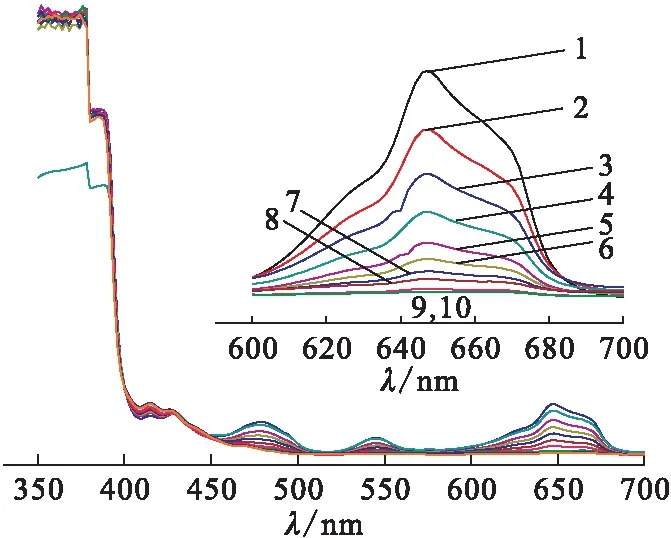
ρ(U(Ⅳ))=8.00 g/L,c(HNO3)=1.5 mol/L,c(NaNO2)=0.21 mol/L,ρ(Pu(Ⅳ))=0.1 g/L,θ=29 ℃
含Pu和不含Pu条件下U(Ⅳ)在648 nm处吸光度值随时间的变化示于图2。对比曲线1和2可以发现,当体系中不含HNO2时,在考察的时间20 min内648 nm处的吸光度值基本未发生变化;而当体系中含有浓度为0.21 mol/L的HNO2时U(Ⅳ)的吸光度值降低的速度加快,在考察时间20 min内约有16%的U(Ⅳ)发生了氧化。结果表明,HNO2能以较快的速度将U(Ⅳ)氧化为U(Ⅵ)。对比曲线2和曲线3可以发现,当向体系中加入浓度仅为U(Ⅳ)浓度1.66%的Pu后,U(Ⅳ)氧化的速度明显加快。在反应时间为16 min时,在含Pu的实验中U(Ⅳ)的氧化率在99.9%以上,而不含钚的实验中U(Ⅳ)的氧化率仅为16.1%。结果表明,Pu能对HNO2氧化U(Ⅳ)的反应起到明显的催化作用。对比曲线3、4、5可以看出,Pu浓度增加,U(Ⅳ)的氧化速率加快。
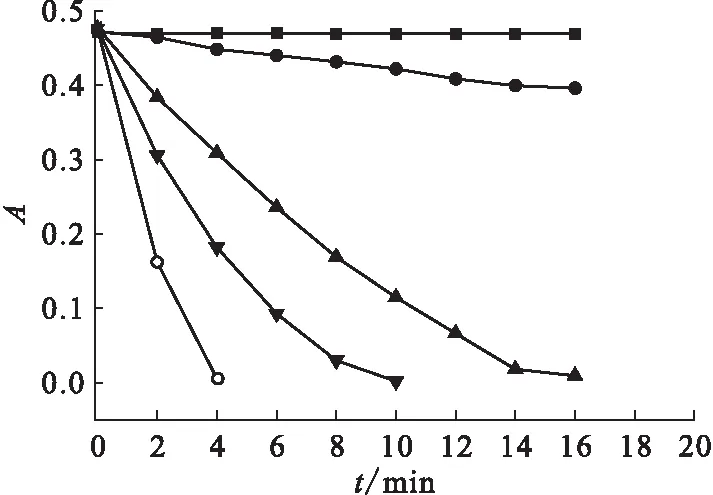
λ=648 nm,ρ(U(Ⅳ))=8.00 g/L,c(HNO3)=1.5 mol/L,θ=29 ℃■——c(HNO2)=0,c(Pu)=0;●——c(HNO2)=0.21 mol/L,c(Pu)=0;▲——c(HNO2)=0.21 mol/L,c(Pu)=0.42 mmol/L;▼——c(HNO2)=0.21 mol/L,c(Pu)=0.84 mmol/L;○——c(HNO2)=0.21 mol/L,c(Pu)=1.26 mmol/L
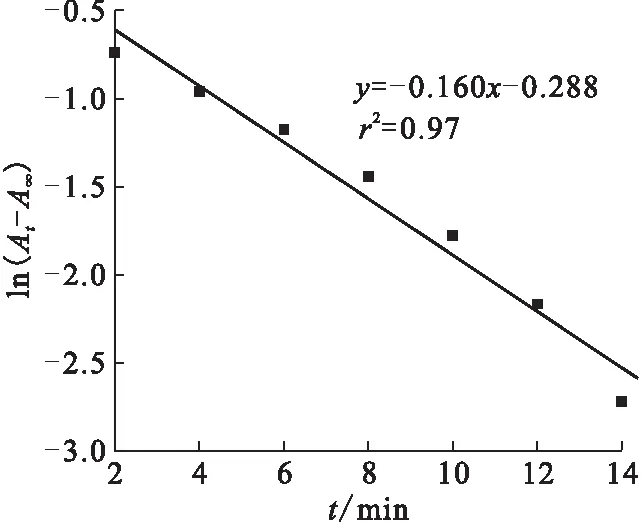
图3 Pu离子存在条件下ln(At-A∞)随时间变化关系Fig.3 Relationship between ln(At-A∞) and t in the presence of Pu ion
取图1中U(Ⅳ)在648 nm处的吸光度值,取其对数值并按照方程(1)作图,结果示于图3。由图3可知,ln(At-A∞)与t呈线性关系,证明方程(1)所做的假设正确。在图3中,U(Ⅳ)氧化的表观速率常数ka=0.160 min-1。
2.2HNO3浓度对U(Ⅳ)氧化效果的影响
不同HNO3浓度条件下ln(At-A∞)随时间变化关系示于图4。由图4可知,在HNO3浓度分别为1.0、1.8、3.0 mol/L的实验条件下,U(Ⅳ)氧化的表观速率常数ka分别为0.087、0.176、0.353 min-1。以不同HNO3浓度下的表观速率常数值,按照方程(2)作图,结果示于图5。由图5得到HNO2氧化U(Ⅳ)的反应中,关于HNO3的级数为1.3。
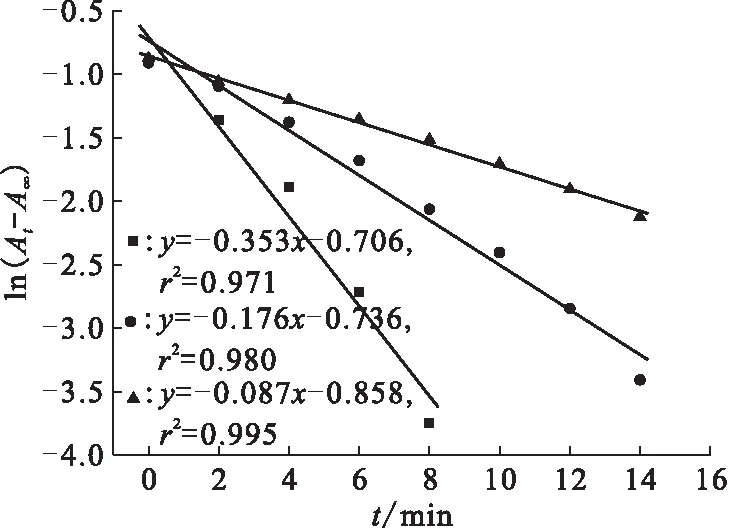
ρ(U(Ⅳ))=8.00 g/L,c(NaNO2)=0.21 mol/L,ρ(Pu(Ⅳ))=0.1 g/L,θ=29 ℃c(HNO3),mol/L:■——1.0,●——1.8,▲——3.0
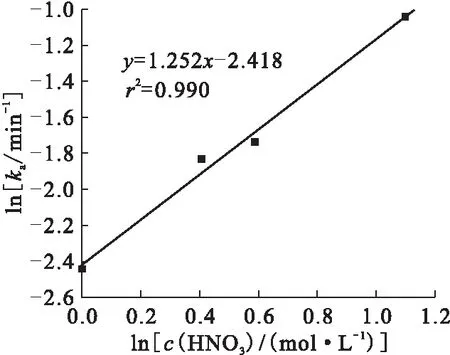
图5 不同HNO3浓度下ln ka随lnc(HNO3)变化关系Fig.5 Relationship between ln ka and lnc(HNO3) at different concentration of HNO3
2.3NaNO2浓度对U(Ⅳ)氧化效果的影响
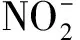
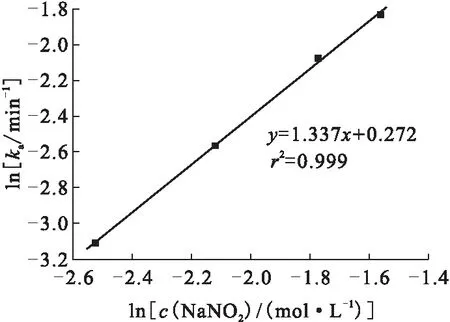
图6 不同NaNO2浓度下ln ka随lnc(NaNO2)变化关系Fig.6 Relationship between ln ka and lnc(NaNO2) at different concentration of NaNO2
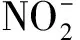

表1 不同实验条件下的表观速率常数值Table 1 Values of kaat different experiment conditions
3 反应历程探讨
在含有HNO2、U(Ⅳ)、Pu(Ⅲ)的HNO3介质中,U(Ⅳ)能直接与HNO3和HNO2发生反应,其化学反应式如式(3)和式(4)所示[6-7]。

(3)
(4)
同时U(Ⅳ)又能迅速将反应体系中的Pu(Ⅳ)还原为Pu(Ⅲ),其化学反应方程式如式(5)所示[5-7]。

(5)
HNO3介质中反应(5)的动力学方程[4,8]如式(6)所示:
(6)
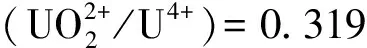
依据文献可知,HNO3介质中HNO2氧化Pu(Ⅲ)的反应能以较快的速度发生,其化学反应方程式如式(7)和式(8)所示:

Pu4++NO+H2O
(7)
(8)
由以上分析可以发现,Pu催化HNO2氧化U(Ⅳ),是由于Pu(Ⅲ)能被HNO2氧化为Pu(Ⅳ),而生成的Pu(Ⅳ)又能迅速将U(Ⅳ)氧化为U(Ⅵ)。
4 结 论
[1]顾忠茂,叶国安.先进核燃料循环体系研究进展[J].原子能科学技术,2002,36(2):160-167.
[2]叶国安,张虎.核燃料后处理技术发展及其放射化学问题[J].化学进展,2011,23(7):1289-1294.
[3]于恩江,刘黎明,费洪澄,等.U(Ⅳ)用作Purex过程中Pu(Ⅳ)还原剂的研究[J].核化学与放射化学,1992,14(4):207-214.
[4]胡晓丹,丁戈龙,刘文彬.钚化学进展,1967-2000[M].北京:原子能出版社,2008:28-29.
[5]张绍绮,隗秀芳,叶国安,等.Purex流程以N2O4调节钚价态的研究[J].原子能科学技术,1993,27(3):130-137.
[6]Achimori S T. Numerical simulation for chemical reactions of actinide elements in aqueous nitric acid solution[J]. J Nucl Sci Technol, 1991, 28(3): 218-227.
[7]Marchenko V I, Dvoeglazov K N, Volk V I. Use of redox reagents for stabilization of Pu and Np valence forms in aqueous reprocessing of spent nuclear fuel: chemical and technological aspects[J]. Radiochem, 2009, 51(4): 329-344.
[8]Koltunov V S, Marchenko V I, Nikiforov A S, et al. The role taken by technetium in the oxidation-reduction processes used in irradiated-fuel technology[J]. Atomnaya Energiya, 1986, 60(1): 35-41.
[9]Taylor R J, May I. Advances in actinide and technetium kinetics for applications in process flowsheet modeling[J]. Sep Sci Technol, 2001, 36(5&6): 1225-1240.
[10]任凤仪,周镇兴.国外核燃料后处理[M].北京:原子能出版社,2006:231-232.
[11]Koltunov V S, Marchenko V I, Frolov K M, et al. Kinetics of some oxidation reduction reactions of uranium and neptunium in organic trialkyl phosphates solutions: international conference “Actinides 1989”, Tashkent(USSR), September 24-29, 1989[C]. Moscow: Nauka, 1989: 353-354.
ReactionBetweenU(Ⅳ)andNitrousAcidCatalyzedbyPlutonium
WANG Hao-wen1, ZHOU Xian-ming1, LI Gao-liang1, LAN Tian1, LIU Jin-ping1,
CHANG Shang-wen1, HE Hui1, DUAN Hong-wei2,*
1.China Institute of Atomic Energy, P. O. Box 275(26), Beijing 102413, China;
2.Nuclear and Radiation Safety Center of Ministry Environmental Protection, Beijing 100082, China
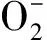
HNO2; oxidation of U(Ⅳ); catalytic effect of plutonium; mechanism
2014-04-19;
2014-05-07
王浩文(1988—),男,山东寿光人,硕士研究生,核燃料循环与材料专业
*通信联系人:段红卫(1978—),男,江苏新沂人,机械专业,E-mail: duanhongwei0119@126.com
O614.353
A
0253-9950(2014)05-0295-05
10.7538/hhx.2014.36.05.0295

