顶空气相色谱法测定注射用甲磺酸吉米沙星中基因毒性杂质
范达,涂家生
(中国药科大学药剂学教研室,江苏 南京210000)
顶空气相色谱法测定注射用甲磺酸吉米沙星中基因毒性杂质
范达,涂家生*
(中国药科大学药剂学教研室,江苏 南京210000)
目的:建立测定注射用甲磺酸吉米沙星中甲磺酸烷基酯类基因毒性杂质的顶空气相色谱法。方法:以Supelco毛细管柱(30 m×250 μm,0.25 μm)为色谱柱,程序升温;氮气为载气,流速为0.5 mL•min-1;采用微池电子捕获检测器,检测器温度为250 ℃;顶空进样,平衡温度为60 ℃,平衡时间为30 min,进样口温度为110 ℃,进样量为1 mL;分流比为1∶10。 结果:基因毒性杂质甲磺酸甲酯、甲磺酸乙酯和甲磺酸异丙酯在限度为20%~120%的范围内线性关系良好,定量限分别为0.010 0、0.250 0和1.250 0 μg•L-1,检测限分别为0.002 0、0.010 0和0.250 0 μg•L-1,平均回收率分别为99.20%、99.45%和99.98%(n=9)。结论:该方法准确、简便,适用于甲磺酸吉米沙星中基因毒性杂质的检测及限度控制。
顶空气相色谱法;甲磺酸吉米沙星;基因毒性杂质
甲磺酸吉米沙星(gemifloxacin mesylate)是由韩国LG Life Sciences公司开发的第4代氟喹诺酮类抗菌素,具有强效广谱抗菌活性,2006 年7月在我国获准上市。目前国内外上市的甲磺酸吉米沙星均为片剂,而对于一些重症病人、住院病人或肠胃道吸收有障碍的病人来说,该药仅有片剂是不够的,开发其注射剂型非常必要。但注射剂型对杂质要求更加严格,因此,需建立对注射用甲磺酸吉米沙星中潜在基因毒性杂质进行测定再评估的有效方法。
甲磺酸盐药物中可能含有甲磺酸烷基酯类的基因毒性杂质,其来源是合成时低级醇和甲磺酸发生反应而生成的甲磺酸甲酯(MMS)、甲磺酸乙酯(EMS)、甲磺酸异丙酯(IMS)等[1],这些甲磺酸酯的DNA 烷基化作用会产生诱变效应、致癌效应和致畸效应[2]。为了防止类似甲磺酸奈非那韦不良事件的发生,欧洲药品管理局(EMEA)在2008年发布了要求生产企业对所有甲磺酸盐类产品进行基因毒性杂质再评估并出示“生产声明”的函件,其中指出,对于无足够证据证明其基因毒性阈值的化合物,可根据毒理学关注阈值(threshold of toxicological concern,TTC)来设定限度,经评价,基因毒性化合物的TTC值即每人摄入限量应为1.5 µg·d-1[3]。注射用甲磺酸吉米沙星的人体摄取量一般为260 mg·d-1,根据TTC值可限定其中所含甲磺酸烷基酯类基因毒性杂质总量(质量分数)不得超过5×10-6。本文在参考欧洲药典7.5版“2.5.38”衍生化法的基础上,以氮气为载气,采用顶空气相色谱(GC)法测定注射用甲磺酸吉米沙星中MMS、EMS和IMS的含量。
1 仪器与试药
Agilent 7890A 气相色谱仪;Agilent ChemStation 化学工作站;HG-1083A型高纯氮气发生器(北京科普生分析科技有限公司);BP211D型电子天平(Sartorius公司)。
MMS对照品(J&K公司,批号:LA90M69,纯度:99%);EMS对照品(纯度:99%,Aladdin公司,批号:C1329031); IMS对照品(纯度:97%,苏州亚科化学试剂股份有限公司,批号:YK2013060501);甲磺酸正丁酯(BMS)标准品(苏州亚科化学试剂股份有限公司,批号:YK2013061801);甲磺酸吉米沙星原料药样品(LG Life Sciences公司,批号:QVB06004);注射用甲磺酸吉米沙星样品(丽珠医药集团,批号:070501、070601、110101);乙腈为色谱纯。
2 方法与结果
2.1 色谱条件
色谱柱:Supelco毛细管柱(30 m×250 µm,0.25 µm);载气:氮气;流速:0.5 mL·min-1;柱升温程序:先以10 ℃·min-1由40 ℃升至110 ℃,再以50 ℃·min-1升至240 ℃;检测器:微池电子捕获检测器(uECD),温度为250 ℃;顶空进样:顶空平衡温度为60 ℃,平衡时间为30 min,进样口温度为110 ℃,进样量为1 mL;分流比:1:10。
2.2 溶液配制
溶液A:取碘化钠60.0 g和无水硫代硫酸钠30 mg,加水溶解并稀释至50 mL,即可。
内标液:取25 µL BMS标准品溶于水-乙腈(20:80)混合溶剂中,并定容至25 mL;吸取该溶液50 µL,用混合溶剂稀释至10 mL,再吸取1 mL,稀释至25 mL,即可。
对照品储备液:精密称取MMS、EMS和IMS对照品各25 mg,加入甲苯使溶解并定容至5 mL;取该溶液50 µL,用内标液定容至25 mL,即可。
对照品溶液:吸取对照品储备溶液625 µL,用内标液稀释至25 mL;吸取该溶液和溶液A各0.5 mL,置20 mL顶空瓶中,立即压盖(覆膜胶塞和铝盖),即可。
供试品溶液:精密称取样品25.0 mg,置顶空瓶中,加入溶液A和内标液各0.5 mL,立即压盖,即可。
2.3 方法专属性考察以及杂质含量测定方法与限度
取平衡后的对照品溶液和空白溶剂(水-乙腈混合溶剂)顶空瓶内气体各1 mL,按“2.1”项下色谱条件,分别进样,记录色谱图(见图1)。由图1可见,各杂质峰分离良好,空白溶剂对各杂质的检测无影响。依据色谱图,样品中各杂质含量(质量分数)的计算公式为:A2×I1×W1×G×0.05×10-6/(A1×I2×W2),其中A1为对照品溶液中某杂质峰面积,A2为供试品溶液中某杂质峰面积,G为某杂质对照品纯度,I1为对照品溶液中内标峰面积,I2为供试品溶液中内标峰面积,W1为对照品储备液中某杂质对照品质量,W2为供试品溶液中样品质量。供试品溶液色谱图中若有杂质峰,各杂质峰面积不得大于对照品溶液中相应杂质峰面积,且按上式计算的各杂质含量的总量(质量分数)不得超过5×10-6。
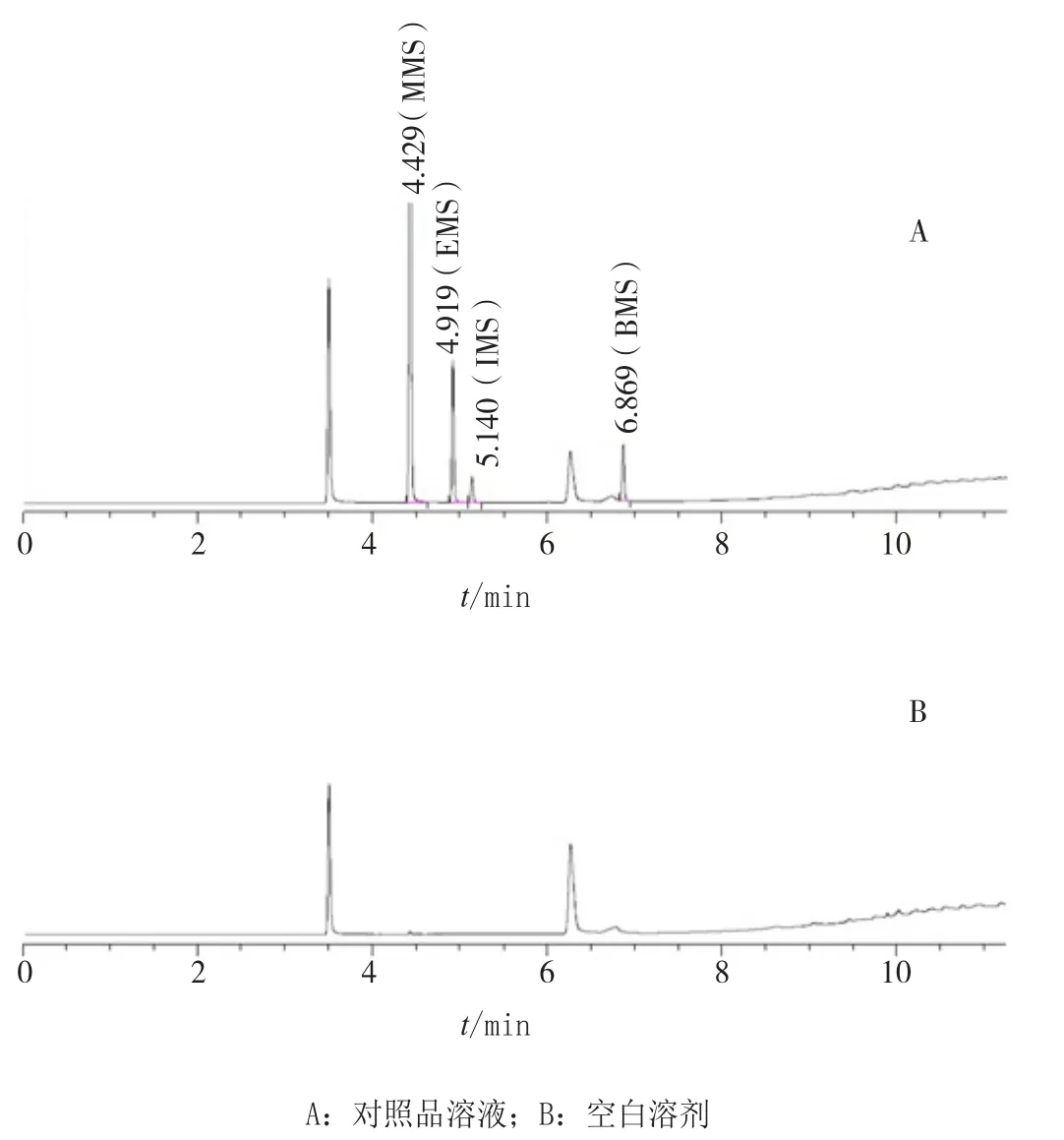
图1 专属性实验色谱图Figure 1 Chromatograms from specificity test
2.4 线性考察
分别精密量取对照品储备液125、250、375、500、625和725 µL 置25 mL容量瓶中,加内标液定容至刻度,摇匀,制成检测限度为20%、40% 、60%、80%、100%和120%的对照品溶液,按“2.1”项下色谱条件,进样,记录色谱图。
以对照品溶液质量浓度(C,mg·L-1)为横坐标,峰面积(A)为纵坐标,绘制MMS、EMS和IMS的标准曲线,分别获得其线性回归方程:

结果表明,MMS、EMS和IMS在限度为20%~120%的范围内线性关系良好。
2.5 检测限和定量限
取对照品溶液,加内标液逐级稀释成不同质量浓度,按“2.1”项下色谱条件,进样检测。结果,在信噪比约为10时,测得MMS、EMS和IMS的定量限分别为0.010 0、0.250 0和1.250 0 µg·L-1;在信噪比约为3时,测得MMS、EMS和IMS的检测限分别为0.002 0、0.010 0和0.250 0 µg·L-1。
2.6 精密度
取对照品溶液,按“2.1”项下色谱条件,连续进样6次,记录色谱图。结果,测得MMS、EMS和IMS峰面积的RSD分别为4.78%、3.89%和3.63%(n=6)。
2.7 重复性
按“2.2”项下方法,精密称取注射用甲磺酸吉米沙星样品(批号:110101)25 mg,配制供试品溶液,平行6份,并按“2.1”项下色谱条件,进样检测,记录色谱图。结果,测得MMS和EMS峰面积的RSD分别为4.49%和3.77%(n=6),但IMS未检出。
2.8 回收率
分别精密量取对照品储备液500、625和725 µL 置25 mL容量瓶中,加内标液定容至刻度,摇匀,制成检测限度为80%、100%和120%的对照溶液。精密称取注射用甲磺酸吉米沙星样品(批号:110101)25.0 mg,至20 mL顶空瓶中,加入溶剂A 0.5 mL,内标液0.5 mL,立即压盖,作为样品本底溶液。另取9份25.0 mg注射用甲磺酸吉米沙星样品(批号:110101),精密称定,置顶空瓶中,分成3组(每组3份),分别加入检测限度为80%、100%及120%的对照溶液0.5 mL,并各加入溶剂A 0.5 mL,密封,作为供试品溶液。此外,再按“2.2”项下要求配制对照品溶液。按“2.1”项下色谱条件,将样品本底溶液、供试品溶液和对照品溶液分别进样检测,记录色谱图。按“2.3”项下公式计算样品本底溶液和供试品溶液中各杂质含量(质量分数),分别记做已知量和测得量,而各供试品溶液中加入的对照溶液所含各杂质含量记做加入量,最后按公式计算回收率:回收率=[(测得量-已知量)/加入量]×100%。结果测得,MMS、EMS和IMS的平均回收率分别为99.20%、99.45%和99.98%,RSD分别为4.00%、3.84%和3.99%(n=9)。
2.9 样品测定
分别精密称取原料药和各批次注射用甲磺酸吉米沙星样品以及各杂质对照品,按“2.2”项下方法,配制供试品溶液以及对照品溶液,并按“2.1”项下色谱条件,进样检测,再按“2.3”项下公式,计算样品中各杂质含量,结果见表1。

表1 各样品中基因毒性杂质的测定结果Table 1 Determination results of genotoxic impurities in different samples
由表1可见,各甲磺酸吉米沙星样品中均存在MMS和EMS,而IMS未检出,杂质总量(质量分数)都小于5×10-6,符合限度要求。
3 讨论
甲磺酸吉米沙星除了其原料在合成过程中可能因使用甲醇、乙醇等低级醇类而产生并引入MMS、EMS等基因毒性杂质外,其在制剂过程也可能是因生产设备曾用甲醇等低级醇清洗而将残留溶剂引入,导致制剂中基因毒性杂质增多,而且随着制剂放置时间的增长,其中基因毒性杂质含量还会逐渐增加,这可能是其间残留溶剂与甲磺酸不断发生反应而生成基因毒性杂质所致。本文中,甲磺酸吉米沙星注射制剂放置6年的批号070501和070601样品中基因毒性杂质含量(质量分数)比放置2年的批号110101样品高约6×10-8,不过总量(质量分数)也仅约为1.7×10-7,仍远小于杂质限度5×10-6,即所有制剂样品中的基因毒性杂质含量都在限度范围内。为了避免甲磺酸烷基酯类杂质的产生,从根本上杜绝基因毒性物质引起的风险,药物活性成分的生产及生产设备的清洗过程应尽量避免使用低级脂肪醇。
本文所建立的顶空GC法能有效检测出甲磺酸吉米沙星原料及注射制剂中各基因毒性杂质,且经济、便捷,适用于该药中基因毒性杂质的检测及限度控制。
[1]Sitaram C, Rupakula R B. Determination of alkyl methanesulfonates in doxazosin mesylate by gas chromatography-mass spectrometer [J]. Indian J Pharm Sci, 2011, 73(1): 107-110.
[2]García A, Rupérez F J, Ceppa F, et al. Development of chromatographic methods for the determination of genotoxic impurities in cloperastine fendizoate [J]. J Pharm Biomed Anal, 2012, 61: 230-236.
[3]European Medicines Agency. Evaluation of medicines for human use, guideline on the limits of genotoxic impurities[EB/OL].[2014-01-27]. http://www.rsihata.com/updateguidance/emea/old/519902en.pdf.
Determination of Genotoxic Impurities in Gemifoxacin Mesylate for Injection by Head-space GC
FAN Da, TU Jiasheng
(Department of Pharmaceutics, China Pharmaceutical University, Nanjing 210000,China)
Objective: To establish a head-space GC method for the determination of the genotoxic impurities in gemifoxacin mesylate for injection. Methods: A Supelco capillary column (30 m×250 μm,0.25 μm) (temperature programming), nitrogen as carrier gas (fow rate: 0.5 mL•min-1) and uECD(temperature: 250 ℃) were used . H-space sampling was conducted (equilibrium temperature: 60 ℃, equilibrium time: 30 min, injection port temperature: 110 ℃, injection volume: 1 mL ) with a split ratio of 1:10. Results: The genotoxic impurities, methyl methanesulfonate, ethyl methanesulfonate and isopropyl methanesulfonate showed good linear relationships in the limitation range of 20%-120%.Their LOQs were 0.010 0, 0.250 0 and 1.250 0 μg•L-1respectively. Their LODs were 0.002 0, 0.010 0, 0.250 0 μg•L-1respectively. Their average recoveries were 99.20%, 99.45% and 99.98%(n=9). Conclusion: The method is accurate and convenient. It is suitable for the determination and limitation control of the genotoxic impurities in gemifoxacin mesylate.
head-space GC; gemifoxacin mesylate; genotoxic impurity
O657.71
B
1001-5094(2014)03-0220-04
接受日期:2013-12-23
*通讯作者:涂家生,教授;
研究方向:药物新剂型与新技术;
Tel:025-83271305;E-mail:jiashengtu@yahoo.com.cn

