氧化苦参碱防治慢性肾纤维化机理的实验研究
陈晨 金玉 西安市儿童医院新生儿科 (西安 710003)
肾病综合征(nephrotic syndrome,NS)是小儿常见病、多发病,它是一种病理类型各异、临床病程不同、预后差别很大的综合征。据国内统计,在因泌尿系统疾病住院的患儿中,本征仅次于急性肾炎,部分患儿病情反复发作,病程迁延不愈,严重影响小儿健康。半个世纪以来,随着有效抗菌药物、肾上腺皮质激素和免疫抑制剂的相继问世,小儿肾病综合征的预后和转归有了显著的变化,但仍有部分患儿病情迁延不愈,肾功能进行性恶化,最终转归为慢性肾功能衰竭(chronic renal failure,CRF),这种转归最终形成以肾脏纤维化为病理基础的终末肾。小儿肾病的研究重点和难点就落在了如何防治不可逆的肾脏纤维化的发生,以提高患儿远期存活率与生存质量。NF-κB是一个具有多向性调节作用的核转录因子,参与了多种炎症性细胞因子、趋化因子、促纤维化因子的合成,细胞增殖、ECM交联、细胞凋亡和成纤维细胞等的分化过程[1]。NF-κB与抑制性-κB(inhibitory kappa B,IκB)构成了 NF-κB/IκB信号传导通路,这就为研究肾脏纤维化的机理提供了重要的研究方向。近年来氧化苦参碱(OM)由于具有多方面的药理活性而引起了人们广泛的重视和兴趣,已有许多研究表明氧化苦参碱在抗肝纤维化和皮肤纤维化中有一定疗效[2,3]。为此,我们曾建立了大鼠慢性纤维化模型,通过分析大鼠肾组织中 TGF-β1/Smads、NF-κB/IκB信号传导通路,发现OM对慢性肾脏损害有保护作用[4,5]。本研究是在前期工作基础上进一步研究不同浓度组氧化苦参碱对肾纤维化的抑制作用,为OM早日应用临床提供理论依据。
1 材料与方法
1.1 药物、试剂 氧化苦参碱,宁夏紫荆花药业有限公司,批号40040909;苯钠普利,北京诺华制药有限公司,10mg×14片,批号04121;盐酸阿霉素10mg/瓶,浙江海正药业股份有限公司,批号040801。鼠抗人NF-κB P65单克隆抗体、兔抗人IκBα多克隆抗体购自美国Santa Cruse公司;PV-6001,PV-6002二步法免疫组织化学试剂盒、DAB显色试剂盒购自北京中山生物技术有限公司。其他试剂均为国产分析纯。
1.2 动 物 大鼠:Wistar大鼠150只,雄性。2月龄,体重180~210g,购自兰州大学基础医学院动物室。
1.3 模型的制备与分组 150只Wistar大鼠适应性喂养2周,随机分为5组:正常对照组(A组)、模型对照组(B组)、苯钠普利治疗组(C组)、OM 50mg/kg治疗组(D组)、OM 100mg/kg治疗组(E组)。每组30只,其中B、C、D、E组大鼠分别于实验第1d、第21d尾静脉注射阿霉素(2mg/kg·d),A组予等量生理盐水[6],C、D、E组于第2次注射后分别给予苯钠普利6mg/kg·d、OM 50mg/kg·d、OM100mg/kg·d灌胃,A组予等量生理盐水灌胃直至实验结束。以上各组动物分笼喂养,给予普通饲料及自由饮水。各组大鼠在第2次注射后4周、8周、12周、16周、20周、24周分6批处死进行指标检测。
1.4 24h尿蛋白及血生化检测 采用三氯乙酸法于第1次注射前和第2次注射后第1d收集24h尿液测蛋白(第1次注药前为0周),之后以第2次注药后计算周数,每隔4周测1次尿蛋白。于4周、8周、12周、16周、20周、24周末处死大鼠之前取股静脉血,用全自动生化分析仪测定血清白蛋白(albumin,Alb)、肌酐(creatinine ,Cr)、尿素氮(blood urea nitrogen,BUN)。
1.5 肾脏病理检查 大鼠处死后立即用10%福尔马林固定肾组织,常规石蜡包埋,切片厚4μm,行HE染色后观察肾脏的病理改变。参照Raij等[7]的方法评估肾小球硬化程度,然后计算肾小球硬化指数(glomerulosclerosis index,GSI)表示肾小球硬化程度。
1.6 采用PV二步法检测肾组织中的NF-κB、IκB 主要操作步骤为:取4μm厚的10%甲醛固定的石蜡切片,常规脱蜡水化,浸入3%过氧化氢(H2O2)5min,PBS冲洗3次,滴加稀释的一抗(NF-κB P65单克隆抗体和IκBα多克隆抗体均为1∶50稀释度)滴加适量山羊抗小鼠(或兔)IgG抗体-HRP多聚体,PBS冲洗3次3,3’-二氨基联苯胺(DAB)显色。苏木素轻度复染,脱水、透明、封片、镜检肾实质及间质细胞内有棕褐色颗粒为阳性。结果采用Olympus BX50图像分析定量仪,每张切片在400倍下随即选取15个肾小球,计算每个肾小球内抗体染色阳性细胞数,以均值表示每例肾小球中阳性细胞数;20个高倍视野下阳性肾小管数占总肾小管数的百分数,均值表示每例肾小管中的阳性率[8]。
2 结 果
2.1 24h尿蛋白检测结果 在第2次注药后的第1d,B、C、D、E组的24h尿蛋白排出量较A组开始增多(P<0.01),B组的尿蛋白于16周末达到高峰,之后维持在较高水平,而C、D、E三组的尿蛋白排出量于第4周后开始低于B组(P<0.01),以后尿蛋白有所增加,但均不明显;12周后,C、E两组的尿蛋白水平低于D组(P<0.01),但C、E间差异无显著性(P>0.05)。
2.2 血生化检测结果 B组大鼠Alb于第8周开始较A组显著降低(P<0.05),D组大鼠的Alb于第12周后较A组显著降低(P<0.05),C、E两组的Alb于20周开始高于B组而低于A组(P<0.05),第24周时,E组的Alb低于D组(P<0.05),其他时期C、D、E三组间差异无显著性(P>0.05);B组大鼠BUN、Cr在第12周后较A、C、D、E组增多(P<0.01),24周时,D组BUN高于A组(P<0.05)而C、D、E组Cr高于 A组(P<0.05),其他时期C、D、E三组间差异无显著性(P>0.05)。
2.3 肾脏病理改变 光镜下4周末各组大鼠肾组织未见明显改变;8周末B组大鼠肾组织中部分肾小球细胞可见空泡变性,12周时可见肾小球系膜细胞轻度增生,肾小球代偿性肥大;16周时肾小球系膜细胞呈中度增生,系膜区增宽,部分毛细血管腔变窄甚至完全闭塞,20周时少数小球内可见球囊粘连,局灶、节段性硬化;24周时上述病变加重,部分小球呈全球硬化,并发生玻璃样变性。C、D、E组大鼠的肾小球硬化较轻,20周时才与A组具有显著性差异(P<0.05)。肾小管和间质结构在从第4周开始可见远曲小管蛋白管型;16周后远曲小管蛋白管型明显增多,20周后部分近曲小管萎缩,小管上皮细胞肿胀,颗粒变性,坏死、脱落明显,间质单个核细胞浸润和纤维化;24周时,以上病变加重,在萎缩的肾小管周围可见纤维化组织包围。C、D、E组的肾小管和间质改变较轻。
2.4 NF-κB在阿霉素大鼠肾组织中的表达(见图1~4)A组大鼠肾组织可见少许肾小球系膜细胞和肾小管上皮细胞有较弱的 NF-κB表达,8周后 B、C、D、E肾组织 NF-κB的表达与A组相比显著增强(P<0.01),并且随时间的延长呈逐渐增强的趋势,主要见于肾小球系膜细胞、肾小球囊侧壁上皮细胞和肾小管上皮细胞。如表1所示,C、D、E组第8周后较B组大鼠肾组织中NF-κB的表达显著下降(P<0.01),C、E两组肾小球及肾小管NF-κB的表达分别在16周和12周后低于D组(P<0.05),但C、E两组间比较差异无显著性(P>0.05)。
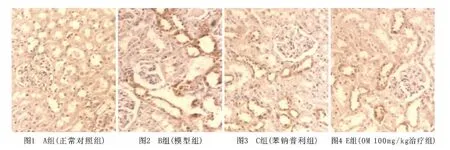
图1~4 各组24周末NF-κB指标的表达 (免疫组化染色×200)
2.5 IκB在阿霉素大鼠肾组织中的表达(见图5~8) A组大鼠肾组织中IκB表达水平较高,主要表达于肾小球系膜细胞和肾小管上皮细胞;B、D组肾组织表达明显减弱,且随时间的延长呈逐渐降低的趋势,如表2所示,C、D、E组大鼠肾小球和肾小管中IκB的表达在第8周后低于A组高于B组(P<0.01),C、E两组肾组织中IκB的表达于16周后高于D组(P<0.05),C、E两组间比较差异无显著性(P>0.05)。
表1 各组大鼠不同时期NF-κB在肾组织中的表达(,n=5)
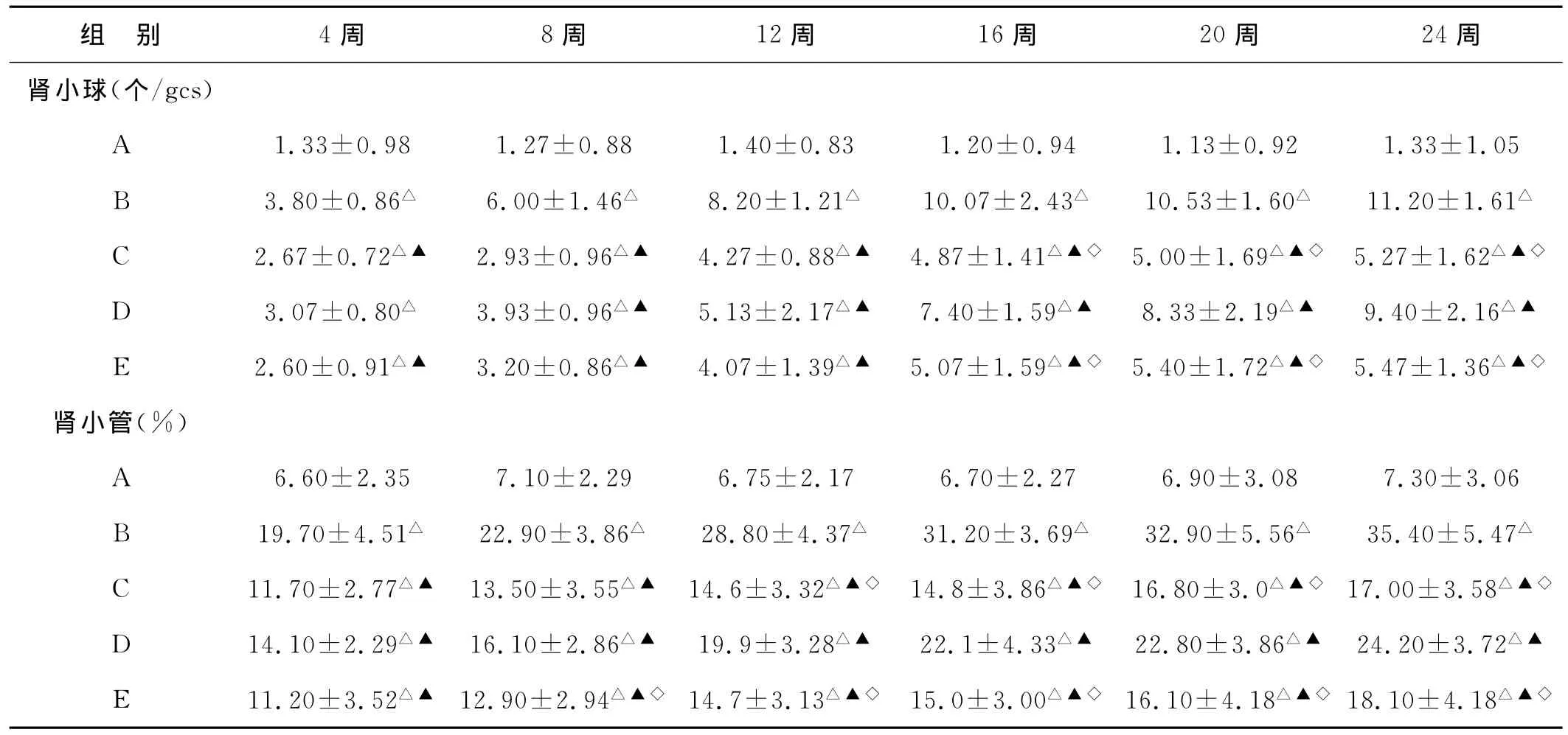
表1 各组大鼠不同时期NF-κB在肾组织中的表达(,n=5)
注:△与A组相比,P<0.01;▲与B组相比,P<0.05;◇与D组相比,P<0.05
组 别 4周 8周 12周 16周 20周 24周肾小球(个/gcs)A 1.33±0.98 1.27±0.88 1.40±0.83 1.20±0.94 1.13±0.92 1.33±1.05 B 3.80±0.86△ 6.00±1.46△ 8.20±1.21△ 10.07±2.43△ 10.53±1.60△ 11.20±1.61△C 2.67±0.72△▲ 2.93±0.96△▲ 4.27±0.88△▲ 4.87±1.41△▲◇ 5.00±1.69△▲◇ 5.27±1.62△▲◇D 3.07±0.80△ 3.93±0.96△▲ 5.13±2.17△▲ 7.40±1.59△▲ 8.33±2.19△▲ 9.40±2.16△▲E 2.60±0.91△▲ 3.20±0.86△▲ 4.07±1.39△▲ 5.07±1.59△▲◇ 5.40±1.72△▲◇ 5.47±1.36△▲◇肾小管(%)A 6.60±2.35 7.10±2.29 6.75±2.17 6.70±2.27 6.90±3.08 7.30±3.06 B 19.70±4.51△ 22.90±3.86△ 28.80±4.37△ 31.20±3.69△ 32.90±5.56△ 35.40±5.47△C 11.70±2.77△▲ 13.50±3.55△▲ 14.6±3.32△▲◇ 14.8±3.86△▲◇ 16.80±3.0△▲◇ 17.00±3.58△▲◇D 14.10±2.29△▲ 16.10±2.86△▲ 19.9±3.28△▲ 22.1±4.33△▲ 22.80±3.86△▲ 24.20±3.72△▲E 11.20±3.52△▲ 12.90±2.94△▲◇ 14.7±3.13△▲◇ 15.0±3.00△▲◇ 16.10±4.18△▲◇18.10±4.18△▲◇
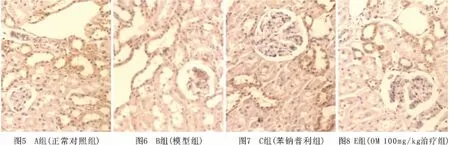
图5~8 各组24周末IκB指标的表达 (免疫组化染色×200)
表2 各组大鼠不同时期IκB在肾组织中的表达(,n=5)
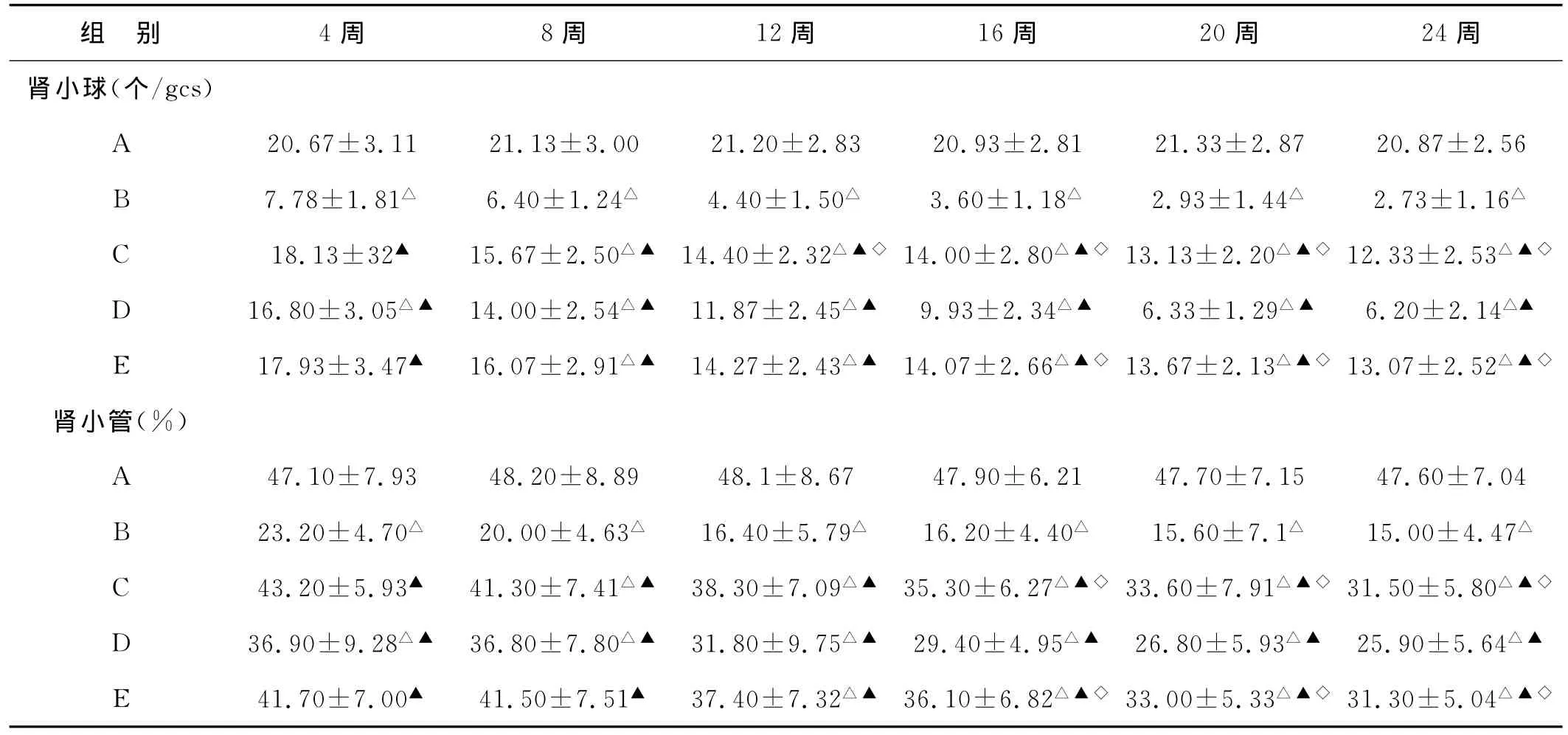
表2 各组大鼠不同时期IκB在肾组织中的表达(,n=5)
注:△与A组相比,P<0.01;▲与B组相比,P<0.01,◇与D组相比,P<0.05
组 别 4周 8周 12周 16周 20周 24周肾小球(个/gcs)A 20.67±3.11 21.13±3.00 21.20±2.83 20.93±2.81 21.33±2.87 20.87±2.56 B 7.78±1.81△ 6.40±1.24△ 4.40±1.50△ 3.60±1.18△ 2.93±1.44△ 2.73±1.16△C 18.13±32▲ 15.67±2.50△▲ 14.40±2.32△▲◇14.00±2.80△▲◇13.13±2.20△▲◇12.33±2.53△▲◇D 16.80±3.05△▲ 14.00±2.54△▲ 11.87±2.45△▲ 9.93±2.34△▲ 6.33±1.29△▲ 6.20±2.14△▲E 17.93±3.47▲ 16.07±2.91△▲ 14.27±2.43△▲ 14.07±2.66△▲◇13.67±2.13△▲◇13.07±2.52△▲◇肾小管(%)A 47.10±7.93 48.20±8.89 48.1±8.67 47.90±6.21 47.70±7.15 47.60±7.04 B 23.20±4.70△ 20.00±4.63△ 16.40±5.79△ 16.20±4.40△ 15.60±7.1△ 15.00±4.47△C 43.20±5.93▲ 41.30±7.41△▲ 38.30±7.09△▲ 35.30±6.27△▲◇33.60±7.91△▲◇31.50±5.80△▲◇D 36.90±9.28△▲ 36.80±7.80△▲ 31.80±9.75△▲ 29.40±4.95△▲ 26.80±5.93△▲ 25.90±5.64△▲E 41.70±7.00▲ 41.50±7.51▲ 37.40±7.32△▲ 36.10±6.82△▲◇33.00±5.33△▲◇31.30±5.04△▲◇
3 讨 论 目前临床上尚无明确有效的抗肾纤维化药物,作为适合中国国情的中医中药,对其治疗可能更有临床应用潜力。苦参系药用豆科槐属植物苦参(Sophora flavescens Ait)的干燥根,性寒味苦,始载于我国最早的药学文献《神农本草经》。随着分离提取技术的进步,发现在苦参、苦豆子、广豆根中存在同一类以苦参碱(matrine,Ma)及氧化苦参碱(oxymatrine,OM)为代表的生物碱。近年来发现OM具有抗器官纤维化的作用,目前临床已应用于病毒性肝炎、变态反应性疾病、细菌感染等。因此我们决定研究OM对大鼠慢性肾纤维化的防治作用。NF-κB主要由P50和P65两个亚基组成,在细胞静息状态下,NF-κB与其抑制因子IκB结合,形成 NF-κB/IκB复合体,使NF-κB以无活性的形式存在于细胞质中,当细胞受到刺激后,IκB发生快速泛蛋白化及蛋白酶解,NF-κB被活化,异位到核,并与靶基因启动子区域κB基序结合,启动基因的转录和蛋白合成[9]。许多免疫相关因子都含有NF-κB的结合序列位点,使NF-κB通过调节一系列重要的免疫因子的表达而参与对肾的损害过程。近年来还发现部分药物通过作用于IκB而发挥药效,如糖皮质激素可诱导IκBα的转录活性;免疫抑制剂可抑制IκB的降解,从而使IκB表达增多以降低NF-κB的表达[10]。本实验研究的结果证实:OM除了能抑制阿霉素大鼠肾脏纤维化组织中NF-κB蛋白的表达外,也能增强肾脏纤维化组织中IκB蛋白的表达。
众所周知,AngⅡ作为一个生长调节因子,能促进多种细胞生成因子的释放,如NF-κB。已有研究证实AngⅡ能增强肾小球系膜中NF-κB的结合活性[11]。因此AngⅡ可能通过增强NF-κB的活性而发挥致纤维化作用。从本实验可得出作为对肾脏纤维化有肯定疗效的血管紧张素转化酶抑制剂(ACEI)苯钠普利,除了可以减缓肾脏纤维化的进展外,还可下调NF-κB的表达和上调IκBα的表达,其中机理有待于进一步研究。在本实验研究中还发现OM100mg/kg·d对阿霉素大鼠肾纤维化的抑制作用强于 OM50mg/kg·d,并呈剂量依赖性,OM100mg/kg·d抑制肾纤维化的作用与苯钠普利相比差异无显著性,证明OM在抑制肾纤维化上可达到与ACEI同样的效果。之后还有待于增加更多OM浓度组进一步研究,为OM早日在临床应用提供理论依据。
综上所述,NF-κB的激活可能是肾脏纤维化发生发展的一个中心环节。并且其活性可被药物控制。由此推论氧化苦参碱防治慢性肾纤维化机理为:通过对NF-κB/IκB信号传导通路中,NF-κB的抑制作用及上调IκBα的表达和抑制其降解的作用,从而减少炎症性细胞因子、趋化因子和促纤维化因子的产生,减少ECM的合成及沉积,最终起到有效地抗肾纤维化的目的。
[1]E Isharkawy AM,Mann DA.Nuclear Factor-Kappa B and the hepatic in flammation-fibrosis-cancer axis[J].Hepatology,2007,46(2):590-597.
[2]柴宁莉,徐世平,石 卉,等.氧化苦参碱减轻大鼠肝纤维化的机制研究 [J].中国医学学报,2012,9(30):16-18.
[3]边 曦,吴江群,聂兴举,等.氧化苦参碱对人瘢痕成纤维细胞前胶原及纤维粘连蛋白表达的影响[J].中国中西医结合杂志,2012,32(10):1390-1393.
[4]孔秀岩,金 玉,李津玉.苦参素防治阿霉素肾病鼠肾小球硬化的实验研究[J].第四军医大学学报,2006,27(23):2150-2153.
[5]陈 晨,金 玉.氧化苦参碱对阿霉素大鼠慢性肾纤维化组织中核因子-κB表达的影响[J].南方医科大学学报,2007,27(3):345-348.
[6]Okuda S,Oh Y,Tsuruda H ,et al.Adriamycin-induced nephropathy as a model of chronic progressive glomerular disease[J].Kidney Int,1986,29:502-10.
[7]Raij L,Azar S,Keane W.Mesangial immune injure,hypertension and progressive glomerular damage in Dahl rats[J].Kidney Int,1984,26:137-143.
[8]张爱华,黄松明,丁桂霞,等.核因子-κB/IκB信号通路介导实验性肾炎肾组织中单核细胞趋化蛋白-1表达[J].中华病理学杂志,2003,32(6):548-552.
[9]罗正茂,何 风,王 寅,等.尿激酶联合黄芪对环孢素A大鼠慢性纤维化组织中核因子-κB表达的影响及意义[J].中医药研究,2010,13(1):324-327.
[10]刘明媛.NF-κB在肾脏疾病中的研究进展[J].国外医学泌尿系统分册,2002,22(6):399-403.
[11]吴秋菊,郭 颖,曾 华,等.NF-κB介导大鼠肾小球系膜细胞Visfatin对肾素血管紧张素系统mRNA表达的影响[J].热带医学杂志,2012,12(5):553-557.

