重组chemerin蛋白对3T3-L1脂肪细胞visfatin、MCP-1基因表达的影响
焦 谊 常 曦 王丽凤 李俊红 关亚群
(新疆医科大学基础医学院生物化学与分子生物学教研室,新疆 乌鲁木齐 830011)
近几年的研究表明,脂肪源性细胞因子参与肥胖相关的胰岛素抵抗(IR)、2 型糖尿病(T2DM)等病理生理过程。脂肪细胞分泌的多种细胞因子如chemerin、内脂素(visfatin)及单核细胞趋化蛋白-1(MCP-1)等均参与机体一些重要机能的调节〔1~3〕。脂肪细胞不仅参与能量代谢,还参与了炎症反应,MCP-1 是单核细胞和T淋巴细胞的主要趋化因子。有研究显示MCP-1 与各种肥胖相关性疾病存在明显相关,因此,MCP-1 可能成为肥胖相关性疾病十分有用的治疗靶点〔4,5〕。笔者在前期研究中发现,chemerin表达水平随着脂肪细胞分化成熟而显著上调〔6〕,但其如何影响糖、脂代谢以及参与肥胖诱导的IR的确切机制目前尚不清楚。因此,本研究采用不同时间、剂量的chemerin蛋白干预成熟的3T3-L1脂肪细胞,观察该蛋白对MCP-1、visfatin基因表达的影响,为深入研究chemerin蛋白在肥胖、糖尿病等疾病发病中的作用提供参考资料。
1 材料与方法
1.1材料与试剂 3T3-L1前脂肪细胞株购自中国科学院上海细胞库,DMEM培养基、胎牛血清、胰蛋白酶、青霉素/链霉素购自Gibico公司,胰岛素、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine IBMX)、地塞米松购自Sigma公司,重组小鼠chemerin蛋白购自R&D公司,逆转录试剂盒购自Promega公司, PCR扩增试剂盒等购自上海生工生物有限公司。
1.2方法
1.2.1脂肪细胞的培养及诱导分化 将3T3-L1前脂肪细胞接种于6孔培养板中,用含有10%胎牛血清、1%双抗的DMEM高糖培养液,在37℃ 5% CO2的培养箱中培养,每2 d换液1次,待细胞接触抑制2 d后开始诱导分化(第0天),加入含有0.5 mmol/L IBMX、2.5 μmol/L地塞米松、5 μg/ml胰岛素、10%胎牛血清的DMEM高糖培养液诱导48 h后;换用含5 μg/ml胰岛素、10%胎牛血清的DMEM培养液诱导48 h,随后用含10%胎牛血清的DMEM高糖培养液继续培养,诱导分化至第10天;90%以上的3T3-L1前脂肪细胞分化为成熟的脂肪细胞,油红O染色鉴定后既可用于后续试验。
1.2.2chemerin蛋白干预分化成熟的3T3-L1脂肪细胞 将诱导分化成熟后的3T3-L1脂肪细胞,采用随机数字表法将细胞分为 15组,予以含0.2% BSA的DMEM培养液饥饿过夜后,分别以不同浓度梯度(0、25、50、100、200 ng/ml)的chemerin蛋白作用12、24、48 h,每个浓度做3个复孔,分别收集不同浓度chemerin干预后的脂肪细胞,置-70℃冰箱冻存备用。
1.2.33T3-L1脂肪细胞总RNA提取及RT-PCR检测visfatin、MCP-1基因mRNA的表达 按照Invitrogen公司Trizol试剂说明书提取细胞总RNA,用Gene Quant Pro紫外分光光度计测定RNA的浓度和纯度,确保A260/A280>1.8,1%琼脂糖凝胶鉴定RNA的完整性。逆转录方法参照Promega试剂盒说明书进行操作,取总RNA 1 μg,经逆转录合成单链cDNA。根据Genebank中小鼠β-actin、visfatin和chemerin cDNA序列,应用Primer 5.0设计引物,引物序列及扩增退火温度及扩增片段长度见表1。

表1 小鼠β-actin、visfatin、MCP-1引物信息
以6 μl逆转录产物cDNA为模板,进行visfatin、MCP-1及β-actin基因的PCR扩增,反应体系20 μl。MCP1与β-actin的扩增条件:94℃预变性5 min,94℃变性30 s,60℃退火30 s,72℃延伸40 s,共35个循环,总延伸72℃ 7 min。visfatin的扩增条件:94℃预变性5 min,94℃变性30 s,58℃退火30 s,72℃延伸40 s,共35个循环,总延伸72℃ 7 min。目的基因表达量的检测:取扩增产物5 μl置于含溴化乙锭的2.0%琼脂糖凝胶中电泳;利用Bio-Rad凝胶成像仪成像,用β-actin的吸光度值作为内参照,计算visfatin、MCP-1基因mRNA的相对表达量而进行半定量分析。
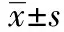
2 结 果
2.13T3-L1脂肪细胞的培养与鉴定 诱导分化前,3T3-L1前体脂肪细胞呈梭形,细胞质中不含脂滴。诱导后第2~4天细胞形态发生明显变化,细胞体积增大,逐渐由梭形变为圆形,可见少数细胞的胞浆内开始出现亮红的小脂滴。诱导第8~10天的细胞约90%多呈脂肪细胞表型,表现为细胞质中含多个脂滴。见图1。

图1 3T3-L1前脂肪细胞在诱导分化的不同时段油红O染色结果(×200)
2.2chemerin蛋白对诱导分化成熟的3T3-L1脂肪细胞visfatin基因表达的影响 使用不同剂量的chemerin蛋白作用于分化成熟后3T3-L1脂肪细胞,结果显示:作用24 h后,100 ng/ml的 chemerin蛋白干预组与未干预组比较,visfatin的表达差异有统计学意义;作用48 h后;50、100、200 ng/ml的chemerin蛋白干预的细胞与未干预组比较,visfatin的表达升高(P<0.05),且表达量随着chemerin浓度的增加而增加,各组间比较差异有统计学意义(P<0.05)。见表2、图2。

表2 不同剂量chemerin蛋白干预不同时间对visfatinmRNA表达的影响

1~5泳道:chemerin200、100、50、25、0 ng/ml;M:DNA Marker
图2chemerin蛋白干预48hvisfatin电泳图
2.3chemerin蛋白对诱导分化成熟的3T3-Ll脂肪细胞MCP-1基因表达的影响 使用不同剂量的chemerin蛋白作用于分化成熟后3T3-Ll脂肪细胞,结果显示: 25、100、200 ng/ml的chemerin蛋白干预12 h后,MCP-1的表达chemerin干预组与未干预组比较差异均有统计学意义(P<0.05);作用24和48 h后,50、100、200 ng/ml的chemerin蛋白对细胞内MCP-1的表达与未干预组比较差异均有统计学意义(P<0.05)。见表3、 图3。

1~5泳道分别表示chemerin干预剂量为200、100、50、25、0 ng/ml时,24 h后MCP-1和β-actin的扩增产物电泳图;6~10泳道分别表示chemerin干预剂量为200、100、50、25、0 ng/ml时,48 h后MCP-1和β-actin的扩增产物电泳图;M:DNA Marker
图3chemerin蛋白干预24和48h后MCP-1电泳图

表3 不同剂量chemerin蛋白对干预不同时间MCP-1基因mRNA表达的影响
3 讨 论
Chemerin是Bozaoglu等〔7〕采用新的信号序列捕获技术确定的、主要表达于成熟的脂肪细胞、并由脂肪细胞分泌的细胞因子。chemerin作为抗原呈递细胞特异性亚群的趋化因子,在炎症或组织损伤部位具有潜在的控制免疫应答的作用,然而其在代谢调节中的作用并不清楚。本课题组前期研究结果显示,chemerin和visfatin表达趋势与脂质积聚过程呈现较好的一致性,提示两者与脂肪细胞成熟及脂质积聚有关,但是具体的作用机制目前还不清楚。
本研究表明chemerin的干预促进了visfatin的表达,并且具有明显的时间与剂量依赖性。有研究显示在脂肪细胞成熟阶段沉默chemerin基因,将使涉及葡萄糖代谢和脂质稳态的基因表达降低;外源性给予浓度为100 ng/ml的重组人chemerin可以促进3T3-Ll前脂肪细胞在胰岛素干预下的葡萄糖转运蛋白活性增加41%。若用重组的鼠chemerin也可以得到类似的结果〔8〕。由于visfatin具有模拟胰岛素的作用,因此chernerin也可能通过促进visfatin的表达来增加胰岛素的敏感性。
chemerin刺激了树突状细胞和巨噬细胞的趋化性〔9〕,由于这些细胞表达chemerin受体,因此chemerin有可能在这些细胞向炎症部位的募集中起作用。脂肪因子(如瘦素、TNF-α)释放的增加以及来自脂肪细胞游离脂肪酸的增多刺激了巨噬细胞浸润和局部炎症应答,激活的巨噬细胞释放附加的前炎症分子,这些分子使炎症应答持续发生并损伤了脂肪细胞对胰岛素的敏感性〔10〕。因此,进一步研究chemerin对于炎症反应和代谢功能的系统行为将很有意义。
MCP-1是趋化因子CC亚家族的一员,在体内由脂肪细胞、内皮细胞、单核细胞、巨噬细胞等多种细胞产生,是一种单核细胞趋化和激活因子,主要趋化单核细胞和T淋巴细胞,使各种炎性细胞尤其是单核细胞向病变部位聚集。作为一种炎症趋化因子,MCP-1可能参与肥胖的发生和发展〔11~13〕,而肥胖引起胰岛素抵抗主要与脂肪组织炎性因子和炎症信号传导通路的激活有关。一方面,脂肪细胞数目增多和体积增大,可刺激脂肪组织分泌CRP、TNF-α和IL-6等炎性因子;另一方面脂肪组织中浸润的巨噬细胞作为炎性细胞也分泌大量的炎性因子,抑制脂肪细胞的胰岛素信号转导,最终引起脂肪细胞广泛溶解,释放大量游离脂肪酸,导致胰岛素抵抗。MCP-1是诱导巨噬细胞由外周血循环进入脂肪组织并使其激活的关键介质,同时也是一种胰岛素反应因子。因此,进一步分泌的胰岛素又能促进脂肪细胞等表达和分泌MCP-1,加重胰岛素抵抗的进展〔14〕。chemerin蛋白可能刺激了树突细胞和巨噬细胞的趋化性和MCP-1作为一种炎症趋化因子在肥胖发生和发展中所起的作用,本研究表明脂肪细胞中chemerin水平的升高可能作用于MCP-1,而后者诱导巨噬细胞由外周血循环进入脂肪组织并使其激活,这可能是肥胖和胰岛素抵抗等疾病发展的重要环节之一。
综上所述,重组chemerin蛋白干预成熟的3T3-L1脂肪细胞后,使visfatin和MCP-1基因表达量上调。而在这个过程中visfatin和MCP-1基因的表达是如何被调控的,两个基因又是如何调控脂肪细胞分化成熟的,在肥胖相关的代谢综合征发生发展过程中是如何起作用的还均有待于进一步研究。
4 参考文献
1Goralski KB,Mc Carthy TC,Hanniman EA,etal.Chemerin,a novel adipokine that regulates adipogenesis and adipocyte metabolism〔J〕.J Biol Chem,2007;282(38):28175-88.
2Chri Stiansen T,Richelsen B,Bruun JM,etal.Monocyte chemoattractant protein-1 is produced in isolated adipocytes,associated with adiposity and reduced after weight loss in morbid obese subjects〔J〕.Int J Obes (lond),2005;29(1):146-50.
3Varma V,Yao-Borengasser A,Rasouli N,etal.Human visfatin expression:relationship to insulin sensitivity,intramyocellular lipids,and inflammation〔J〕.Clin Endocrinol Metab,2007;92(2):666-72.
4Yu R,Kim CS,Kwon BS,etal.Mesenteric adipose tissue-derived monocyte chemoattractant protein-1 plays a crucial role in adipose tissue macrophage migration and activation in obese mice〔J〕.Obesity (Silver Spring),2006;14(8):1353-62.
5Zhang H,Cui J,Zhang C. Emerging role of adipokines as mediators in atherosclerosis〔J〕.World J Cardiol,2010;2(11):370-6.
6焦 谊,王延蛟,关亚群,等.3T3-L1前脂肪细胞分化过程中chemerin基因表达水平的变化〔J〕.中国老年学杂志,2011;31(11):4150-52.
7Bozaoglu,K,Bolton,K,McMillan J,etal.Chemerin is a novel adipokine associated with obesity and metabolic syndrome〔J〕.Endocrinology,2007;148(10):4687-94.
8Takahashi M,Takahashi Y,Takahashi K,etal.Chemerin enhances insulin signal- ing and potentiates insulin-stimulated glucose up take in 3T3-L1 adipocytes〔J〕.FEBS Lett,2008;582(5):573-8.
9Parlee SD,Ernst MC,Muruganandan S,etal.Serum chemerin levels vary with time of day and are modified by obesity and tumor necrosis factor-{alpha}〔J〕.Endocrinology,2010;151(6):2590-602.
10Weisberg SP,McCann D,Desai M,etal.Obesity is associated with macrophage accumulation in adipose tissue〔J〕.J Clin Investig,2003;112(12)1785-88.
11Chri ST,Richelsen IB,Bruun JM,etal.Monocyte chemoattractant protein-1 is produced in isolated adipocytes,associated with adiposity and reduced after weight loss in morbid obese subjects〔J〕.Int J Obes(lond),2005;29(1):146-50.
12Wadad T,Furcichi K,Sakai N,etal.Up-regulation of monocyte chemo attractant protein-l in tubulointerstitial lesions of human diabetic nephro- pathy〔J〕.Kidney Int,2000;58(4):1492-9.
13Takahashi K,Mizuarai S,Araki H,etal.Adiposity elevates plasma MCP-1 levels leading to the increased CD11b-positive monocytes in mice〔J〕.J Biol Chem,2003;278(47):46654-60.
14Sartip YP,Loskutoff DJ.Monocyte chemoattractant protein-1 in obesity and insulin resistance〔J〕.Proc Natl Acad Sci USA,2003;100(12):7265-70.

