慢性牙周炎患者龈下菌斑和动脉粥样硬化斑块中福赛坦氏菌的检测及同源性分析
陈 凌, 吴 贇, 汪义永, 魏 斌
近年来多项研究表明,感染因素在动脉粥样硬化及其并发症的发生和发展中起着重要作用[1-2]。牙周炎是发生在牙齿周围组织的感染性疾病,是多种全身性疾病如冠心病、糖尿病、低体质量早产儿等的危险因素[3]。福赛坦氏菌(Tannerellaforsythensis,Tf)与牙周炎发生发展关系密切。研究显示,Tf既可定植于牙周炎病变部位,也可在牙周健康部位检出,在牙周炎患者或牙周炎症部位检出率较高[4]。
本研究采用PCR扩增细菌DNA片段的方法检测慢性牙周炎患者的龈下菌斑、动脉粥样硬化斑块中Tf,通过比对2个样本中Tf的同源性,研究Tf和动脉粥样硬化的相关性。
1 对象与方法
1.1对象 2010年11月-2011年12月,在住院患者中选择伴有慢性牙周炎并且需要行动脉外科手术病例21例,其中男性13例,女性8例,年龄中位数74.5岁(62~93岁);其中牙周病轻度3例,中度8例,重度10例。慢性牙周炎纳入标准:(1)成年人,男女不限,年龄不限;(2)有明显的菌斑、牙石及局部刺激因素,且与牙周组织的炎症和破坏程度比较一致;(3)病情进展缓慢,也可间有快速进展的活动期;(4)全身一般健康,也可有某些危险因素,如吸烟、精神压力、骨质疏松等;(5)已排除侵袭性牙周炎;(6)根据累及的牙位数,可进一步分为局限型(<30%位点)和广泛型(>30%);(7)根据牙周附着丧失(AL)的程度,可分为:轻度(AL 1~2 mm)、中度(AL 3~4 mm)和重度(AL≥5 mm)。排除标准:剔除患有其他全身系统性疾病、药物过敏史、3月内有抗生素、肾上腺皮质激素、非甾体类抗炎药、性激素及避孕药等应用史者,心梗发生以及牙周治疗均须间隔6月以上。本研究通过福建医科大学生物研究伦理审查委员会审查,所有研究对象均知情同意并签字。
1.2方法
1.2.1主要试剂和设备 PCR反应体系、细菌基因组DNA提取试剂盒、溶菌酶(北京天根生化科技有限公司),基因组DNA纯化试剂盒(Promega公司),蛋白酶K(美国Sigma公司),Tf国际参考标准菌株(四川大学华西口腔医学院卫生部重点实验室提供)。Tf引物[5](上海生工生物工程有限公司合成)预期扩增片段长度为222 bp,退火57 ℃、30 s。ABI 9700 PCR扩增仪(美国ABI公司),微量核酸-蛋白定量仪(德国Eppendorf公司)。
Tf引物:
上游:GTCGGACTAATACCTCATAAAACA
下游:TCGCCCATTGACCAATATT
1.2.2标本的收集和处理 手术前一天所有患者进行全口天然牙的牙周袋探诊深度(PD)、附着丧失(AL)、菌斑指数(PLI)、出血指数(SBI)、牙石指数(CI)检查,由同一名医生完成。龈下菌斑样本的收集:选取患者口内PD≥4 mm的4个不同位点的患牙,患牙牙周袋最深的部位作为采样的位点,无菌龈上刮治器去除取样牙的龈上菌斑,棉卷隔湿干燥,用另一无菌龈下刮治器刮取龈下菌斑,放入同一盛有生理盐水的无菌Ep管中,-80 ℃保存。动脉粥样硬化斑块样本的收集:由外科医生在手术中收集,并立刻置于盛有生理盐水的无菌Ep管中,-80 ℃保存。
1.2.3细菌DNA的提取 按细菌基因组DNA提取试剂盒说明操作提取标准菌株、龈下菌斑及动脉粥样硬化斑块标本中的DNA序列。
1.2.4PCR反应体系及条件 PCR反应体系:DNA模板3 μL,2×Hot Start Taq PCR Master Mix 12.5 μL,上游引物(25 μmol/L)0.3 μL,下游引物(25 μmol/L)0.3 μL,H2O 8.9 μL,总体积25 μL。PCR反应条件参照文献[5]。
1.2.5PCR反应产物电泳、测序 取PCR扩增产物8 μL,2%琼脂糖凝胶电泳,用紫外线检测仪观察扩增条带,动脉粥样硬化斑块中检测到的牙周致病菌送往英杰生命技术公司检测。
2 结 果
2.1牙周临床指标检测结果 PD(5.62±0.63)mm(3.84~6.47 mm),AL(4.26±2.21)mm(1.46~6.72 mm),SBI(2.84±0.67)(1.94~3.72),PLI(2.24±0.37)(1.57~2.86),CI(2.04±0.73)(1.25~2.83)。
2.2Tf的PCR扩增产物电泳Tf特异引物扩增后出现目的条带,分子量大小与参考菌株基本相同,片段大小为200~300 bp,与预期的222 bp相符(图1)。
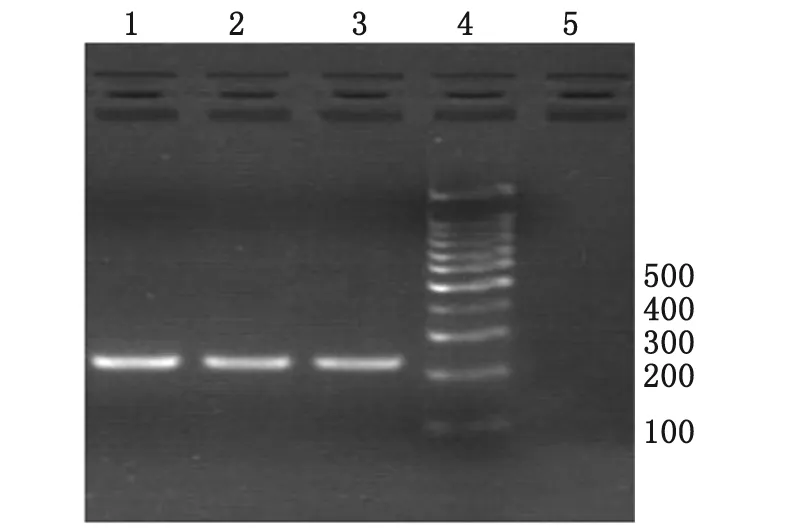
1:Tf标准菌株;2:龈下菌斑Tf阳性样本;3:动脉粥样硬化斑块Tf阳性样本;4:Takara 100 bp DNA markers(dye plus);5:空白对照组.
2.3Tf检出率 21例中,动脉粥样硬化斑块中Tf阳性6例,检出率29%;龈下菌斑中Tf阳性15例,检出率71%;在同一患者龈下菌斑及动脉粥样硬化斑块中Tf检测均阳性5例,检出率24%。
2.4测序 将动脉粥样硬化斑块中检测到的TfPCR产物测序,并将基因序列与GenBank中标准序列进行比对,表明是Tf(图2,3)。
2.5同源性检测 将同一患者2个样本Tf均为阳性的的标本PCR产物测序结果通过blast比对,发现其符合Genbank中的标准序列,这两种不同来源的Tf间具有高度的同源性,基因序列相似度99%(图4)。
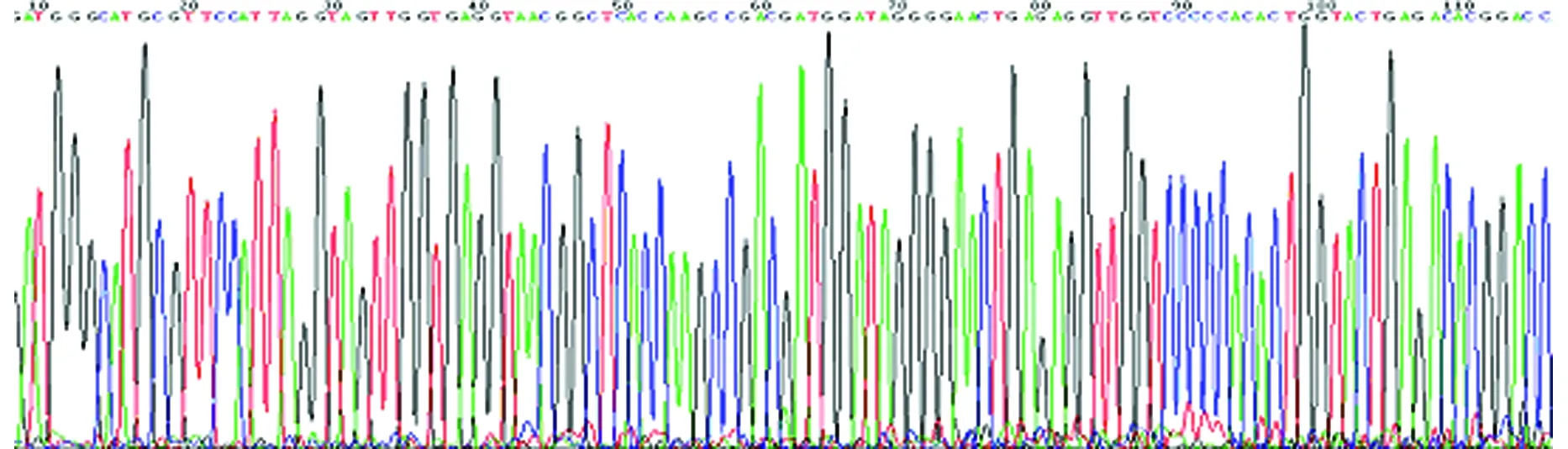
图2 动脉粥样硬化斑块中Tf PCR产物的部分基因测序结果
3 讨 论
牙周炎症感染的情况下,牙周支持组织受到不同程度的破坏,牙周袋内的上皮组织可产生溃疡,使牙周袋内的病原菌可能进入血液,导致短暂、低水平的菌血症发生。Tf与牙周炎发生发展关系密切,重度牙周病患者的龈下菌斑中经常可检出Tf。Tf为革兰阴性厌氧菌,其细胞壁中的脂多糖可引发宿主免疫反应,诱导白细胞介素-1、6、8及肿瘤坏死因子-α等多种细胞因子产生,诱导细胞凋亡[6]。研究发现,牙周炎患者检出Tf比率为56.5%,与牙周健康人群对比显著增高;并且牙周破坏程度加剧,牙周袋内检测出Tf的比率也升高[7]。

图3 动脉粥样硬化斑块中检测到的Tf PCR测序结果与GenBank参考序列比对

图4 龈下菌斑及动脉粥样硬化斑块中Tf 同源性比对
在病损的血管和动脉粥样硬化斑块里均检测出口腔细菌感染物是支持慢性口腔感染与动脉粥样硬化相关联的有力证明。Chiu等收集了进行冠状动脉搭桥手术的患者,发现术中取得的粥样硬化斑块中存在2种牙周来源的致病菌(牙龈卟啉单胞菌和血链球菌)[8]。Jain等发现,发生牙周炎的兔动脉粥样硬化模型与无牙周炎模型相比,有更多类脂沉积于动脉壁,且随着牙周炎的加重类脂的沉积程度越严重[9]。Figuero等研究了70例外周动脉疾病或腹主动脉瘤患者,发现其血管及血液样本中常见牙周致病菌(伴放线聚集杆菌、牙龈卟啉单胞菌、直肠弯曲菌、Tf)检出率分别为7.1%和11.4%[10]。Mahendra等收集了51例接受冠状动脉搭桥的慢性牙周炎患者的冠状动脉粥样硬化斑块标本,结果表明伴放线聚集杆菌、Tf、牙龈卟啉单胞菌、牙龈卟啉单胞菌黏附因子菌毛蛋白A基因、齿垢密螺旋体检出率分别为0,31.4%,45.1%,39.2%和51%[11]。杨泓等检测动脉粥样硬化斑块中的3种牙周致病菌,发现重度牙周炎组Tf检出率(25%)比轻度牙周炎组(7.69%)明显增高[12]。安娜等研究发现,动脉粥样斑块样本中可检出3种可疑牙周致病菌,其中牙龈卟啉单胞菌阳性率为30%,Tf阳性率为10%[13]。由此可见,多数研究都从动脉粥样硬化斑块检测出牙周致病菌,从而确定牙周感染与动脉粥样硬化的相关性。但是要确定分别从动脉粥样硬化斑块与牙周组织来源的致病菌之间的相似度究竟如何,需要同时检测同一患者动脉粥样硬化斑块及龈下菌斑同种牙周致病菌并进行分析,比对两种来源致病菌的相关性,此类相关研究较少。本研究发现,Tf在动脉粥样硬化斑块、龈下菌斑中的检出率为29%和71%,检出Tf的DNA符合Genbank中的标准序列,在同一患者龈下菌斑及动脉粥样硬化斑块中检出率为24%,且2种不同来源的Tf间具有高度的同源性,其基因序列相似度为99%。本课题组前期已经在慢性牙周炎患者的动脉粥样硬化斑块中找到了2种牙周致病菌(伴放线聚集杆菌、牙龈卟啉单胞菌)DNA[14],与前期研究相比,Tf无论是在检出率还是核酸的相似程度方面都更高,因此推测牙周感染中存在的Tf可能对动脉粥样硬化发生发展起到更为重要的作用,但仍需要大样本的研究证实。
本研究结果提醒临床医生应重视牙周疾病与心血管病的关系,在进行牙周卫生指导时,提醒患者积极去除牙周组织可能存在的危险因素,降低动脉粥样硬化及其他血栓栓塞性疾病发生的危险。
参考文献:
[1] Leivadaros E, van der Velden U, Bizzarro S. A pilot study into measurements of markers of atherosclerosis in periodontitis[J].JPeriodontol, 2005,76(1):121-128.
[2] Gibson F C, Yumoto H, Takahashi Y,etal. Innate immune signaling and porphyromonas gingivalis-accelerated atherosclerosis[J].JDentRes, 2006,85(2):106-121.
[3] Manjunath B C, Praveen K,etal. Periodontal infections: a risk factor for various systemic diseases[J].NatlMedJIndia, 2011,24(4):214-219.
[4] Hajishengallis G, Martin M, Sojar H T,etal. Dependence of bacterial protein adhesion on toll-like receptors for proinflammatory cytokine induction[J].ClinDiagnLabImmunol, 2002,9(2):403-411.
[5] Ishihara K, Nabuchi A, Ito R,etal. Correlation between detection rates of periodontopathic bacterial DNA in caroid coronary stenotic artery plaque and in dental plaque samples[J].JClinMicrobiol, 2004,42(3):1313-1315.
[6] Hasebe A, Yoshimura A, Into T. Biological activities of bacteroides forsythus lipoproteins and their possible pathological roles in periodontal disease[J].InfectImmun, 2004,72(3):1318-1325.
[7] 杨 禾,吴亚菲. 福赛斯坦纳菌与牙周炎关系的研究进展[J]. 国际口腔医学杂志, 2007,34(3):177-180.
[8] Chiu B. Multiple infections in carotid atherosclerotic plaques[J].AmHeartJ, 1999,138:534-536.
[9] Jain A, Batista E L, Serhan C,etal. Role for periodontitis in the progression of lipid deposition in an animal model[J].InfectImmun, 2003,71(10):6012-6018.
[10] Mahendra J, Mahendra L, Felix J,etal. Prevelance of periodontopathoenic bacteria in subgingival biofilm and atherosclerotic plaques of patients undergoing coronary revascularization surgery[J].JIndianSocPeriodontol, 2013,17(6):719-724.
[11] Figuero E, Lindahl C. Quantification of periodontal pathogens in vascular, blood and subgingival samples from patients with peripheral arterial disease or abdominal aortic aneurysms[J].JPeriodontol, 2014,85(1):1-22.
[12] 杨 泓,李行懿,陈 娜,等.动脉粥样硬化斑块中牙周致病菌的检测[J]. 北京口腔医学,2011,19(3):131-134.
[13] 安 娜,欧阳翔英,韩 蔚.动脉粥样硬化斑块中牙周可疑致病微生物的检测[J].北京大学学报:医学版, 2010,42:33-36.
[14] 吴 贇,陈 凌,魏 斌,等.龈下及动脉粥样硬化斑块中牙周致病菌的同源性分析[J].口腔医学研究,2013,29(6):543-546.

