相平衡原理在化工分离提纯中的应用
张坤玲, 张 玮, 杨 永, 李瑞珍
(石家庄职业技术学院a.化学工程系;b.学生工作部,河北 石家庄 050081)
物理化学知识对基础化学实验有重要的理论指导意义.在化工生产、药物生产、冶金工业和其他生产过程中,往往要对混合物进行分离提纯,而相平衡理论是选择分离方法、设计分离装置以及实现最佳操作的理论基础.本文主要讨论相平衡原理在分离提纯中的应用.
1 单组分系统——超临界萃取
CO2的相图如图1所示.

图1 CO2的相图
图中OC线为液体CO2的蒸气压曲线,该线至C点为止,C点为CO2的临界点,临界温度tc为31.06℃,临界压强pc为7.39MPa.超过C 点之后,CO2的气、液界面消失,系统性质均一,处于此状态的CO2被称为超临界CO2流体.
超临界流体由于具有较高的体积质量,故有较好的溶解性能,以之作为萃取剂,萃取效率较高,且降压后,萃取剂气化,被溶解物质即被分离出来.
超临界CO2流体的体积质量几乎是最大的,压强增加,其体积质量增加很快,其对许多有机物的溶解能力很强,因而最适宜作为超临界萃取剂使用.
CO2临界温度低,可在接近室温下完成整个萃取分离工作,特别适用于热敏性和化学不稳定性强的天然产物的分离.CO2临界压强适中,易于实现工业化.与其他有机萃取剂相比,CO2既便宜,又容易制取,且无毒、惰性、易于分离,因而CO2在超临界萃取中应用十分普遍.
2 二组分液态完全互溶系统的气液平衡——蒸馏和精馏
二组分系统的气液平衡相图,对液态混合物的分离提纯如蒸馏、精馏、蒸汽蒸馏等有很重要的意义.科研和工业生产中的一些分离操作多是在固定压强下进行的,因此,讨论一定压强下的温度-组成相图更有实际意义.温度-组成相图亦称沸点-组成图,它表示当外压恒定时,二组分系统气液两相平衡组成与温度的关系.
2.1 蒸馏
蒸馏是将液态物质加热到沸腾,使之变为蒸气,又将蒸气冷凝为液体的过程.若将两种挥发性液体混合物进行蒸馏,在沸腾温度下,气相与液相达到平衡,蒸气中就含有较多易挥发物质的组分.若将此蒸气冷凝后收集起来,则馏出物中易挥发物质组分的含量高于原始液体混合物,而残留液中却含有较多的难挥发组分(高沸点组分),这就是一次简单的蒸馏.简单蒸馏方法只能粗略地将混合物相对分离,要想得到较纯的两种组分,则需要采用精馏的方法.
2.2 精馏
精馏是将液态混合物反复进行部分气化和部分冷凝,使混合物中的不同组分分离的单元操作.其原理是,利用液态混合物在气液平衡时,各组分的相对挥发能力的不同而将各组分分离开来.在化工生产中,常通过精馏操作分离和提纯液态混合物[1].
2.2.1 正常类型液态混合物的精馏
这类液态混合物包括理想液态混合物和具有较小正负偏差的液态混合物.其共同的特点是在全部组成范围内均有假定B为易挥发组分).
精馏过程的t-x图如图2所示.
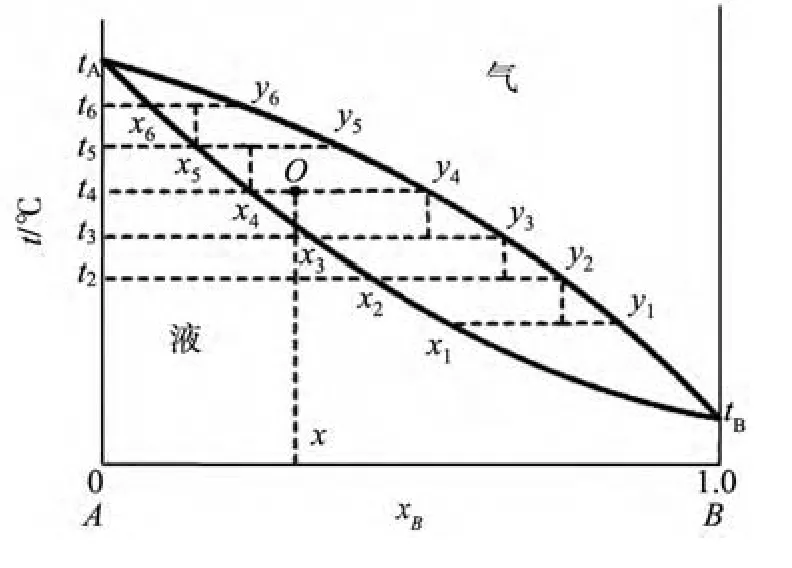
图2 精馏过程的t-x示意图
设原始溶液的组成为x,加热到t4时,体系点为O,此时气液两相的组成分别为y4和x4.如果把组成为y4的气相冷却到t3,则气相将有部分冷凝为液体,得到组成为x3的液相和组成为y3的气相.再将组成为y3的气相冷却到t2,就得到组成为x2的液相和组成为y2的气相,依此类推.由图2可知,y4<y3<y2<y1.如果继续下去,反复冷凝气相,最后得到的气相组成可接近纯B.将组成为x4的液相加热到t5,液相部分气化,此时,气相和液相的组成分别为y5和x5.把组成为x5的液相再部分气化,则得到组成为y6的气相和组成为x6的液相.显然x6<x5<x4<x3,即液相组成沿液相线上升,最后得到纯A.
在工业上,上述气相反复地部分冷凝和液相反复地部分气化的过程是在精馏塔中同时进行的.泡罩式精馏塔的示意图见图3.
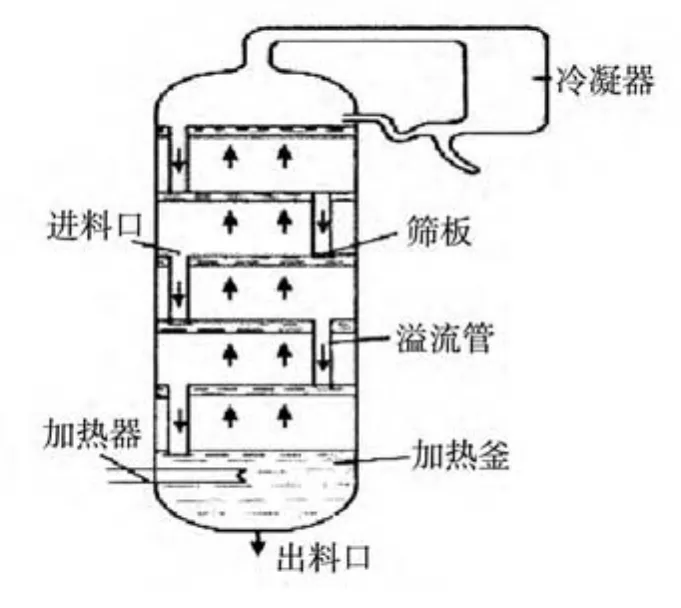
图3 泡罩式精馏塔示意图
物料在塔釜内加热后,蒸气通过塔板上的泡罩与塔板上的液体接触,蒸气中难挥发组分冷凝为液体并放出热量,使液相中易挥发组分气化并升入高一级塔板.上升的蒸气中含有较多的易挥发组分,而下降的液体中难挥发组分增加.每一层塔板就相当于一个简单的蒸馏器.最终在塔顶得到纯度较高的易挥发组分,经塔顶冷凝器变为液体放出;而在塔底得到纯度较高的难挥发组分.
正常类型的液态混合物可以通过精馏完全分离出纯组分.
2.2.2 具有最低恒沸点和最高恒沸点类型液态混合物的精馏
这两类液态混合物存在最低或最高恒沸点.在恒沸点,两种物质的相对挥发能力相同.因此,通过普通的精馏不能达到完全分离两种物质的目的,只能得到一种纯组分和恒沸混合物.
对具有最低恒沸点类型的液态混合物,如图4所示,若溶液的组成在恒沸组成C点的左侧,精馏结果为,在塔顶得到恒沸混合物,塔底得到纯组分A;若溶液的组成在恒沸组成C点的右侧,精馏结果为,在塔顶得到恒沸混合物,塔底得到纯组分B.

图4 P一定时最大正偏差t-x图
对具有最高恒沸点类型的液态混合物,如图5所示,若溶液的组成在恒沸组成C点的左侧,精馏结果为,在塔顶得到纯组分A,塔底得到恒沸混合物;若溶液的组成在恒沸组成C点的右侧,精馏结果为,在塔顶得到纯组分B,塔底得到恒沸混合物.
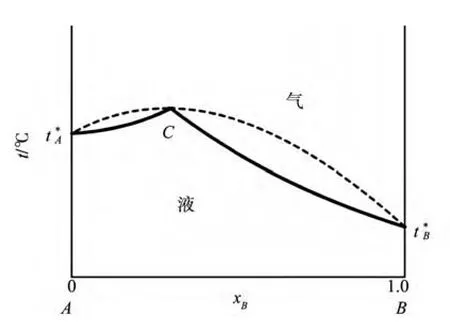
图5 P一定时最大负偏差t-x图
例如,乙醇-水溶液,因为乙醇与水形成了恒沸物,在常压下,共沸组成为4.4%的水和95.6%的乙醇,共沸点为78.15℃.即当乙醇-水溶液的浓度为95.6%时,溶液的气液相组成(平衡组成)相等.这就无法用普通精馏的方法将乙醇溶液再浓缩,即得不到纯度高于95.6%的乙醇.
若在两组分恒沸混合物中加入第三组分(称为挟带剂),该组分与原料液中的一个或两个组分形成新的恒沸混合物,从而使原恒沸混合物用普通精馏方法分离,这种精馏操作称为恒沸精馏.对于乙醇-水溶液系统,目前常采用在95.6% 的乙醇中加入适量苯的方法得到无水乙醇.因为加入适量苯后,形成了乙醇-水-苯三元系统,其三元恒沸点(64.45℃,组成:乙醇18.5%、水7.4%、苯74.1%)低于乙醇-水的恒沸点(78.15℃),故馏出所有的水,剩下的残留液为乙醇-苯的二元系统,具有最低恒沸点(67.65℃,苯67.6%).进一步分馏,则馏出恒沸混合物,剩下残留液即为纯乙醇.
3 二组分液态完全不互溶系统的气液平衡——水蒸气蒸馏
二组分液态完全不互溶系统的气-液平衡t-x图见图6.在二组分液态完全不互溶系统中,组分之间几乎互不影响,它们的蒸气压与其单独存在时一样,系统的总压等于两纯组分在该温度下单独存在时的蒸气压之和.所以,在一定温度下,二组分完全不互溶系统的蒸气压恒大于任一纯组分的蒸气压,而沸点则低于任一纯组分的沸点.例如,在101.325 kPa下水的沸点为100℃,氯苯的沸点为130℃,而水-氯苯系统的共沸点为91℃.
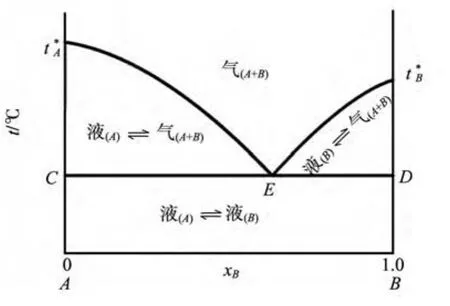
图6 P一定时液态完全不互溶气-液平衡t-x图
水蒸汽蒸馏就是利用液态完全不互溶系统的沸点低于任一组分的沸点这一特征,将与水不互溶的有机化合物和水共同蒸发,经冷凝后分为两层,除去水层后即得产品.在提纯某些热稳定性较差的有机化合物时,一般将待提纯有机化合物液体加热到接近100℃,然后使蒸汽以气泡的形式通过有机物液体,形成二组分完全不互溶系统,则有机物液体会向气泡内蒸发,而气体经冷凝后自然分成有机液体和水两个液层.这样既能达到提纯的目的,又可避免有机物受热分解[1].
4 二组分系统的液-固平衡——盐的分离和提纯
二组分水-盐系统的相图可用于盐的分离和提纯,指导人们找到盐类提纯与精制的最佳工艺条件和方法.
例如,利用相图可以确定 (NH4)2SO4的纯化条件.H2O-(NH4)2SO4系统的相图[1]见图7.

图7 H2O-(NH4)2SO4 系统的相图
分析相图可知,当溶液的组成落在ME线左边时,用单纯降温的方法最终只能得到的冰和固体(NH4)2SO4的混合物,不能分离出纯盐.要从80℃,20%的(NH4)2SO4溶液(图中物系点 H)中获得纯(NH4)2SO4晶体,应先将此溶液蒸发、浓缩,使物系点H 沿水平方向移至S点,此时溶液中(NH4)2SO4的含量接近50%,再冷却此溶液,到K点时溶液已饱和,若再降低温度,将析出(NH4)2SO4晶体.继续降温至R点(10℃),系统中的溶液和(NH4)2SO4晶体共存.此时,可将晶体与母液分开,并将母液重新加热到P点,再溶入粗(NH4)2SO4,适当补充水分,使物系点自P移到S,然后再过滤、降温、结晶、分离、加热、溶入粗盐.如此循环多次,即可达到粗盐提纯的目的.需要注意的是,温度不能降至-18.3℃(E点)水-盐共析点,否则,整个系统又成为三相共存状态,析不出纯盐.实际操作中,一般冷却至10℃~20℃ 为宜,此时既可保证(NH4)2SO4晶体的含量,又可达到节能的效果.
5 二组分固态完全互溶系统——区域熔炼法
区域熔炼法是一种利用杂质在液相和固相中溶解度的不同而制备高纯度金属的方法.金属放在水平的管式炉中,管外绕以可移动的加热环,例如可用高频加热环,随着熔化区向右端移动,杂质也向右移动.多次重复上述操作,在最左端即可得到极纯的金属.
二组分固态完全互溶系统的相图如图8所示.

图8 A-B固态完全互溶体系相图
组分A为待提纯的金属,组分B为杂质.若开始时物系点为a,升温至液相线上b点时,首先析出相点为c的固溶体,此固溶体中杂质B的含量比b点少.若再将固溶体c加热熔融且重新冷却至d点,又析出相点为e的固溶体,其杂质含量比c点少.如此重复,固态相点可不断往左上角的端点移动,从而达到提炼纯A的目的.
区域熔炼法可生产刚玉、白钨矿等宝石材料,常用于材料的物理提纯.
6 结束语
相平衡是热力学在化学领域的重要应用.研究系统的相平衡,对科研与生产具有重要意义.在教学过程中,将相平衡原理与化工分离提纯操作有机结合,相互渗透,对提高学生学习“物理化学”的兴趣、增强学习动力、提高实验操作技能等具有重要作用.
[1]张坤玲.物理化学 [M].大连:大连理工大学出版社,2013:115-124.

