食品乳状液稳定性检测方法研究进展
许朵霞,曹雁平,韩 富
(北京工商大学食品学院,北京工商大学食品添加剂与配料北京高校工程研究中心,北京工商大学北京市食品风味化学重点实验室,北京100048)
食品乳状液是在表面活性剂存在的条件下,一种液体以液滴的形式分散在另一与其互不相溶的液体中的液滴分散体系。乳状液在食品领域中广泛应用,如饮料、脂质替代品、蛋糕、冰激凌、巧克力等。食品乳状液在热力学上属于不稳定体系,在宏观上不稳定性现象有两种,一种是乳状液分散相颗粒的迁移(乳析和沉淀),另一种是分散相颗粒粒径大小变化(团聚和絮凝)。随着科学技术的不断发展,实验技术不断完善,越来越多的精密仪器可用于食品乳状液稳定性的检测,但至今对乳状液稳定性的检测仍没有普遍统一的方法。根据文献报道和研究实践,本文结合实例就常见的食品乳状液稳定性测定方法进行综述。
1 光学法
1.1 激光粒度仪法
激光粒度仪法是通过粒径分析仪,对体系中肉眼不能分辨的粒子粒径特性进行表征的一种方法。乳状液液滴粒度分布是乳状液的重要特性之一,粒度特征的参数主要包括粒径大小及分布。乳状液液滴大小及其分布对乳状液的稳定性有很大的影响,根据stockes规律,颗粒越细小,沉淀速度越慢,乳状液也就越稳定。液滴尺寸范围越窄越稳定,单分散比多分散的乳状液稳定[1]。
粒度特征既可以从微观上确定乳状液分散相的组成特点,又可以从宏观上描述食品乳状液絮凝和聚结等过程。同时,乳状液的其他性质,如黏度、粘弹性等,也与其粒径密切相关。乳状液液滴粒径分布测定可采用显微统计法、激光散射法和超声波法,其中应用最广泛的是激光散射法(如Mastersizer2000,Zetasizer Nano ZS90)。
粒径分布具有不同的表达方式,常见的有表面积加权平均值 D[3,2],体积加权平均值 D[4,3],其中D[4,3]对样品中大颗粒的存在敏感,D[3,2]对样品中小颗粒的存在敏感,D[4,3]对絮凝/聚结更敏感。因此,如果评价食品乳状液的团聚现象,主要考察 D[4,3]变化值[2]。可通过粒径大小的变化来分析乳状液的稳定性。
丰隽莉等以Tween 80为表面活性剂,正丁醇为助表面活性剂制备VE微乳液,通过考察贮藏1个月过程中的粒径变化,研究该微乳液的稳定性[3]。结果表明,在贮藏期内VE微乳液粒径变化不大,分布在10nm以下,该纳米级VE微乳液具有较好的稳定性。
1.2 Turbiscan法
Turbiscan是检测乳状液稳定性的一种新方法,仪器采用脉冲近红外光源(λ=880nm)自下而上扫描样品,两个同步光学探测器分别搜集透射光和背散射光。在一定时间内连续扫描样品,获得透射光与背散射光信号对样品高度的函数曲线图,即可反映出样品中颗粒运动趋势,进而预测出乳状液的稳定性。因此,Turbiscan可直观获得沉淀层、乳析层或澄清层随时间的变化关系曲线。
大多数乳状液属于浓缩体系,而且不透明,分析时需要对其进行稀释,而稀释会破坏絮凝等结构,这将严重降低了评价的准确性。Turbiscan法的特点是:无需对乳状液样品进行稀释,不接触样品直接进行扫描,分析乳状液的稳定性。样品的分析浓度最高可达95%,粒径大小范围50nm~1000μm。
通过Turbiscan图谱分析不同乳化剂制备乳状液的稳定性差异(图 1)[4]。
采用Turbiscan Lab Expert浓缩体系稳定性分析仪,对β-胡萝卜素纳米乳状液的稳定性进行分析。实验中,将装有20mL的β-胡萝卜素纳米乳状液的仪器专用测试瓶放入检测池中,每30min扫描一次,连续扫描4h。由于样品浊度高,透射光量小,实验选用背散射光值(Backscattering,BS)来分析乳状液的稳定性。在样品中部,BS值增大,表明乳状液中颗粒有团聚现象发生;而样品顶部BS值显著增大,则表明大量分散相颗粒上浮,表现为乳析。
由图1可知,以 TW、DML、OSS、WPI为乳化剂的四种乳状液样品的中部BS均有不同程度升高,表明乳状液粒径均有增大趋势。DML乳状液的BS值升高幅度最大,达到26%,表明该乳状液聚结明显,粒径不断增大,使得乳状液发生分层现象(样品顶部BS值显著增大)。WPI乳状液的BS值变化最小,表明该乳状液稳定性较好。因此,可采用Turbiscan仪来筛选最佳乳化剂。
1.3 Lumisizer法
目前,精密稳定性分析仪主要有两种,这两种仪器均为非结构破坏性量测。其中一种为法国FORMULACTION公司生产的全能稳定性分析仪Turbiscan,另一种为德国LUM公司生产的LUMI稳定性分析仪。
Lumisizer稳定性分析仪,通过加速分层和量化沉淀、悬浮的方法(STEP-Technology)快速测定乳状液的稳定性。仪器采用光学离心的分析方法,利用粒子迁移速率与光的穿透关系,记录下随时间改变的粒子行为。在时间和位置为参数,同步测量透射光强度。透射特征线的描绘过程反映分离过程的动力及稳定性。通过对现有的分析模式“透视度积分”(澄清的速度)和“相界面层跟踪”进行考察,判断乳状液的失稳过程。在离心的过程中,平行的近红外或蓝色光照射在样品试管上,通过记录样品不同位置的透射率分布的变化,确定乳状液粒子的迁移过程[5]。

图1 含有不同乳化剂的β-胡萝卜素纳米乳状液(10%,w/w)Turbiscan扫描图谱Fig.1 Turbiscan profiles of β-carotene nanoemulsions stabilized by four emulsifiers scanned every 30 minutes for 4 hours at 55℃,where Y axis represents delta backscattering intensity and X axis represents sample height.
应用Lumisizer考察大豆多糖稳定乳状液(10%MCT,0.15% β-胡萝卜素)的最佳浓度[6]。实验过程中,取乳状液约1.8mL,均匀注射至样品试管底部,温度设定为60℃,离心转数为4000r/min,每30s记录一次样品的透射率特征曲线,共255次。
图2表明,随着大豆多糖浓度的增加,乳状液的透光率变化程度逐渐减小。当大豆多糖浓度较低时,样品顶部的透光率明显变大,表明乳状液在离心过程中不稳定,出现比较显著的乳状液乳析现象,此时大豆多糖浓度不足以覆盖乳状液液滴表面。当大豆多糖浓度高于4wt%时,乳状液的透光率变化明显减小,乳状液能够保持较好的物理稳定性。

图2 不同大豆多糖浓度制备β-胡萝卜素乳状液的LUMiSizer分析图Fig.2 LUMiSizer analysis of β-carotene emulsions prepared by different soybean polysaccharide concentrations
1.4 透射光浊度法
透射光浊度法主要是利用光透过乳状液时,透光率变化确定乳状液内部颗粒大小的变化。该方法结合浊度与比色测定,具有和显微镜观察法同样的特点。最常见的测定乳状液稳定性的方法是:取一定量的乳状液加入带盖的贮藏瓶中,在37℃条件下贮存,不同贮藏时间取出样品,采用浊度仪测定透光率变化,分析样品的稳定性。
Klein等人利用浊度仪,研究阿拉伯胶与乳清分离蛋白对乳状液体系稳定性的影响。采用浊度法测定乳状液的稳定性,而后将该乳状液应用于饮料生产中[7]。
2 电荷分布法
乳状液的电荷分布通常用zeta-电位(zetapotential)表征。目前测定zeta-电位的方法主要有电泳法、电渗法、流动电位法及超声波法,其中以电泳法应用最广。最常用且操作便利的仪器是马尔文公司生产的Zetasizer Nano设备。Zetasizer仪基于动态光散射原理,带电颗粒在外加电场作用下发生定向移动,当光束照到颗粒上时,会引起光束频率或相位发生变化,且颗粒运动速度越快,光的频率和相位变化得也快。因此可以通过测量光的频率或相位变化来间接测出颗粒的电泳速度,从而求出zeta-电位[8]。
Zeta-电位不仅取决于液滴表面,也受分散相组成,如pH、介质离子强度的影响。Zeta-电位与体系稳定性之间的关系如表1所示。如果液滴有较大的负zeta-电位或正zeta-电位,它们将因为静电排斥作用而稳定分散。一般而言,zeta-电位越高,乳状液越稳定;∣zeta-电位∣≥30mV时,乳状液较稳定。但乳状液的稳定性不能完全靠zeta-电位值是否大于30mV来判断,因为乳状液的稳定性不仅取决于静电排斥作用力,还取决于界面膜厚及空间位阻作用[9]。

表1 Zeta-电位大小与乳状液稳定性之间的关系Table 1 The relationship between zeta-potential and emulsion stability
利用zeta-电位分布变化,考察壳聚糖分子对大豆多糖制备的β-胡萝卜素双层乳状液的吸附作用,获得壳聚糖稳定该乳状液的最佳添加量(图3)[6]。研究发现:在未添加壳聚糖时,大豆多糖稳定的β-胡萝卜素乳状液的zeta-电位约为-34mV,随着壳聚糖浓度的增加,zeta-电位由负变正,当壳聚糖浓度为2wt%时,乳状液电位为+58mV。通过zeta-电位分析表明,带正电荷的壳聚糖分子能够吸附到带负电荷的液滴表面,乳状液的稳定性得到提高。
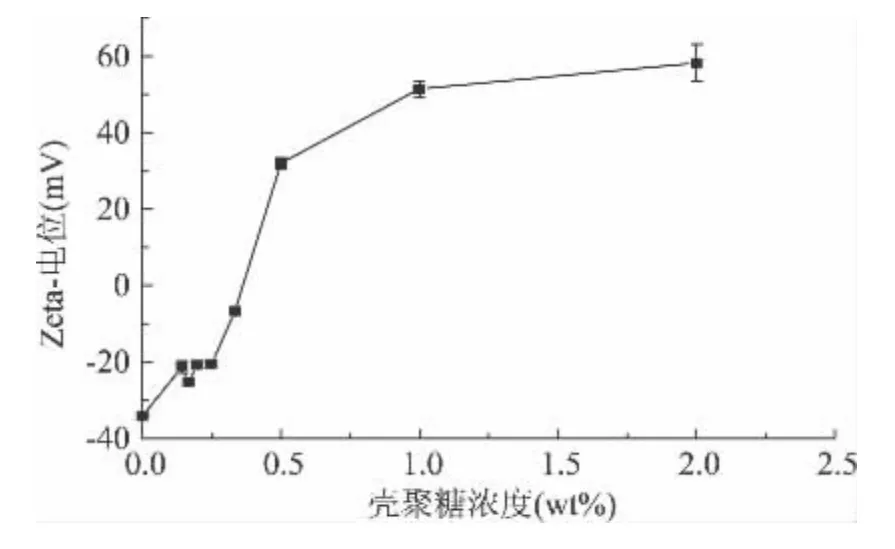
图3 壳聚糖浓度对β-胡萝卜素双层乳状液电位的影响Fig.3 Dependence of electrical charge(ζ-potential)on the chitosan concentration for SSPS stabilized β-carotene emulsions
3 流变法
乳状液的稳定性与流变特性取决于乳状液液滴间的相互作用,这种相互作用与油水界面结构与组成相关。在食品乳状液体系中,界面吸附层相对较复杂。其中,最宏观特征为乳状液的流变学特性。食品乳状液流体包括牛顿流体(如牛奶)和非牛顿流体(如蛋黄酱)两种类型。
乳状液遵守stockes沉淀作用规律,粘度高可减少乳状液分离的趋势。在乳状液中添加增稠剂以增加粘度,常用低分子增调剂如甘油、山梨醇等,高分子增调剂如阿拉伯胶、海藻胶等[10-11],可提高乳状液的稳定性。
添加不同浓度的阿拉伯胶至1%乳清蛋白制备的10%正己烷乳状液中,考察不同阿拉伯胶浓度对乳状液在不同剪切速率下黏度的影响。结合乳状液的稳定性分析,得到阿拉伯胶的最佳添加浓度。结果表明,随着阿拉伯胶浓度的增加,乳状液的黏度增大,乳状液流体特性符合power方程,表现为假塑性流体,n值由0.4(未添加阿拉伯胶的乳状液)增加为0.55(添加15%阿拉伯胶的乳状液)。因此,随着阿拉伯胶含量的增加,乳状液的流变学特性接近牛顿流体,稳定性得到提高[12]。
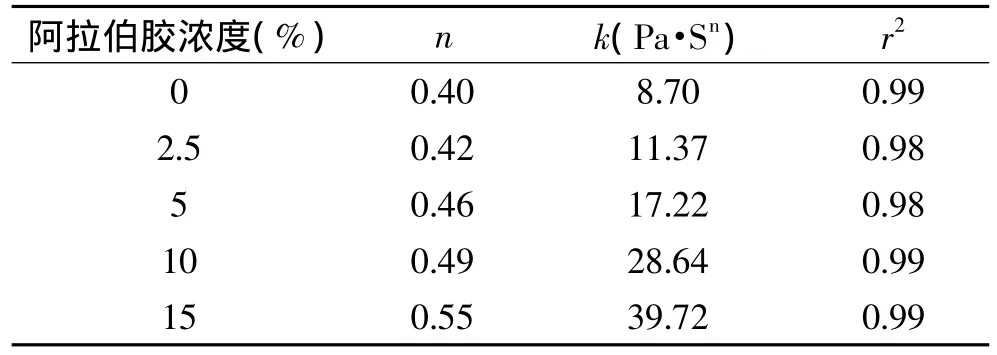
表2 不同阿拉伯胶浓度对WPI-乳状液流变学参数的影响(n为流变行为指数,k为稠度系数)Table 2 Flow behaviour indices(n),consistency coefficients(k)and regression coefficients for emulsions having different gum arabic ratios
4 界面吸附法
乳化剂在油水界面上的动态特性对乳状液的稳定性具有重要影响。在吸附作用下,乳化剂通过分子间非共价作用及共价键交联,不仅可以降低界面张力,还可以在油滴周围形成具有一定粘弹性的薄膜,该薄膜是影响乳状液分散体系稳定性的重要因素。因此,乳状液的稳定性也取决于界面上吸附的乳化剂流变学特性与界面吸附层厚度[13]。
通过界面层吸附含量表征乳清蛋白/壳聚糖混合比、pH对乳状液稳定性的影响(图4)。结果表明随着乳清蛋白/壳聚糖混合比的增加,界面吸附量呈先增大后减小的趋势。pH5.5与pH6.0相比,界面吸附量较多[14]。因此,二者混合比为 5∶1,pH5.5 时,乳状液的稳定性较好
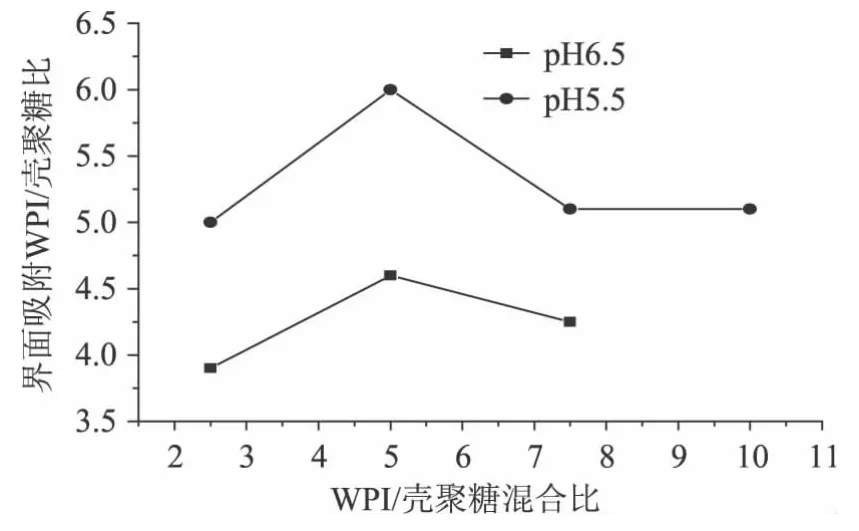
图4 WPI/壳聚糖混合比及pH对乳状液界面吸附量的影响Fig.4 Effect of WPI/CNI on interfacial protein-chitosan load ratio
5 微观结构法
乳状液的稳定性可通过微观结构来考察,利用光学显微镜/原子力显微镜(AFM)/透射电镜(TEM)-摄像-录像-计算机图像采集、处理集成系统,可实现对乳状液界面结构、液滴大小及其分布、液滴运动和团聚的动态过程进行实时观测、录像、图像采集和处理。微观结构分析不破坏乳状液体系的原有组成与分布,因此,在乳状液稳定性研究领域具有广阔的应用前景。
5.1 显微镜观察法
显微镜观察法是通过显微镜观察微粒在整个乳状液体系中的分散情况,从而预测体系的稳定性。该法只检测相对较少的颗粒,采样有可能不具有代表性,误差较大;同时对观察者的经验要求较高,主观性也比较强;因此该方法常只用于作为质量或生产控制的简单判断。
最简单的可视显微镜观察乳状液的微观结构变化,是通过取一滴乳状液,将其置于载玻片上,调节显微镜焦距,放大一定倍数至形成清晰的画面后,将显微镜信息转至CCD软件进行拍照。
采用共聚焦显微镜,可直观观测乳状液的微观结构,分析乳状液的稳定性和界面组成。将1mL乳状液样品中加入40μL混合染料,混合均匀。选择488nm的Ar离子和633nm的He/Ne离子激光预扫描,采集荧光图像。常用的“油”溶性染料是“苏丹Ⅲ”、油溶绿;常用的水溶性燃料是“亮蓝FCF”、酸性红 GG 等[15]。
利用共聚焦显微镜,观察不同制备方法对多重乳状液稳定性的影响。通过染色,可以观察多重乳状液内层与外层组成。由图5可知,经过21d贮藏后,传统两步法制备的多重乳状液,粒径分布均匀,稳定性较好;而双向进料法制备的多重乳状液,液滴发生团聚现象[16]。

图5 不同制备方法对PGPR-WPI(5wt%)多重乳状液(W/O/W)贮藏21d后微观结构的影响Fig.5 Photomicrographs of W/O/W double emulsion stabilized with 5wt.%WPI as an external emulsifier prepared by‘two-step’method
5.2 原子力显微镜(AFM)法
原子力显微镜(AFM)法是取少量样品,加入超纯水稀释一定倍数,经过超声波震荡5min后,使样品分散,然后直接将样品滴到新鲜云母表面,自然风干。采用Agilent 5500原子力显微镜,轻敲(AAC)模式,Si3N4探针观察乳状液的微观结构。为了客观的分析样品的形貌和尺寸,可选择不同区域不同扫描范围进行成像,结果以样品表面形貌的平面图和立体图表征。
通过AFM观察乳状液的微观结构,图6是TW 20乳状液和乳清分离蛋白(WPI)乳状液的AFM图。仔细观察可以发现,乳状液中大部分颗粒呈球形,粒径主要集中在100~200nm间。另外,在TW 20乳状液中,部分颗粒发生团聚,乳状液不稳定。相比之下,WPI乳状液的颗粒分布更为均匀[17],稳定性较好。
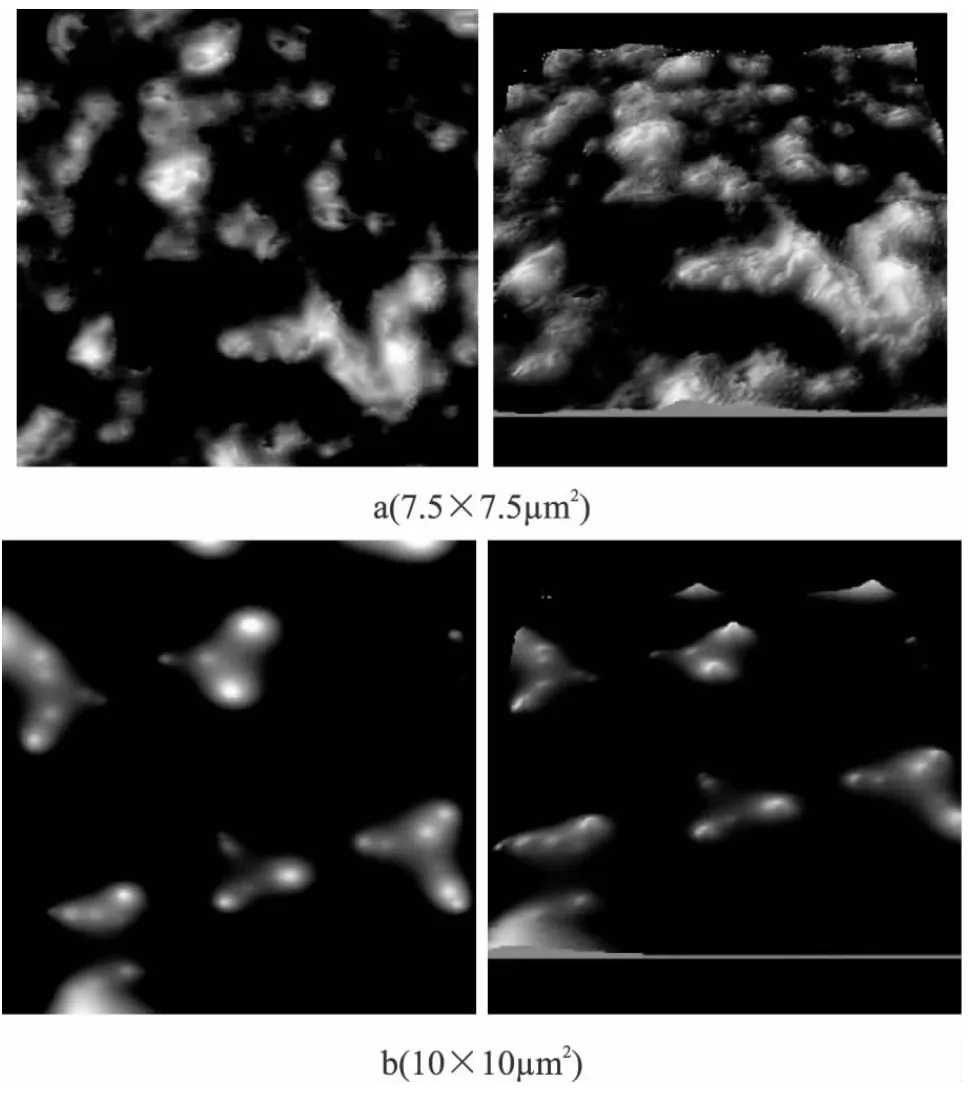
图6 纳米乳状液AFM图Fig.6 Representative AFM images of β-carotene nanoemulsions(prepared at 80MPa and 55℃):
5.3 透射电子显微镜(TEM)法
透射电子显微镜(简称透射电镜,缩写TEM),是将经加速和聚集的电子束投射到非常薄的样品上,电子与样品中的原子碰撞而改变方向,从而产生立体角散射。散射角的大小与样品的密度、厚度相关,因此可以形成明暗不同的影像,影像将在放大、聚焦后在成像器件(如荧光屏、胶片以及感光耦合组件)上显示出来。
通过TEM观察TW 20和纯胶纳米乳状液的微观结构(图7),显示乳状液颗粒以球形为主,部分呈棒状,其中有的颗粒因为团聚呈现不规则形状,尤其是TW 20乳状液的团聚现象较为明显[4]。

图7 纳米乳液TEM图Fig.7 Representative TEM images of β-carotene nanoemulsions prepared at 10 MPa for three cycles.
6 高速离心分析法
高速离心分析法利用高速离心作用,加快体系中油滴的上浮和下降,达到快速分析乳状液稳定性的目的[18]。该方法因需设备较为简单,在食品企业中普遍使用。
实例:利用离心分析法研究大豆分离蛋白乳状液稳定性[19]。具体方法为:在2mL离心管中准确加入2mL乳状液,经高速离心10min,在距离心管底部1cm处取样,测定吸光度值(A500nm)。乳状液稳定性系数用如下公式计算。
乳状液稳定性系数=At/A0
式中:A0为离心前乳状液的吸光度;At为离心后乳状液的吸光度。
7 直观观察法
直观观察法是将乳状液灌装于一定容器内,贮藏在一定温度(通常为 4、25、37、55℃)下,在静置过程中,用肉眼定期观察体系的分层情况。该方法直观、简便,但耗时较长,不能满足现代食品产品研发的需要。
直观观察法的具体操作为:将一定量的乳状液放置于试管中,乳状液的不稳定性表现为,上层为乳析层,下层为相对透明层。不稳定指数通过以下公式计算。
不稳定指数(%)=100×(样品乳析层高度/样品总高度)
8 结论
我国乳状液技术在食品科学领域还处于基础研究阶段,但是它已渗透到食品工业的多个领域。因此,亟待加快发展食品乳状液检测技术。总之,仅使用以上一种方法,往往有一定的局限性(表3)。故应结合多种方法监测乳状液的稳定性,互相印证,才能得到正确的、可靠的结果,以期加深乳化技术在我国食品领域的深入研究与利用。

表3 不同食品乳状液稳定性检测方法的优缺点Table 3 The advantanges and disadvantanges of different measurement methods of food emulsions stabilities
[1]McClements DJ.Emulsion design to improve the delivery of functional lipophilic components[J].In M.P.K.T.R.Doyle(Ed.),Annual Review of Food Science and Technology,2010,1(1):241-269.
[2]Lesmes U,McClements DJ.Structure-function relationships to guide rational design and fabrication of particulate food delivery systems[J].Trends in Food Science & Technology,2009,20(10):448-457.
[3]丰隽莉,王正武,俞惠新,等 .VE 的微乳化研究[J].食品与机械,2006,22(5):36-38.
[4]Mao L,Yang J,Xu D,et al.Effects of homogenization models and emulsifiers on the physicochemical properties of β-carotene nanoemulsions[J].Journal of Dispersion Science and Technology,2010,31:986-993.
[5]Sobisch T,Lerche D.Thickener performance traced by multisample analytical centrifugation[J].Colloids and Surface A:Physicochemical and Engineering Aspects,2008,331(1-2),114-118.
[6]Hou Z,Gao Y,Yuan F,et al.Investigation into the physicochemical stability and rheological properties of β-carotene emulsion stabilized bysoybean solublepolysaccharidesand chitosan[J].Journal of Agricultural and Food Chemistry,2010,58:8604-8611.
[7]Klein M,Aserin A,Svirov I,et al.Enhanced stabilization of cloudy emulsions with gum Arabic and whey protein isolate[J].Colloids and Surfaces B:Biointerfaces,2010,77:75-81.
[8]Dickinson E.Mixed biopolymers at interfaces:Competitive adsorption and multilayer structures[J].Food Hydrocolloids,2011,25(8):1966-1983.
[9]Dickinson E.Hydrocolloids as emulsifiers and emulsion stabilizers[J].Food Hydrocolloids,2009,23(6):1473-1482.
[10]Dickinson E.Hydrocolloids at interfaces and the influence on the properties of dispersed systems[J].Food Hydrocolloids,2003,17(1):25-39.
[11]Diftis NG,Pirzas TA,Kiosseoglou VD.Emulsifying properties of gelatin conjugated to pectin under alkaline conditions[J].Journal of the Science of Food and Agriculture.2005,85:804-808.
[12]Ibanoglu E.Rheological behaviour of whey protein stabilized emulsions in the presence of gum arabic[J].Journal of Food Engineering,2002,52:273-277.
[13]Gancz K,Alexander M,Corredig M.Interactions of high methoxyl pectin with whey proteins at oil/water interfaces at acid pH[J].Journal of Agricultural and Food Chemistry,2005,53(6):2236-2241.
[14]Laplante S,Turgeon SL,Paquin P.Emulsion-stabilizing properties of chitosan in the presence of whey protein isolate:Effect of the mixture ratio,ionic strength and pH[J].Carbohydrate Polymers,2006,65:479-487.
[15]McClements DJ,Li Y.Structured emulsion-based delivery systems:Controlling the digestion and release of lipophilic food components[J].Advances in Colloid and Interface Science,2010,159(2):213-228.
[16]Benichou A,Aserin A,Garti N.W/O/W double emulsions stabilized with WPI-polysaccharide complexes[J].Colloids and Surfaces A:Physicochem Eng Aspects,2007,294:20-32.
[17]Mao L,Xu D,Yang J,et al.Effects of small and large molecule emulsifiers on thecharacteristicsofβ-carotene nanoemulsions prepared by high pressure homogenization[J].Food Technology Biotechnology,2009,47(3):336-342.
[18]王春玲,孟祥晨.乳状液成分对O/W乳状液性质的影响[J].食品工业科技,2012,33(7)36-40.
[19]张芬芬,曾茂茂,何志勇,等.大豆分离蛋白乳状液稳定性的几种分析方法比较[J].食品科学,2012,33(17):44-47.

