细胞代谢组学用于羽扇豆醇干预人乳腺癌细胞MCF-7的机理探究
史栋栋, 况媛媛, 王桂明, 彭章晓, 王 彦, 阎 超
(上海交通大学,上海200240)
代谢组学作为一种系统的研究方法,是通过考察生物体系受刺激或扰动后(如将某个特定的基因变异或环境变化后)其代谢产物的变化或其随时间的变化来研究生物体系的代谢途径的一种技术[1]。它不仅能够研究药物引起的内源性代谢物的变化,还能够研究药物本身的代谢和动力学变化,更能直接反映药物干预下体内生物学变化和动力学变化[2]。通过认识生物体代谢指纹图谱变化的原因,阐明药物的作用机理,用代谢组学方法研究所揭示的生物化学变化很容易与传统手段的测定结果联系,更容易评价药效作用和发现药物作用的生物化学物质基础和作用机制[3]。代谢组中常用的分析平台有GC-MS、LC-MS和NMR 等,其中GC-MS优良的定性和定量分析能力,加上其庞大的化合物谱库为鉴定工作带来了很大的便利,使得GC-MS 在代谢组学研究中显示出突出的优势[4,5]。
羽扇豆醇属于三萜类化合物,广泛存在于水果、蔬菜和中草药等植物中[6]。大量的体外和动物实验证明羽扇豆醇在抗炎、抗菌、抗疟疾、抗恶性肿瘤增殖、抗血管再生等方面有很大的潜能[7],并且已经有实验证明羽扇豆醇对胰腺癌、乳腺癌、前列腺癌、黑色素瘤等肿瘤有明显的抗癌活性[8,9]。因此,羽扇豆醇是具有很大潜力的天然抗肿瘤药物。
本课题以羽扇豆醇作用于乳腺癌细胞,基于GC-MS联用技术发现潜在的生物代谢差异标志物,并结合细胞周期实验结果对羽扇豆醇作用于乳腺癌细胞MCF-7的机理进行深入研究,从代谢组学的角度为羽扇豆醇的抗肿瘤机制提供新的线索。
1 实验部分
1.1 仪器与试剂
PEGASUS 4D GC×GC-TOF/MS(美国LECO公司);LNG-T88 台式快速离心浓缩干燥器、L-35低温冷阱(太仓市华美生化仪器厂);CO2培养箱(美国Thermo公司);XW-80A 漩涡混合器(上海青浦沪西仪器厂);倒置显微镜(日本Olympus公司);96孔培养板(丹麦Nunc公司);全自动酶标分析仪(美国Thermo公司);流式细胞仪FACSCalibur(美国BD 公司);
胎牛血清购于美国Gibco公司,DMEM/HIGH GLUCOSE DMEM 培养基、PBS(磷酸盐)缓冲液、胰蛋白酶均购于赛默飞世尔生物化学制品有限公司(北京);四甲基偶氮唑盐(MTT)、碘化丙啶(PI)、RNaseA 酶购于美国Sigma公司;二甲基亚砜(DMSO)购于国药集团化学试剂有限公司;甲醇(HPLC级,德国Merck公司);吡啶(分析纯)购于国药集团化学试剂有限公司;硅烷化试剂N,O-双三甲基硅基三氟乙酰胺(BSTFA)(含1% 三甲基氯硅烷(TMCS))购自上海安谱科学仪器有限公司;甲氧胺、2-氯苯丙氨酸均购自美国Sigma公司。
人乳腺癌细胞MCF-7购于中国科学院上海细胞库。
1.2 MTT 实验测定羽扇豆醇对细胞增殖的影响
将MCF-7 细胞培养于含10%的胎牛血清的DMEM 培养液中,置于5%CO2、37 ℃恒温箱中培养,取对数生长期细胞,加入0.25%胰蛋白酶消化后,配成含量为4×104个细胞/mL,接种于96 孔板,每孔接种100μL(4×103个细胞/孔)。培养12 h后添加药物羽扇豆醇,使其质量浓度梯度为10、25、50、100、200μg/mL。每组5个复孔。加完药后置于5%CO2培养箱中,于37 ℃恒温下继续培养。继续培养的时间梯度为24、48、72 h。然后加入20 μL5 mg/mL的MTT溶液,再继续培养4 h,吸取上清液,每孔加入150μL DMSO,酶标仪测定570 nm处的吸光度(A),计算平均吸光度和抑制率。抑制率=(对照组的A 值-实验组的A 值)/(对照组A值-空白组A 值)×100%。
1.3 细胞提取及衍生方法
取一皿对数生长期的细胞,倒掉培养基,用生理盐水(0.9%NaCl水溶液)清洗3遍以去除培养基中复杂物质的影响。清洗完毕后,液氮猝灭以防止活细胞在环境变化下代谢发生变化,影响代谢物的考察。液氮猝灭后,每皿加入1 000μL 甲醇-水(4∶1,v/v)溶液,用细胞刮刀刮下细胞置于样品瓶(玻璃)中,在样品瓶中加入少量氯仿(体积为前述甲醇-水溶液体积的1、5),使得细胞中的非极性成分溶在提取液中。然后加入10μL 0.3 mg/mL 的2-氯苯丙氨酸作为内标。涡漩,于4 ℃细胞超声破碎仪中破碎细胞(功率20%,破碎3 min,期间开5 s,关5 s),使代谢物质全部溶出,更加全面地提取代谢物。在4 ℃、4 000 r/min下离心15 min,去除大分子蛋白等物质。
取800μL上述上清液至GC 进样瓶中,室温下真空干燥,用氮气对样品进行再次干燥后,加入80 μL甲氧胺(15 mg/mL,溶剂为吡啶),混合1 min,于30℃下反应90 min后,加入80μL BSTFA 和40 μL正己烷,于70 ℃下反应90 min。
1.4 GC-TOF/MS条件
色谱柱为DB-5MS 色谱柱(30 m×250μm×0.25μm,安捷伦科技有限公司);进样量为1μL。进样口温度为270℃,程序升温:起始温度为80℃,保持2 min,以10℃/min升至180 ℃,以5 ℃/min升至240 ℃,以5 ℃/min升至290 ℃,保持9 min。接口温度为260 ℃;离子源温度为200 ℃。载气为氦气,载气流速为1 mL/min。电子能量70 eV,全扫描方式,扫描范围为m/z 30~600,以20张/s的速率采集TOF质谱图。
1.5 数据统计方式
将GC-MS 获得的所有原始质谱数据通过ChromaTOF软件(v3.30,Leco Co.,USA)转化成CDF格式,然后用ChromaTOF软件对数据进行峰识别、峰对齐、基线矫正、峰面积归一化预处理。导入SIMCA-P 11.5软件进行多维分析。在本实验中采用正交偏最小方差判别分析(OPLS-DA)模型区别各组代谢物差异。结合评价OPLS-DA 模型质量的3 个 关 键 指 标(R2X,概 括X 矩 阵 结 实 率;R2Ycum,反映模型 的 稳 定 性;Q2Ycum 反 映 模 型 的预 测 性;其 中R2Ycum 和Q2Ycum 越 接 近1说 明 模型的稳定性和预测性越好)及根据OPLS-DA 模型得到的变量权重值(VIP,variable importance in the projection)找到潜在的代谢差异物(其VIP>1)。实验中采用了t 检验,以验证多维统计中得到的差异物是否具有显著差异[10]。搜索数据库为NIST数据库。
1.6 羽扇豆醇对MCF-7细胞周期的影响
为了进一步确认羽扇豆醇对MCF-7细胞的抑制作用,并且为全面阐述羽扇豆醇抑制MCF-7细胞的作用机理,本实验进行了细胞周期实验。
取一皿对数生长期的细胞,接种于6孔板中,使得每孔有3×105个细胞。培养12 h后,分别加入25μg/mL和50μg/mL羽扇豆醇,作用24 h。24 h后,加入胰蛋白酶消化细胞至细胞可以用移液管或枪头轻轻吹打下来时,轻轻吹散细胞,将其收集到离心管内。于约1 000 g离心力下离心3~5 min,沉淀细胞。小心吸除上清液,残留约50μL左右的培养液以避免吸走细胞。加入约1 mL预冷的PBS缓冲液,重悬细胞,并转移到1.5 mL离心管内。再次离心沉淀细胞,小心吸除上清液,残留约50μL左右的PBS缓冲液以避免吸走细胞。轻轻弹击离心管以适当分散细胞以避免细胞成团。
细胞固定:加入1 mL预冷至4℃的70%(v/v)乙醇水溶液,轻轻吹打混匀。固定12 h后于1 000 g左右离心力下离心3~5 min,沉淀细胞。小心吸除上清液,残留约50μL 左右的70%乙醇,以避免吸走细胞。加入约1 mL预冷的PBS缓冲液,重悬细胞。再次离心沉淀细胞,小心吸除上清液,轻轻弹击离心管以适当分散细胞,避免细胞成团。
染色后进行流式细胞检测和分析。
2 结果与讨论
2.1 羽扇豆醇对乳腺癌细胞MCF-7的抑制作用
图1为5个浓度梯度的羽扇豆醇和3个作用时间对乳腺癌细胞MCF-7增殖的影响。由图1可以明显地看出,在羽扇豆醇作用时间为24 h,作用浓度为10和25μg/mL时,抑制率低于10%,对MCF-7细胞没有明显的抑制作用。而当羽扇豆醇的浓度增加到50μg/mL 以上时,抑制率明显上升,均在70%以上,并且50、100和200μg/mL 羽扇豆醇的抑制作用没有明显的差异。当作用时间增加到48和72 h时,抑制作用更加明显,且高浓度的抑制效果好于低浓度。实验结果说明,羽扇豆醇对乳腺癌细胞MCF-7的抑制作用不仅有时间依赖性,也具有浓度依赖性。与文献[11,12]报道的羽扇豆醇对乳腺癌细胞有抑制作用的研究结果一致。
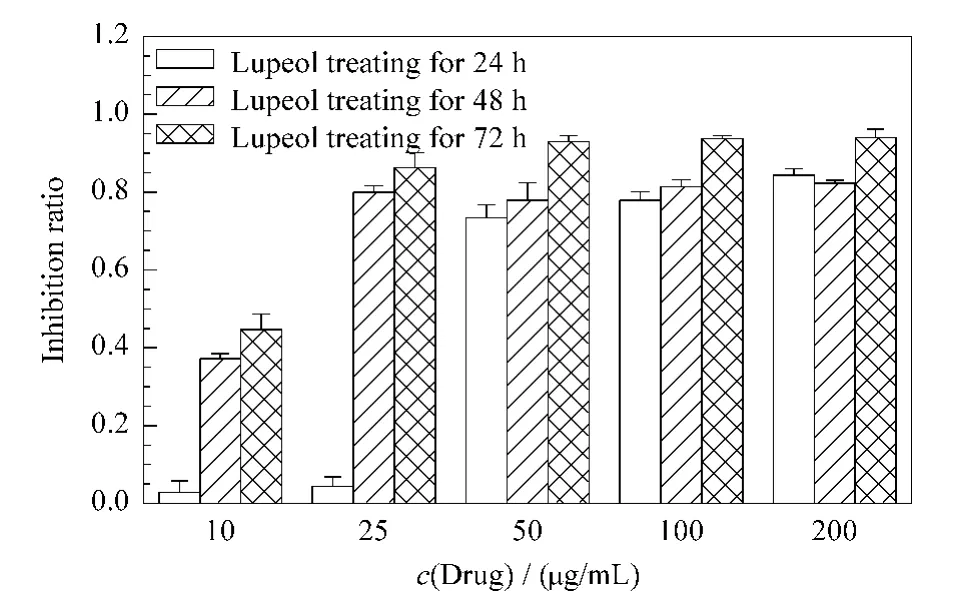
图1 羽扇豆醇浓度及作用时间对MCF-7细胞增殖的影响Fig.1 Inhibition effects of lupeol with different concentrations and reaction times on the proliferation of MCF-7 cells
2.2 基于GC-TOF/MS技术的细胞代谢组学分析
MTT实验结果显示,当羽扇豆醇的作用浓度高于25μg/mL时,对MCF-7细胞的抑制率基本都在70%以上。由于细胞代谢组学使用的代谢物均为活细胞的代谢物,因此选择羽扇豆醇作用浓度和作用时间时不仅要考虑其对MCF-7细胞的抑制作用,还要考虑保持MCF-7细胞的低致死率,因此最终选择羽扇豆醇的作用浓度和作用时间分别为10 μg/mL和24 h。以前述甲醇-水混合液与三氯甲烷的5∶1(v/v)混合液为提取液,液液萃取提取细胞代谢物,经硅烷衍生化后利用GC-MS 技术分析细胞代谢物。图2为其中典型的MCF-7细胞对照组和羽扇豆醇24 h作用组的GC-TOF/MS代谢物谱图,在S/N=10时,MCF-7细胞的代谢谱图的分子特 征峰个数在500~600之间。

图2 MCF-7细胞对照组和10μg/mL羽扇豆醇作用24 h干预组代谢物的GC-TOF/MS基峰色谱图Fig.2 Typical GC-TOF/MS base peak chromatograms of metabolite profiles of control MCF-7 cells and10μg/mL lupeol treated MCF-7 cells for 24 h
羽扇豆醇分别作用于MCF-7细胞6、12和24 h后,在上述优化的色谱条件下,分别对细胞样品进行分析,采集GC-TOF/MS 数据并进行多维统计处理。
考虑到干扰因素的复杂性,为了消除非药物作用的影响,最大化组间分离,并寻找各组间的差异代谢物,利用有监督的OPLS-DA 方法去除与样品分类无关的信息,对不同时间点样本的细胞代谢全谱进行分析。图3 显示的是GC-TOF/MS 细胞代谢物全谱数据的OPLS-DA 得分图,该模型包含4 个主成分,R2Ycum=0.988,Q2Ycum=0.964,说 明模型的稳定性和预测率较高;且得分图显示对照组与给药组样本能明显区分,作用24 h的差异物区别最大。
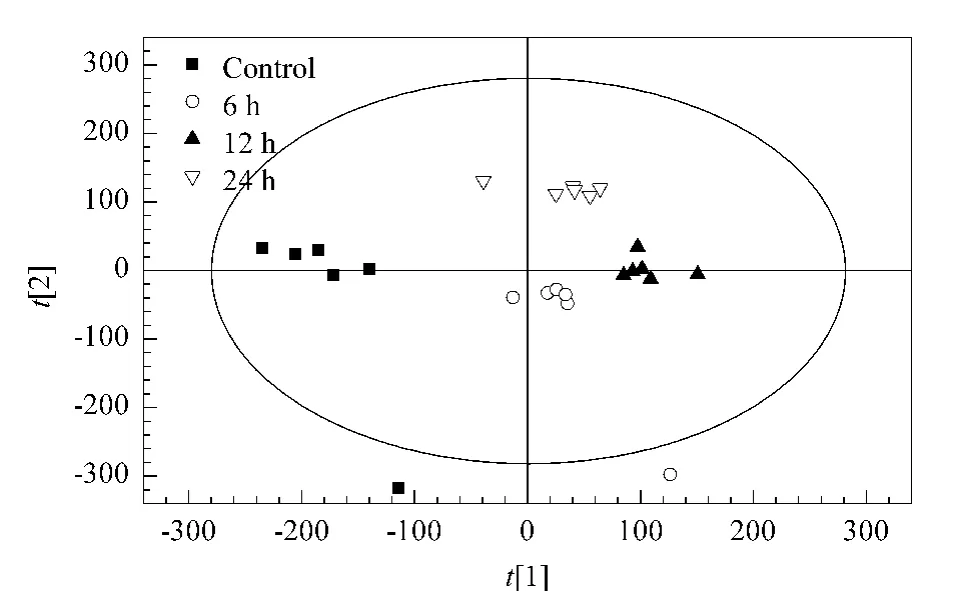
图3 人乳腺癌细胞MCF-7代谢物的OPLS-DA 分类图Fig.3 OPLS-DA results of metabolites of MCF-7 breast cancer cells
VIP值是OPLS-DA 有监督性分析方法中评价变量贡献的最常用方法,根据VIP>1.0和p 值<0.05(t-test),通过NIST 和标准库,对一些具有显著性差异的物质进行了初步的结构鉴别。本实验单独将差异性最大的对照组和羽扇豆醇24 h作用组两组进行OPLS-DA 模型分析,获得了11种细胞代谢差异物(见表1)。
在肿瘤细胞代谢物中,丙氨酸、天冬氨酸、脯氨酸、琥珀酸、甘露糖和核糖醇的含量下降。亮氨酸、异亮氨酸、甘氨酸、天冬酰胺和磷酸的含量上升。琥珀酸的含量下降、磷酸的含量上升可能是羽扇豆醇破坏了MCF-7细胞能量代谢途径三羧酸循环造成的[13]。亮氨酸、异亮氨酸、甘氨酸、天冬酰胺均可以通过转氨作用脱掉α-氨基生成有机酸类物质,再通过分解代谢作用而生成三羧酸循环的底物,作为能量的来源[14]。也有可能是三羧酸循环受到了抑制。丙氨酸、脯氨酸、天冬氨酸的含量下降,可能是因为药物抑制了MCF-7细胞的氨基酸代谢[15]。
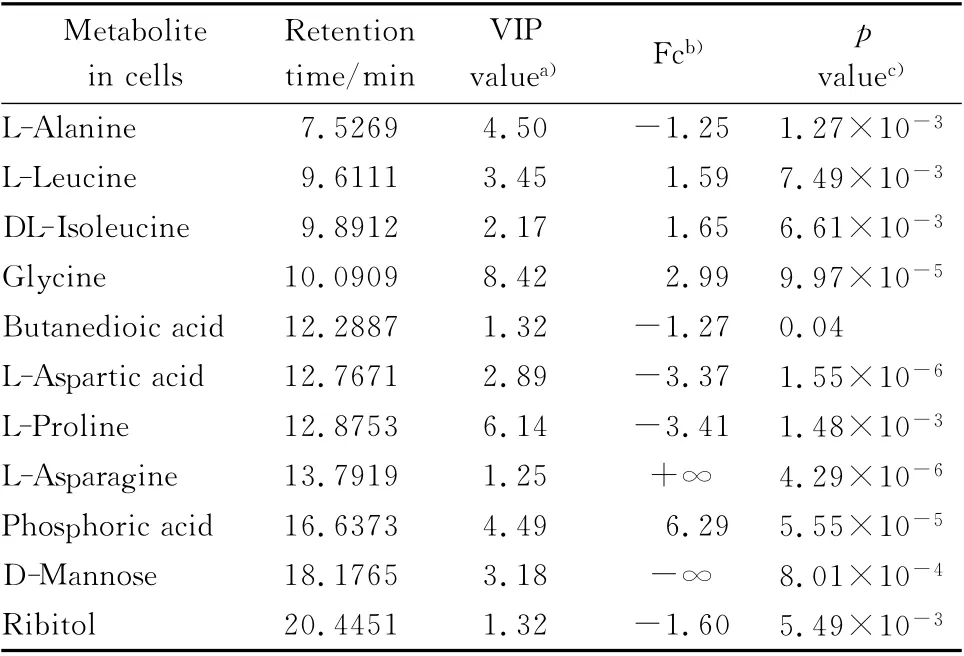
表1 GC-TOF/MS分析人乳腺癌细胞MCF-7对照组与羽扇豆醇24 h作用组代谢差异物的鉴定结果Table 1 List of identified differential metabolites of MCF-7 breast cancer cells in lupeol 24 h treatment group as measured by GC-TOF/MS
2.3 细胞周期分析
基于代谢组学数据,为了进一步研究羽扇豆醇作用于MCF-7细胞后的作用机制,我们考察了羽扇豆醇对MCF-7细胞周期的影响。在这个实验中,羽扇豆醇作用时间为24 h,作用浓度为25μg/mL 和50μg/mL。结果见图4和表2。首先溶剂对于细胞几乎没有影响。在排除溶剂影响的前提下,羽扇豆醇主要将细胞抑制在细胞周期的G1期(synthesis)。羽扇豆醇作用浓度为25μg/mL 和50μg/mL 时,G1期细胞所占比例从50.92%分别增长到61.69%和63.61%。同时S 期的细胞数量显著下降,推测可能是由于羽扇豆醇抑制了MCF-7细胞中蛋白质和能量的合成,从而使得停留在G1 期的细胞数量上升,S期的数量下降[16]。
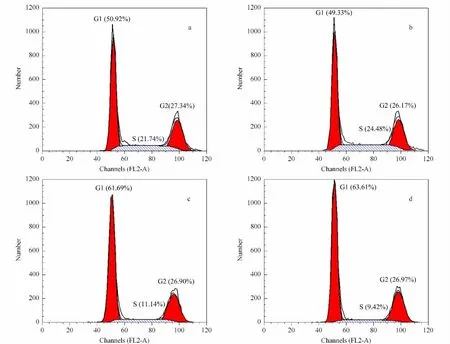
图4 羽扇豆醇作用于MCF-7细胞24 h的细胞周期图Fig.4 Distributions of cellular DNA in control MCF-7 cells and lupeol treated MCF-7 cells for 24 h,determined by FCM (flow cytometry)and the occupation of cell phase in all cells
2.4 代谢差异物及作用机理推测
G1期细胞内进行着一系列极为复杂的生物合成变化,如合成各种核糖核酸(RNA)及核蛋白体,这些物质的形成导致结构蛋白和酶蛋白的形成,为S期DNA 的复制准备物质和能量[17]。羽扇豆醇将细胞阻滞在G1期,所以推测羽扇豆醇的作用机理可能与能量和蛋白质的合成有关。
琥珀酸是三羧酸循环的中间代谢产物[18],它的含量下降,磷酸、亮氨酸、异亮氨酸、甘氨酸、天冬酰胺的含量上升,均可能是因为三羧酸循环受到了抑制。三羧酸循环是机体获得能量的主要方式,是机体将糖或其他物质氧化而获得能量的最有效方式。在琥珀酸硫激酶(succinatethiokinase)的作用下,琥珀酰-CoA的硫酯键水解,释放的自由能用于合成三磷酸鸟苷(guanosine triphosphate,GTP),再生成ATP,作为能量的来源。羽扇豆醇可能抑制了琥珀酸硫激酶的活性而使得底物磷酸化的反应受到抑制,磷酸的含量上升。而琥珀酸脱氢酶的活性受到抑制后,琥珀酸的含量下降。
综合分析,羽扇豆醇主要抑制了细胞中的能量代谢途径三羧酸循环,使得细胞在G1 期不能够充分地准备S 期进行DNA 复制所需要的能量和物质,从而使得G1期细胞数量大量上升,S期细胞数量急剧下降。
3 结论
本文以GC-MS技术为平台,通过多元统计分析等手段探索了羽扇豆醇作用于MCF-7细胞后细胞代谢物的变化,结果表明加药组和未加药组存在显著的差异。对具有显著性差异的物质进行分析,得到了L-丙氨酸、磷酸等11 种代谢差异物。并结合羽扇豆醇将MCF-7 细胞抑制在G1 期的细胞周期实验结果,推测羽扇豆醇主要通过抑制三羧酸循环代谢途径中琥珀酰辅酶A 的生成和底物磷酸化生成ATP的反应来抑制MCF-7细胞的增殖。
本研究利用代谢组学的方法研究中药活性物质作用于细胞的生物化学变化,并且与传统手段的测定结果相联系,为药物的机理研究提供了一种新的有效平台。
[1] Xu G W,Yang J.Chinese Journal of Chromatography(许国旺,杨军.色谱),2003,21(4):316
[2] Saleem M,Kweon M H,Yun J M,et al.Cancer Res,2005,65(23):11203
[3] Xia J F,Liang Q L,Hu P,et al.Chinese Journal of Analytical Chemistry(夏建飞,梁琼麟,胡坪,等.分析化学),2009,37(1):136
[4] Huang Q,Yin P Y,Lu X,et al.Chinese Journal of Chromatography(黄强,尹沛源,路鑫,等.色谱),2009,27(5):566
[5] Zhou J,Wang S Y,Chang Y W,et al.Chinese Journal of Chromatography(周佳,王霜原,常玉玮,等.色谱),2012,30(10):1037
[6] Beveridge T H,Li T S,Drover J C.J Agric Food Chem,2002,50(4):744
[7] Hifzur R S,Mohammad S.Life Sci,2011,88:285
[8] Mohammad S,Imtiyaz M,Olya W,et al.Biochem Biophys Res Commun,2009,388:576
[9] Mostafa M G,Larsen M T,Love R R.J Bangladesh Coll Phys Surg,2010,28(3):157
[10] Yu X W,Wu Q,LüW,et al.Chinese Journal of Chromatography(余欣慰,吴谦,吕望,等.色谱),2013,31(7):691
[11] Lu H M,Liang Y Z.Journal of Instrumental Analysis(卢红梅,梁逸曾.分析测试学报),2008,27(3):325
[12] Saleem M.Cancer Lett,2009,285(2):109
[13] Jia W.Medical Metabonomics.Shanghai:Shanghai Science and Technique Publishing House(贾伟.医学代谢组学.上海:上海科学与技术出版社),2011:52
[14] Huang Y S,Zhang G Y.Biochemistry and Molecular Biology.Beijing:Science Press(黄诒森,张光毅.生物化学与分子生物学.北京:科学出版社),2008:173
[15] DeBerardinis R J,Lum J J,Hatzivassiliou G,et al.Cell Metab,DOI:10.1016/j.cmet.2007.10.002
[16] Sporn M B,Suh N.Carcinogenesis,2000,21:525
[17] Sherr C J,Roberts J M.Genes Dev,1999,13:1501
[18] He H B,Shi X Z,Chen J,et al.Chinese Journal of Chromatography(和红兵,石先哲,陈静,等.色谱),2012,30(3):245

